2021 年 61 巻 12 号 p. 833-838
2021 年 61 巻 12 号 p. 833-838
症例は85歳男性.2017年夏から関節リウマチに対しサラゾスルファピリジン(salazosulfapyridine,以下SASPと略記)が開始された.2018年12月に左手指の筋力低下を自覚し,2ヶ月後には左上肢重度麻痺に至った.頭部MRIで右中心前回近傍白質に異常信号を認め,進行性多巣性白質脳症(progressive multifocal leukoencephalopathy,以下PMLと略記)が疑われた.髄液JCV-DNA陽性と脳生検で抗VP-1抗体免疫染色陽性細胞を確認し診断を確定した.被疑薬としてSASPを中止したところ,左上肢麻痺は速やかに改善傾向に転じ,自然経過で約1年後には正常機能に回復し,白質病巣の縮小も認めた.SASPによるPMLの既報告はないが,経過よりSASPの関与が疑われた.
Progressive multifocal leukoencephalopathy (PML) is a rare opportunistic infection caused by JC virus (JCV) activation. We report an 85-years old man who had been diagnosed to have rheumatoid arthritis (RA) 1.5 years prior to diagnosis of PML, and had been treated with salazosulfapyridine (SASP). He developed weakness of the left upper limb, which progressed gradually for two months. A neurological examination on admission revealed severe palsy of the left upper limb without sensory disturbance, cognitive decline or gait disturbance. Brain MRI revealed white matter lesions in the right frontal lobe around the precentral gyrus. Cerebrospinal fluid (CSF) examination and peripheral lymphocyte counts were normal. HIV was ruled out serologically. There were no findings suggestive of malignancy. We suspected PML and stopped SASP. JCV-DNA was detected in CSF. There were enlarged nuclei positive with VP-1 immunostaining in the brain biopsy materials. Thus, the diagnosis of PML was definitive. Paralysis of the left upper limb began to improve one week after discontinuing SASP. Treatment with mefloquine and mirtazapine was initiated, but he developed severe interstitial pneumonia, which might be caused by mefloquine. Therefore, he underwent rehabilitation without medication. JCV-DNA became undetectable and white matter lesions decreased 6 months later. Paralysis improved and he had no problem with activities of daily living a year later. The risk factor for PML has changed over the last decade, and drugs such as biologics became significant risk factors for patients with autoimmune diseases. There are reports suggesting that systemic lupus erythematosus (SLE) and RA themselves might be independent risk factors for PML. Although there is no previous report of SASP inducing PML, SASP might be the culprit in our case. However, there is another possibility that SAPS and RA worked synergistically for the onset of PML.
進行性多巣性白質脳症(progressive multifocal leukoencephalopathy,以下PMLと略記)は,免疫機能低下が背景にある患者の脳白質にJCウィルス(JC virus,以下JCVと略記)が感染することによる進行性脱髄疾患である.かつて欧米ではPML発症者の約8割をHIV感染患者が占めていたが1),多剤併用抗レトロウィルス療法(combination antiretroviral therapy,以下cARTと略記)の導入によりHIV関連PMLは減少している.一方,近年では分子標的薬導入により自己免疫疾患やがんでのPML発生が増加傾向にある2)~4).今回,関節リウマチ(rheumatoid arthritis,以下RAと略記)に対して投与されていたサラゾスルファピリジン(salazosulfapyridine,以下SASPと略記)の関与が疑われるPML症例を経験したので報告する.
症例:85歳,男性
主訴:左上肢脱力
既往歴:61歳 心筋梗塞.
77歳 前立腺癌(CAB療法,放射線治療にて治癒).
83歳時にRAと診断され内服治療継続中.
家族歴:特記事項なし.
現病歴:2017年夏からRAに対し経口ステロイドとSASPが開始され,同年末よりSASP単剤に移行した.2018年12月に左手指の筋力低下を自覚し,2019年1月に筋力低下が左手関節に,2月には左上肢近位筋にまで拡大した.頭部MRIで右中心前回近傍白質に異常信号を認め,当科へ紹介入院となった.
所見:初診時,左上肢に感覚障害を伴わない重度麻痺(MMT左上肢遠位筋0~2,左上肢近位筋4)を認め,脳神経系,右上肢および両下肢の運動感覚系は正常で,高次脳機能にも異常を認めなかった.頭部MRI画像では右中心前回近傍白質の病巣が経時的に右頭頂葉白質にまで拡大しており,FLAIR・T2強調画像・ADCで高信号,T1強調画像で等~低信号を呈し,病巣辺縁に不均一な造影効果がみられた(Fig. 1, 2).血液検査はHIV陰性,白血球数正常で有意な異常を認めなかった.髄液検査は細胞数2/mm3,蛋白46 mg/dlで特異な所見を認めず細胞診陰性であった.体幹造影CT,Gaシンチグラフィ,ランダム皮膚生検でも異常所見を認めなかった.

MRI obtained 6 weeks (A) and 2 weeks (B) before discontinuation of salazosulfapyridine (SASP), on the day of discontinuation of SASP (C), as well as 7 weeks (D), 4 months (E) and 7 months (F) after discontinuation of SASP. Axial T2 WI and FLAIR showed high intensity lesions only in the white matter of the right frontal lobe around the precentral gyrus and the parietal lobe. The lesions became enlarged during treatment with SASP(A–C). After discontinuation of SASP, the lesions gradually became smaller (D–F).

DWI (A) showed low intensity lesions in the core and high intensity lesions in the rim. ADC (B) and FLAIR (C) showed high intensity lesions in the white matter. T1WI with Gd enhancement (D) showed partially enhancing rims of the white matter lesions.
経過:感覚障害を伴わない左上肢の重度麻痺が亜急性に進行し,3月初旬には左手指機能が全廃し左上肢挙上困難に至った.全身および頭蓋内に腫瘍を疑う所見は認められず,PMLを疑い髄液JCV-DNA検査を提出し,脳腫瘍鑑別および確定診断目的に脳生検を施行した.また,RA症状は寛解していたためSASPを中断した.後日に髄液JCV-DNA陽性(139コピー/ml)が確認され,脳生検で抗VP-1抗体免疫染色強陽性(Fig. 3)を認めたことから,PMLと診断した.病理では,白質優位にグリオーシスを認め,KB染色で髄鞘染色性が低下していた他に,CD3染色陽性細胞(T細胞)の白質浸潤が認められた.SASP中止1週間後から左上肢麻痺に改善傾向がみられ始めたが,頭部MRI画像に明らかな変化が認められなかったため,SASP中止約1ヶ月後からメフロキン(3日間250 mg/日投与後,週1回250 mg),ミルタザピン(15 mg/日)併用療法(院内倫理委員会にて治療材料・医薬品などの適応外患者限定使用承認を取得:承認日2019年3月26日)を開始した.しかし,投与開始から約1ヶ月半後に,重症間質性肺炎を併発し,一時は人工呼吸管理が必要となった.気管支肺胞洗浄液の薬剤リンパ球刺激試験でメフロキンが被疑薬として疑われたため,以降はメフロキン・ミルタザピンを中止し,リハビリテーション継続のみで経過をフォローした.間質性肺炎に対してはメチルプレドニゾロンパルス療法(1 g/日×3日間,1クール)後にプレドニゾロン60 mg/日から漸減療法が導入され,SASP中止4ヶ月後からは10 mg/日以下で継続された.左上肢麻痺は経時的に改善し,SASP中止1年後には左手指巧緻動作を含め左上肢機能は正常に回復した.頭部MRI画像では病巣の縮小を認め(Fig. 1),SASP中止半年後に髄液JCV-DNA再検査で陰性を確認した.臨床経過をFig. 4に示す.また,経過を通して高次脳機能障害は全く認められず,SASP中止後にRA症状の再燃は認められなかったため,間質性肺炎に対するPSL以外に追加治療は行われなかった.診断から2年経過した時点で,臨床症状再発はなく,発症前と同様の日常生活を送っている.本症例は,SASP単剤療法中にPMLを発症し,SASP中止のみで臨床症状および画像所見に改善がみられたことから,RA患者のPMLにSASPが関与した可能性が考えられた.

(A) The white matter with severe gliosis showed glial cells (arrows) with enlarged nuclei, filled with homogeneous material (Hematoxylin-eosin staining, Bar = 50 μm).
(B) These glial cells (brown) were immunopositive for antibody recognizing JC virus capsid protein (VP-1) (Immunohistochemistry, Bar = 100 μm).
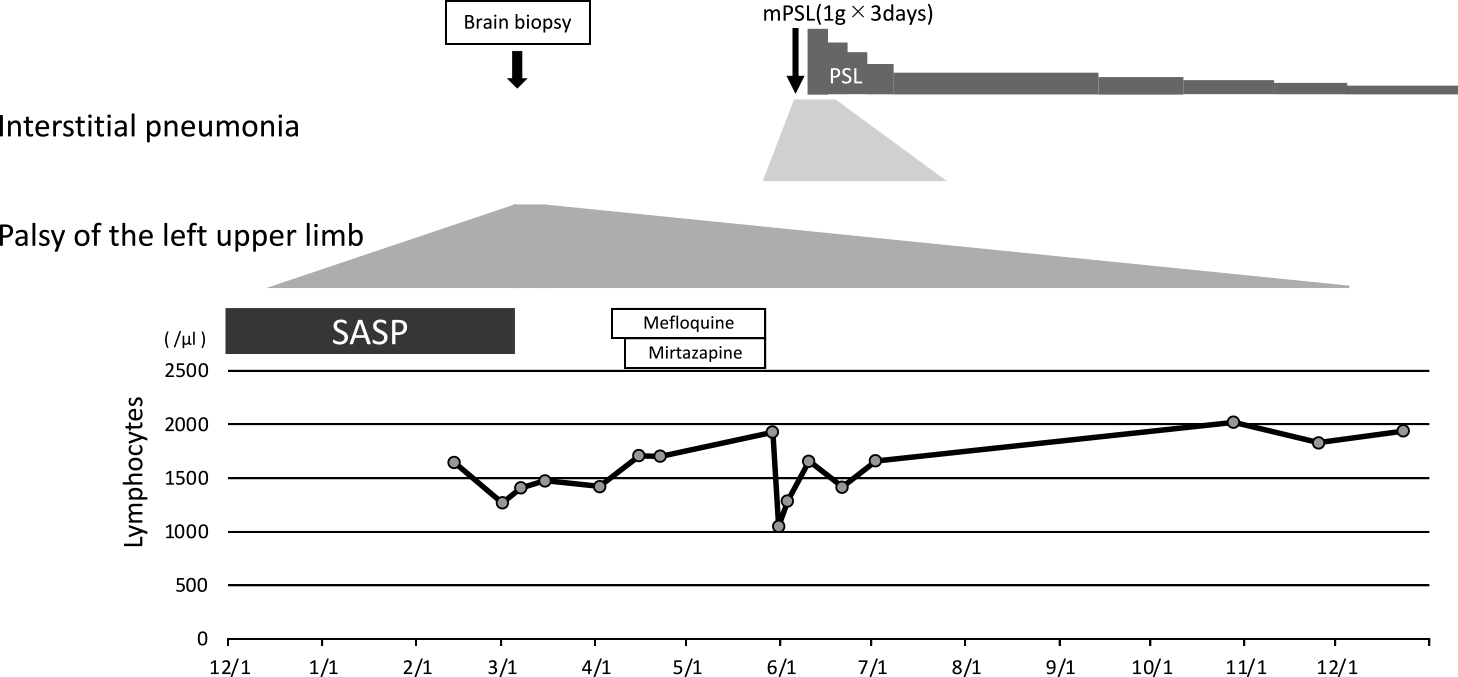
The upper part of the figure presents medication and clinical manifestations, whereas the lower part presents blood lymphocyte counts (per ul) over time.
PMLの基礎疾患は,cART療法が導入される以前は大多数をHIV/AIDSが占めていた.しかし,近年では生物学的製剤や分子標的薬の導入により,海外だけでなく国内でも,がんや自己免疫疾患が占める割合が年々増加している.フィンランドでの2014年まで16年間の調査では,HIVは2012年以降報告されておらず,自己免疫疾患は2009年まで報告されていなかったが,以降は増加傾向にある4).PML基礎疾患に関する調査結果をTable 1に示す1)3)5)6).PMLを発症した自己免疫疾患の内訳は,全身性エリテマトーデス(systemic lupus erythematosus,以下SLEと略記)が最も多く,次いでRAの報告が多い.Molloyらは自己免疫疾患関連PML 92例中,SLEが47%,RAが26%を占めており,発症頻度は,SLEが一般人口の約10倍,RAが2倍だったと報告している1).
| Period | Country | HIV/AIDS (%) | Hematologic malignancy (%) | Solid tumor (%) | Autoimmune diseases (%) | Multiple sclerosis (%) | Reference |
|---|---|---|---|---|---|---|---|
| 1998–2005 | USA | 82.00 | 8.40 | 2.83 | 0.95 | — | 1) |
| 1988–1992 | Sweden | 43 | 36 | 21* | 0† | — | 3) |
| 1993–1997 | Sweden | 64 | 27 | 0 | 5† | — | 3) |
| 1998–2002 | Sweden | 38 | 31 | 15* | 15† | — | 3) |
| 2003–2007 | Sweden | 20 | 27 | 20* | 20† | — | 3) |
| 2008–2013 | Sweden | 11 | 34 | 7* | 39† | — | 3) |
| 2007.4.–2011.3. | Japan | 33.3 | 39.5‡ | 0 | 6.2 | 0 | 5) |
| 2016.12.–2019.11. | Japan | 11.6 | 35‡ | 35 | 23 | 5 | 6) |
The table shows changes in the ratio of underlying diseases which induced PML in different countries during the stated time period. * includes organ transplants, † includes multiple sclerosis, whereas ‡ includes hematologic disorders.
PML発症要因は明らかではないが,CD4リンパ球減少症など宿主固有の因子7)8),ウィルス自体の構造変化などのウィルス因子,分子標的薬や疾患修飾薬などの使用による免疫抑制因子が挙げられている9).自己免疫疾患関連PML 34例の調査では,15例で1剤以上の分子標的薬・生物学的製剤が投与されており,他の19例では非生物学的疾患修飾抗リウマチ薬のみが投与されていた2).Calabreseらは2015年に薬剤をPML発症リスク別に3群にグループ化し,Class 1(high risk)はnatalizumabとefalizumabの2剤,Class 2(low risk)はrituximab,belimumabの生物学的製剤とcyclophosphamideなどの非生物学的製剤,Class 3(very low risk)は抗TNFα薬,tocilizumabなどが挙げられている10).
一方,SLE合併PMLの文献的検討では,35例中3例はPML診断時に免疫抑制薬が投与されておらず,5例で15 mg/日以下の低容量プレドニゾロンか抗マラリア薬しか投与されていなかった11).別の報告でも,SLE合併PML 20例中1例でPML診断時に免疫抑制薬が投与されておらず,8例で15 mg/日以下の低容量プレドニゾロンか抗マラリア薬しか投与されていなかった12).このことより,PML発症に関わる宿主固有の因子としてSLE自体がリスクファクターとなっているとの見解もある9)11).RAは,PML発症率が一般人口と比較し約2~3倍高いとする報告があり1)13),SLEに次いでPML発症が多い自己免疫疾患であることから,RAもSLEと同様に疾患自体がリスクとなっている可能性が示唆されている14).RA合併PMLで詳細が判明している投与薬剤はrituximab(RTX),infliximab,methotrexate(MTX),leflunomide(LEF),chlorambucil(CHL),glucocorticoids(GCs),cyclophosphamide(CYC),azathioprine(AZA),hydroxychloroquine(HCQ)で,これまでRAで被疑薬の投与がないか,あるいは投与歴がSASPのみであるPML症例の既報は見つからなかった.
SASPは免疫調整薬で,潰瘍性大腸炎に対しても使用されている.明確な作用機序は不明であるが,腸に到達したSASPのうち3分の1は小腸から吸収された後に免疫細胞に作用し,IL-1,IL-2,IL-6などの作用を抑制することで炎症抑制効果を発揮し,RAによる異常抗体産生過程も抑制していると考えられている.SASPによるPML発症の既報はないが,本例ではステロイド投与が直近でされておらず,SASP中止後に神経症状が改善したことから,SASPがRA患者のPML発症に関与した可能性が考えられた.一方,メフロキン・ミルタザピンは,重症間質性肺炎を合併したため約2ヶ月間しか投与出来ておらず,症状および画像所見の改善はSASP中止による自然経過とも考えられる.SASPは潰瘍性大腸炎に対して広く投与されている薬剤であるが,これまでSASPを投与された潰瘍性大腸炎でのPML発症の既報はない.本例ではRAが発症に影響を及ぼした可能性もあるが,RAとSASPの両者が共同でPML発症に関与した可能性もある.
本例の頭部造影MRIでは,病巣に造影効果がみられ,病理で白質にT細胞浸潤が認められた.一般的に,HIV関連PMLでは造影効果は見られず,病理学的に炎症細胞浸潤も認めないとされている.しかし,HIV以前の1970年代には病理で炎症細胞浸潤を認め長期生存した非典型な症例が報告されており15),1990年代には造影効果がみられた部位の生検病理でしばしば炎症細胞浸潤が見られ,HIV合併や抗ウィルス薬投与の有無に関わらず,炎症細胞浸潤を伴ったPML患者のほうが,伴っていないPML患者よりも生存期間が長かったと報告されている16).2005年以降報告されるようになったナタリズマブ関連PMLでは初回診断時の画像で約40%に造影効果が認められており17)18),免疫再構築症候群(immune reconstruction inflammatory syndrome,以下IRISと略記)との鑑別が問題となっている.本例の造影効果については,元々IRISはHIV患者でcART導入直後に日和見感染が生じた場合など,宿主の免疫能が再構築される過程で発生する日和見感染および病態悪化と臨床的に定義された概念であることや,造影効果がSASP中止前かつメフロキン・ミルタザピン療法開始前に認められたことから,臨床的にIRISに関連した造影効果ではないと判断した.
PML病理組織で見られる炎症反応について,宍戸-原らは,CD4/CD8比の均衡が保たれた制御された炎症反応と,過剰なCD8陽性T細胞浸潤などCD4/CD8比の不均衡を伴う秩序を失った過剰な炎症反応に大別し,制御された炎症反応は宿主の細胞性免疫によりJCVの増殖が抑制された状態と解釈でき,比較的良好な予後が期待できると論じており19),予後良好であったPML症例を報告している20).本例も,診断時の画像で造影効果が認められ,病理でCD4/CD8比の検索は行っていないが,T細胞浸潤が確認され,予後良好であった.PMLの治療で重要な点は宿主の正常免疫応答を回復させることと考えられており,本例ではSASP中止が細胞性免疫機能回復の契機となり予後改善に繋がった可能性もある.
今回我々はSASP服用中にPMLを発症したRA症例を報告したが,自己免疫疾患患者,特にSLEとRAでは投与薬剤に関わらずPML発症リスクがあると考え,常に留意すべきである.
謝辞:脳生検を実施して頂いた大阪警察病院脳神経外科の高由美先生,米澤泰司先生,ならびに抗VP-1抗体免疫染色を実施して頂いた東京都健康長寿医療センター高齢者ブレインバンクの村山繁雄先生に深謝いたします.
※著者全員に本論文に関連し,開示すべきCOI状態にある企業,組織,団体はいずれも有りません.