2021 年 61 巻 12 号 p. 862-868
2021 年 61 巻 12 号 p. 862-868
症例は35歳男性.意識障害にて搬送.画像検査にて後頭蓋窩を主体にクモ膜下腔に沿ったびまん性の造影病変とその一部に結節性病変を認め,開頭生検したところ組織診断は膠芽腫であった.脳・脊髄実質内に病変を認めないことからprimary leptomeningeal gliomatosis(PLG)と診断した.Temozolomideを用いた化学療法と放射線治療を導入したところ一旦画像上の病変消失をみたが,その後脳実質内に再発し,術後23か月に死亡した.剖検では髄膜以外に脳・脊髄実質にも腫瘍の浸潤を認めた.髄膜に沿うびまん性病変をみた場合,PLGも鑑別にあげ早期の生検を検討する必要がある.
A 35-year-old man was admitted to our department for loss of consciousness. CT and MRI revealed diffuse enhancement of the subarachnoid space surrounding the brainstem and the cerebellar sulci, without any parenchymal lesions in the brain or the spinal cord. Furthermore, gadolinium-enhanced MRI revealed a nodular lesion with heterogeneous enhancement in the right prepontine cistern, at the site from which a biopsy was obtained via right lateral suboccipital craniotomy on the day following admission. Histopathological examination of the resected specimen revealed glioblastoma multiforme. Based on the radiological and histopathological findings, the patient was diagnosed with primary leptomeningeal gliomatosis (PLG). The patient received temozolomide chemotherapy with concurrent radiotherapy and showed radiological remission, 12 months after diagnosis. However, he developed local recurrence 6 months later and died 23 months after diagnosis. Autopsy findings showed tumor cell infiltration of the leptomeninges, as well as the brain and spinal parenchyma. PLG should be considered in the differential diagnosis in patients with diffuse leptomeningeal enhancement even without parenchymal lesions on radiological imaging. A surgical biopsy is recommended for prompt and accurate diagnosis in such cases.
Primary leptomeningeal gliomatosis(PLG)は髄膜の異所性グリア細胞を起源に発生する腫瘍とされ,びまん性の髄膜病変を形成する一方で脳・脊髄実質にはその病変を認めない特異な発症様式を呈する1).本疾患の髄膜病変は,脳・脊髄実質に発生した腫瘍が二次性に髄膜播種を呈するsecondary leptomeningeal gliomatosisとは発生母地の観点から一線を画している.稀な疾患でありかつ病変部位が髄膜であることから早期診断が困難なことが多く,また予後も不良である.今回,早期の生検によりPLG(組織型:glioblastoma)と診断し,速やかにtemozolomide(TMZ)による化学療法・放射線治療を導入し,一定の治療効果が得られた症例を経験したので,剖検所見も交え報告する.
症例:35歳,男性
主訴:意識障害
既往歴:A型肝炎.
生活歴:飲酒歴なし,28歳まで喫煙歴.
家族歴:特記なし.
現病歴:来院10日前ごろから嘔気を訴えていた.来院当日の朝は家族が普段と変わらない様子を確認していたが,同日夕方家族が帰宅した際にベッドで意識がない状態を発見され救急搬送となった.
来院時現症:身長174 cm,体重94 kg,体温40.1°C,血圧123/75 mmHg,脈拍77/分,GCS E1V1M3,JCS III-100,瞳孔3 mm同大,対光反射迅速.
来院時検査所見:白血球16,450/μl(好中球88.6%),CRP 1.72 mg/dl,AST 55 U/l,ALT 150 U/l,随時血糖220 mg/dl.電解質異常は認められなかった.頭部単純CTにて脳幹の右腹側に淡い高吸収域が認められ(Fig. 1A),クモ膜下出血を疑い3D-CTAが施行されたが脳動脈瘤などの血管病変は認められなかった.髄液検査では外観はキサントクロミー,赤血球0/μl,白血球24/μl(多核球11/μl,単核球13/μl),蛋白458 mg/dl,糖111 mg/dl,髄液細胞診は陰性であった.頸胸腹部CTでは異常を認めなかった.
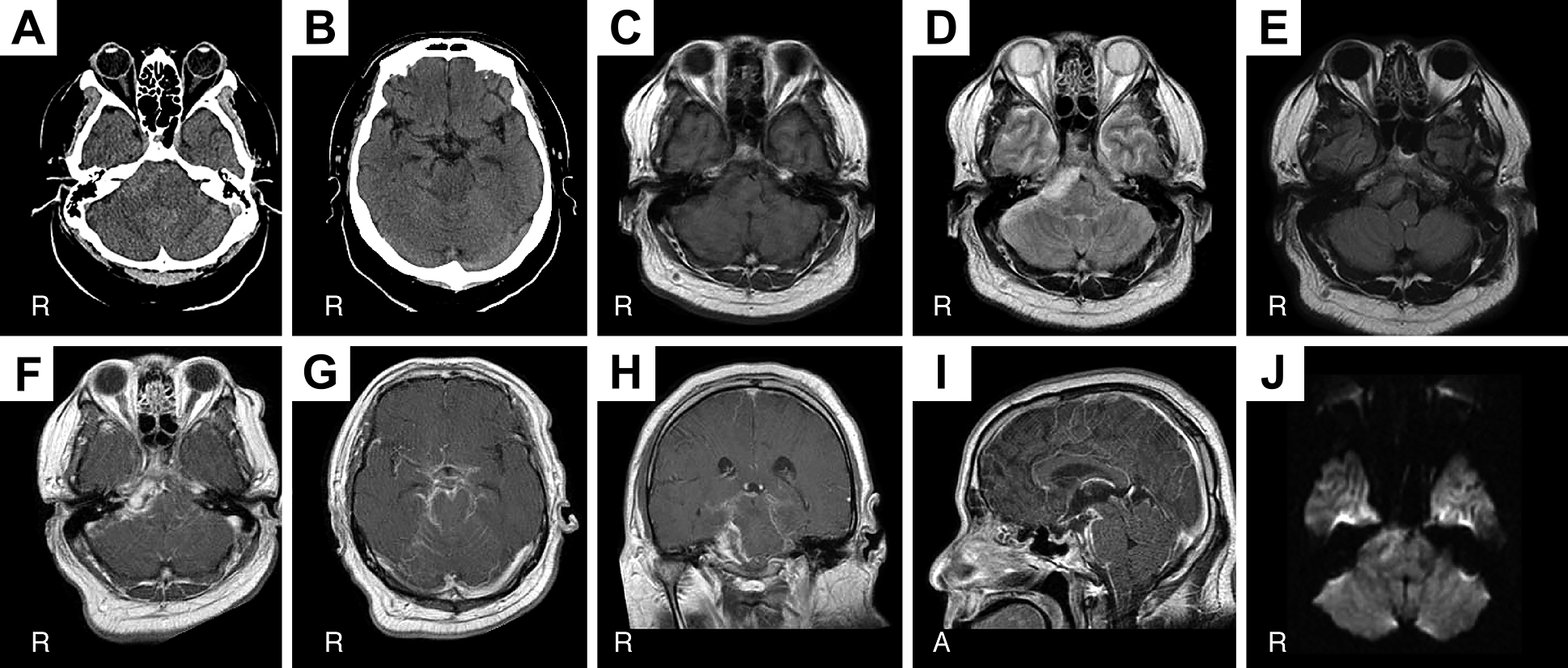
A, B: CT at initial presentation shows a slightly hyperdense lesion in the right-sided subarachnoid space surrounding the brainstem (A). C, D, E, J: MRI demonstrates a mass lesion in the right-sided subarachnoid space surrounding the brainstem, which was slightly hypointense on T1WI (C), hyperintense on T2WI (D), mild hyperintense on FLAIR (E), and spotty hyperintense on DWI (J). F, G, H, I: Gadolinium-enhanced MRI reveals a heterogeneously enhanced nodular lesion in the right-sided subarachnoid space surrounding the brainstem (F, H), as well as diffuse enhancement of the basal cistern (G) and the subarachnoid spaces of cerebellar sulci (G), and the pial surface of the brainstem (I).
入院後経過:発熱を伴うこともあり当初は髄膜炎・脳炎・脳膿瘍などの感染性疾患が疑われ,脳神経内科にて抗菌剤(meropenem, vancomycin)・抗ウイルス剤(acyclovir)とステロイド(dexamethasone)の投与が開始された.入院翌日は四肢に自発的な動きはみられたが意識状態の回復はみられなかった.MRIを施行したところCTで異常がみられた脳幹右腹側部に不均一に造影される結節性病変を認め(Fig. 1F, H),さらに脳底槽や小脳脳溝のクモ膜下腔(Fig. 1G)および脳幹から第1頸髄の腹側表面(Fig. 1I)にびまん性の造影効果を認めた.肉芽腫,膿瘍,腫瘍など複数の疾患の鑑別を要する状態と判断され脳神経外科に紹介となり,同日確定診断のため開頭生検を施行した.
術中所見:右外側後頭下開頭にて後頭蓋窩に進入.VII・VIII脳神経およびIX・X・XI脳神経が観察され,その腹側に病変が確認された(Fig. 2A).病変はやや軟性で易出血性であり,生検したところ迅速診断はglioblastoma multiforme(GBM)であった.この迅速診断結果と病変の広範な進展領域を考慮して手術は生検のみで終了した.

A: Operative finding via right lateral suboccipital craniotomy shows that the nodular lesion appears between cranial nerves VII·VIII and IX·X·XI (the area enclosed by the line). B: Hematoxylin and eosin section discloses hypercellularity, moderate nuclear pleomorphism, endothelial proliferation, and the foci of necrosis, which are the histologic hallmark of glioblastomas (scale bar = 100 μm). C: Immunohistochemical stain indicates that Ki-67 labeling index is 15.9% (scale bar = 50 μm).
病理所見:Hematoxylin and eosin染色では濃染した核を有する紡錘形から多角の異型細胞の増殖と,小血管増生・内皮増殖および壊死巣を認めた(Fig. 2B).免疫組織学的検査ではGFAP(glial fibrillary acidic protein)陽性,S-100陽性,Olig2 陽性,EMA(epithelial membrane antigen)陰性,p53蛋白 陽性,MGMT(O-6-methylguanine-DNA methyltransferase)変異 陰性,IDH 1(isocitrate dehydrogenase 1)R132H変異 陰性,ATRX(α-Thalassemia/mental retardation syndrome X-linked)変異 陽性,H3.3K27M変異 陰性,Ki-67 index 15.9%(Fig. 2C)であった.以上からGBM,wild type,WHO grade 4と診断された.
術後経過:手術翌日には開眼がみられ,簡単な質問に答えられるまでに改善し,術後2日目には意識状態はほぼ清明となり離床可能となった.しかし術後26日目に会話中に突然眼がうつろとなって応答不能となる意識障害が数分間みられ,抗てんかん剤(levetiracetam)の投与を開始した.脳波検査は未施行であり確証は得られていないが,この意識障害および入院時の昏睡状態の原因は脳腫瘍に起因した二次性てんかんと考えられた.以後同症状や痙攣はみられなかった.術後には脊髄MRIを撮影したが,第2頸髄レベル以下の尾側脊髄には異常を認めなかった.画像所見,術中所見,病理所見などを勘案し,本疾患はPLG(組織型:GBM)と診断した.治療はGBMに準じてTMZ 75 mg/m2による化学療法と放射線療法(全脳40 Gy/20分割および局所14 Gy/7分割)を術後18日目から導入した.術後24日目からはbevacizumab(BVZ)10 mg/kgを併用した.これらの治療に反応して腫瘍は縮小し,また状態の改善も得られ,入院59日目に独歩退院となった.その後は外来にて維持療法(TMZ 200 mg/m2/4週毎,BVZ 10 mg/kg/2週毎)を継続し,術後12か月後にはMRI上病変の消失をみた(Fig. 3A~C).しかし術後18か月後に脳幹の左側実質内を中心に造影病変の出現を認め(Fig. 3D~F),以後病状は急速に悪化に転じ,術後23か月に死亡した.

A, B, C: Gadolinium-enhanced MRI 12 months after surgery shows no evidence of the tumor. D, E, F: Gadolinium-enhanced MRI 18 months after surgery reveals local recurrence in the left side of the brainstem.
剖検所見:中脳・橋の実質を置換するような高度の腫瘍細胞の集簇を認めた(Fig. 4A).両側間脳,右側頭葉,延髄にも巣状の腫瘍浸潤を認めた.大脳から脳幹・小脳および脊髄にかけてのクモ膜には腫瘍細胞がびまん性に浸潤し,高度髄膜播種の様相を呈していた(Fig. 4B).さらに脳・脊髄の実質には微小な腫瘍浸潤が広範に認められた(Fig. 4C).剖検時の免疫組織染色は変性による影響はみられるが,手術生検時のものとほぼ同様の結果を示し,腫瘍の基本的性格は保たれていた(Table 1).
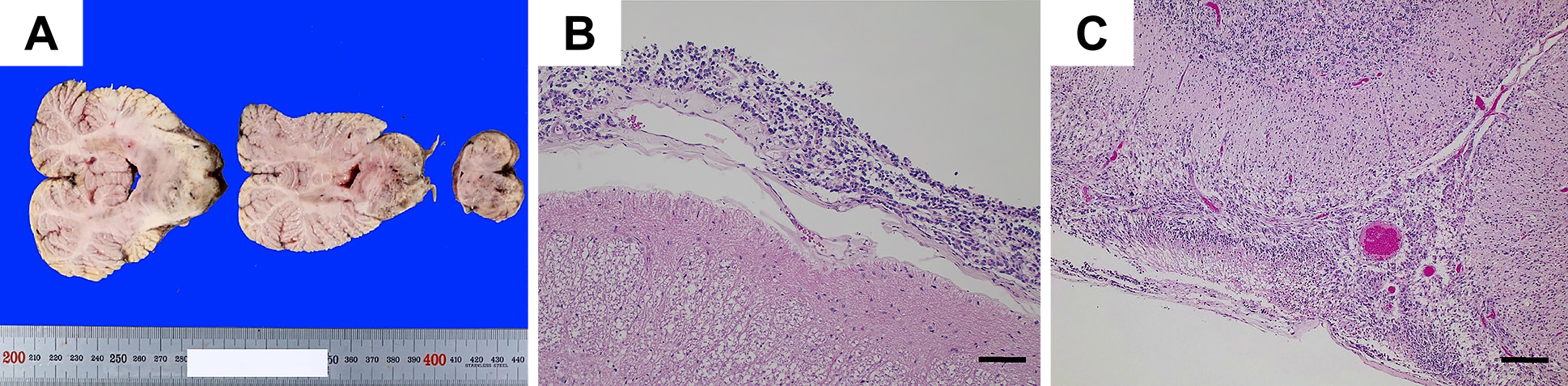
A: Autopsy findings show focal brainstem tumors. B: Postmortem hematoxylin and eosin section shows tumor cell infiltration of the leptomeninges (scale bar = 100 μm). C: Postmortem hematoxylin and eosin section of the cerebellum demonstrates the leptomeningeal tumor with superficial involvement of the cerebellum (scale bar = 200 μm).
| GFAP | Olig2 | S100 | EMA | IDH1 R132H | MGMT | ATRX | p53 | H3.3K27M | Ki-67 | |
|---|---|---|---|---|---|---|---|---|---|---|
| biopsy | + | + | + | − | − | − | + | + | − | 15.9% |
| autopsy | + | ND | + | − | − | − | + | + | − | ND |
ND: not determined because of the degradation.
PLGは髄膜に異所性に存在するグリア細胞が腫瘍化したものと考えられている1).髄膜の異所性グリア細胞巣の存在は剖検の1%にみられるとされ,1個体に複数ヵ所認める場合もあり,この多発のものを含めた部位別頻度は大脳皮質4%,中脳10.5%,橋15%,延髄57%,小脳8%,頸髄10.3%,胸髄10.5%,腰仙髄20%とされている1).この分布に合わせるようにPLGは脳幹周囲の頭蓋底部と脊髄での発生頻度が高い2)3).組織型としてはastrocytoma,oligodendroglioma,GBM,gliosarcomaなど種々のものが報告され,小児から高齢者まで幅広く発生し,男性の比率がやや優位とされる2)4)~6).
PLGは髄膜病変が主体のため,画像検査での髄膜のびまん性肥厚とその造影効果を特徴とするが,それのみでは腫瘍と断定することは困難である.多くの場合髄液検査が補助的に施行されるが,蛋白が高値を示すものの,腫瘍細胞は検出されないか検出されても診断を確定するまでには及ばず,初期段階では感染性髄膜炎や癌性髄膜症あるいは自己免疫疾患などを想定して治療が開始されている.診断には生検が必要となるが,生検でも確定に至るとは限らず,最終的に剖検に委ねられる場合も少なくない3)7)8).Tauziede-Espariatら5)によれば自験例6症例のうち,初回生検で診断し得たのは3症例(50%)に過ぎず,2回(33%)あるいは3回(17%)の生検にてようやく診断にたどり着いたとしている.このPLGの生検の不確実性の一因は,通常の腫瘍と違って病変がびまん性のため局在が定まらないことによる標的部位の選定の困難さにある.一方でPLGの中には本症例のようにびまん性病変だけでなく結節性の局在病変を伴うものや4)5),稀に結節性の局在病変のみの場合もある9)10).この結節性病変はびまん性病変に比べ術中に視認しやすく,組織検体として十分な量を採取できる可能性が高い.したがって生検においてはこの結節性病変を標的に施行できれば診断率が向上するものと思われる.過去の報告には経過中に結節性病変が顕在化したことで同部を生検して診断したものもみられる4).
PLGはその稀少性から確立された治療法はなく,生存期間中央値は8ヵ月2)と短く予後不良である.一方近年化学療法にTMZを用いた報告が散見され,その有効性が期待されている2).過去の文献を渉猟しPLGの治療にTMZを用いた報告をTable 2にまとめる2)~5)9)11)~18).これに示されるTMZを用いた症例の生存期間中央値は15ヵ月であり生存期間の延長がみられるが,各症例における診断までの期間・組織型・併用薬剤・照射の組み合わせなどには差異が大きく,TMZの効果を純粋に評価することは難しい.長期生存を示したCase 4ではTMZ治療後に腫瘤状の再発病変を生じたが,外科的に全摘出でき,さらに試験的な治療(追加照射と他剤化学療法)が施されて奏効した4).TMZだけでなく,再発様式や追加治療の感受性も予後に与える影響が大きい.将来は症例毎の個別化治療が進むと思われるが,PLGにおいてはまだ共通性を示す特徴的な遺伝子発現は解明されていない.その中で近年H3K27M変異に関する報告がみられる5)17).H3(3.1, 3.2, 3.3)K27M変異はdiffuse midline gliomaにおいては診断上必須項目であり,また予後不良と関連している.Case 17では早期診断し得たにもかかわらず予後不良であったが,このH3.3K27M変異を有していたことが報告されている17).他方相対的に予後が良好であった本症例(Case 19)ではH3.3K27M変異は陰性であった.またH3K27M変異と相互排他的とされるH3K27me3についてCase 14, 15, 16で評価されているが,そこでは予後との明らかな関連性はみられなかった5)(Table 2).現在のところ症例数の制限もあり,TMZの治療反応性およびH3K27M変異と予後との関連性については今後のさらなる研究が必要である.
| Case | Author, Year | Age | Sex | Site | Type | CSF protein | CSF cytology | Time to biopsy | Histology | Chemotherapy | Radiation | Follow up (outcome) | Autopsy |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Franceschi, 200511) | 40 | F | B | D+N | 686 mg/dl | negative | 10 weeks | astrocytoma, intermediate grade | TMZ, carboplatin·etoposide, carmustine | NA | 17 months (dead) | NA |
| 2 | Jicha, 20094) | 24 | M | B+S | D | 705 mg/dl | negative | NA | astrocytoma, grade 3 | TMZ, carmustine | salvage | 13 months (dead) | NA |
| 3 | Jicha, 20094) | 19 | M | B+S | D+N | 778 mg/dl | negative | within 1 month | astrocytoma, grade 3 | TMZ | concurrent | 11 months (dead) | NA |
| 4 | Jicha, 20094) | 16 | M | B+S | D+N | 1045 mg/dl | negative | within 2 weeks | GBM | TMZ, imatinib·hydroxyurea | sequential | 41 months (alive) | NA |
| 5 | Jicha, 20094) | 14 | M | B+S | D+N | 2568 mg/dl | negative | NA | anaplastic astrocytoma, grade 3 | TMZ | sequential | 7 months (dead) | NA |
| 6 | Mathews, 200912) | 50 | F | B+S | D | 158 mg/dl | negative | NA | oligodendroglioma | TMZ, etoposide | concurrent | NA (dead) | NA |
| 7 | Michotte, 200913) | 61 | M | B | D | NA | NA | NA | oligodendroglioma, grade 3 | TMZ | salvage | 24 months (alive) | NA |
| 8 | Bhatia, 201014) | 52 | F | S | D | 370 mg/dl | NA | NA | astrocytoma, grade3 | TMZ | sequential | 8.5 months (dead) | NA |
| 9 | Hansen, 20112) | 53 | M | B+S | D+N | NA | atypical cells | 3 weeks | malignant astrocytic tumor | TMZ, topotecan, cisplatin, irinotecan, BVZ | sequential | 22 months (dead) | NA |
| 10 | Noval, 20113) | 17 | F | B+S | D | 77 mg/dl | negative | NA | anaplastic glial cells | TMZ | concurrent | 15 months (dead) | NA |
| 11 | Bernardini, 201315) | 10 | F | B+S+ON | D+N | 113 mg/dl | atypical cells | 3 weeks | gliomatosis (not specified) | TMZ·carboplatin·vincristine | concurrent | 36 months (dead) | NA |
| 12 | Yamasaki, 201416) | 60 | M | B+S | D+N | 54 mg/dl | class 3 | 3 weeks | GBM#1 | TMZ | concurrent | 8 months (dead) | NA |
| 13 | Bathla, 20159) | 51 | M | B | N | NA | NA | NA | GBM | TMZ | concurrent | NA (dead) | NA |
| 14 | Tauziede-Espariat, 20165) | 56 | F | B+S | D | high level | NA | NA | oligodendroglioma, grade 3#1,#3 | TMZ | NA | 23 months (alive) | NA |
| 15 | Tauziede-Espariat, 20165) | 9 | M | B+S | D | high level | negative | NA | GBM#1,#3 | TMZ·vinblastine | NA | 19 months (dead) | NA |
| 16 | Tauziede-Espariat, 20165) | 9 | F | NA | NA | high level | NA | NA | GBM#1,#3 | TMZ·carboplatin·vincristine, BVZ·irinotecan | NA | 14 months (dead) | NA |
| 17 | Champeaux, 201817) | 40 | F | B+S | D+N | 840 mg/dl | negative | 7 days | malignant glioma#1,#2 | TMZ | sequential | 4.6 months (dead) | NA |
| 18 | Katsuhara, 201818) | 55 | F | B | D+N | NA | NA | NA | GBM#1 | TMZ | concurrent | 10 months (dead) | NA |
| 19 | present case | 35 | M | B+S | D+N | 458 mg/dl | negative | 2 days | GBM#1,#2 | TMZ·BVZ | concurrent | 23 months (dead) | + |
NA: not applicable, B: brain, S: spinal cord, ON: optic nerve, D: diffuse, N: nodule, GBM: glioblastoma multiforme, BVZ: bevacizumab, TMZ: temozolomide.
#1: Immunohistochemical staining for IDH1 R132H is negative in Case 12, 14, 15, 16, 17, 18, and 19.
#2: Immunohistochemical staining for H3.3K27M is positive in Case 17, and negative in Case 19.
#3: Immunohistochemical staining for H3K27me3 is expressed in Case 15 and 16, and lost in Case 14.
PLGはその進展様式についても不明な点が多い.PLGは基本的には病変は髄膜に留まり脳・脊髄の実質内には腫瘍を認めないとされているが1)19),それとは異なり腫瘍細胞が脳・脊髄実質内に浸潤するもの7)20)21),腫瘤を形成したり,実質内に囊胞形成するもの8),さらには椎体や皮膚・筋あるいは腹膜などに転移を来すもの4)9),などがあることが判明している.腫瘍細胞の実質内への進展機序としては,脳・脊髄表面での直接浸潤や血管周囲腔に沿って実質深部にまで進展する様式が推察されている7)8)16).本症例の剖検所見では脳幹に腫瘍細胞の集簇を認めた以外に,大脳や脊髄の実質内にも散在する腫瘍細胞を確認した(Fig. 4).本症例において治療内容が再発様式にどのような影響を与えたかは不明だが,PLGの進展の一形態として髄膜に留まらず脳・脊髄実質内への進展様式があることが今回の画像所見および剖検所見からも追認された.
PLGは診断から治療に至るまで依然として未解明な部分が多い.今後の症例の蓄積と遺伝子解析の進歩により,病態の解明に進展がみられることが期待される.
謝辞:本症例の組織学的診断および剖検を行っていただいた豊橋市民病院病理診断科 前多松喜先生に深謝いたします.また診療に携わっていただいた佐藤脳神経外科 佐藤雅基先生には論文作成に際してもご指導賜りました.感謝申し上げます.
本論文の要旨は第91回日本脳神経外科学会中部支部学術集会(2016年9月17日 浜松)において発表した.
※著者全員に本論文に関連し,開示すべきCOI状態にある企業,組織,団体はいずれも有りません.