欧米においてBarrett腺癌は急増しているが,本邦では依然まれである.しかし,本邦における逆流性食道炎罹患率は上昇しており,今後,Barrett食道および腺癌の増加が憂慮されている.進行したBarrett腺癌の予後は不良であり,患者予後の改善には内視鏡による早期発見が必要である.本邦ではBarrett食道の大多数がshort segment typeであることから,腺癌病変の多くは内視鏡的観察の難しい食道胃接合部に局在する.よって,その早期発見には観察のコツと高い内視鏡診断能を要する.内視鏡観察の基本は通常観察であるものの,酢酸法やNarrow Band Imaging(NBI)を併用した拡大観察の有用性が確立されつつある.本稿では筆者らの経験と国内外の臨床研究成果に基づき,内視鏡を用いたBarrett腺癌の早期発見に肝要と思われるテクニックと診断体系について,実際の症例を供覧しつつ解説したい.
特殊な症例を除き,食道に発生する腺癌はBarrett食道から発生する.Barrett腺癌の発生頻度は,欧米諸国においてに過去30~40年で3~5倍と著明に増大しているものの 1),本邦ではBarrett腺癌を含む食道腺癌の頻度は全食道癌の数%以下と依然まれである 2).
しかし,この数十年間における胃食道逆流症(gastro-esophageal reflux disease,GERD)の増加やHelicobacter pylori菌感染率の低下に伴う 3),4),Barrett食道(Barrett’s esophagus,BE) 5),6)の増加が懸念されている.さらにBEはBarrett腺癌の発癌母地でもあるため,Barrett腺癌の増加が危惧されており,実際,軽微ながら,増加傾向にある 2),7).
Barrett腺癌は食道扁平上皮癌や他の消化管癌同様に,進行した段階で発見された場合,5生率は17%と予後不良であるため 8),早期の段階で発見することが重要である.
本邦においてBEは胃から食道へ連続性に伸びる円柱上皮(Barrett粘膜)の存在する食道をBarrett食道とされ,欧米(英国以外)と異なり,組織学的な腸上皮化生の有無は問わない.さらに全周3cm以上をlong segment Barrett’s esophagus(LSBE),それ以外をshort segment Barrett’s esophagus(SSBE)と呼称する.欧米と異なりLSBEは極めてまれで,本邦のBarrett食道の大部分は食道胃接合部(esophagogastric junction:EGJ)とその近傍の下部食道に限局するSSBEである 9).よって,Barrett腺癌を早期発見するためには,EGJを含むBarrett食道を詳細に観察する必要がある.また,Barrett腺癌の早期診断には,まず,通常内視鏡で検出し,拡大内視鏡を用いて狙撃生検することが最も効率がよい.加えて拡大内視鏡診断に精通すれば,内視鏡的切除の際に精度の高い側方進展範囲診断ができ,完全切除率を高めることにもつながる.
よって,本稿では,①最近,改訂されたEGJ診断基準とEGJの観察法,Barrett腺癌の②通常内視鏡像,③拡大内視鏡像の順に内視鏡手技のコツと内視鏡診断のポイントについて述べたい.
(EGJ・Barrett食道の定義)
Barrett粘膜は「胃から連続性に食道に伸びる円柱上皮」と定義されており 9),Barrett食道を診断するにあたり,まずEGJを同定しなければならない.EGJの定義は,本邦では『食道下部の柵状血管の下端』(Figure 1-a),欧米では『胃の縦走ヒダの口側終末部』(Figure 1-b) 10)とされている.『胃の縦走ヒダの口側終末部』は「適度な空気量」で観察することとされているが,その空気量が問題である.なぜなら,胃縦走ヒダの口側終末部(Figure 2-a,b:白点)は送気量が増えるにつれ丈が低くなり胃側に変位し,時に消失する(Figure 2-a:少量 Figure 2-b:多量)ため,「適度な空気量」の設定は容易でない.また,広範囲の萎縮性胃炎(特にopen type)を伴う場合は,空気量に関わらず胃縦走ヒダを視認しづらくなる.実際に胃縦走ヒダによる定義では本邦BEの大多数を占める1cm以下のSSBEにおいて観察者間一致率が低いとの報告もある 10).
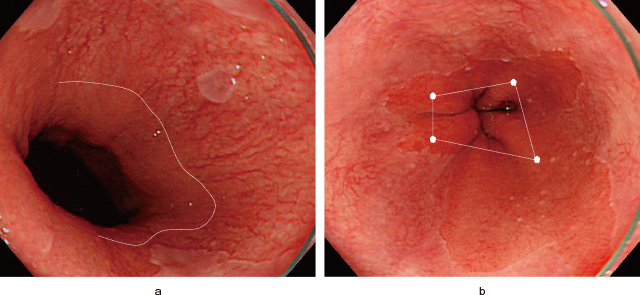
a:食道下部の柵状血管の下端(白破線).
b:胃の縦走ヒダの口側終末部(白点・白破線).

胃の縦走ヒダの口側終末部(白点).
a:空気少量.
b:空気多量.
3°~9°方向の胃縦走ヒダは消失している.
一方,下部食道の柵状血管は解剖学的に位置が不変であり全周性に局在する.よって,欧米に比し,SSBEが圧倒的に多く,萎縮性胃炎の頻度も高い本邦において,EGJの同定には柵状血管の方が適している.本邦のEGJ定義である『食道下部の柵状血管の下端』を全周性に観察するには,胃内を脱気し,吸気時に下部食道を十分に伸展させることに留意する必要がある(後述する“EGJ観察のコツ”参照).
最近,日本胃癌学会と日本食道学会との合同ワーキンググループによって,EGJの定義が見直され,新しい診断基準が作成された(Table 1) 11).EGJの同定におけるポイントは,①『内視鏡診断を優先する』(治療開始前に判断することが重要),②原則的に食道下部柵状血管の下端を優先し,その同定が困難な際は胃縦走ヒダの口側終末部により診断するとされている.

本邦における食道胃接合部の新規診断基準.
EGJが同定されれば,「胃から連続性に食道に伸びる円柱上皮」であるBarrett粘膜の範囲を診断することができる.Barrett食道の長さは発癌リスクを予測するうえで重要であるとされており(Barrett食道の長さが2倍になると発癌リスクは1.7倍) 12),Barrett食道長の内視鏡的測定法は“プラハ分類(C&M分類)”によって国際的に標準化されている 10).EGJの基準点から(プラハ分類では胃粘膜ひだの口側端であるが,本邦では下部食道柵状血管の下端),全周性のBarrett粘膜の最も口側までの距離を“全周長Circumferential:C”とする.また,舌状を呈し口側にのびた非全周性のBarrett粘膜の最も高い位置までの距離を“最大長maximal:M”としている(Figure 3:全周長2cm,最大長5cmなら,C2M5と記載する).
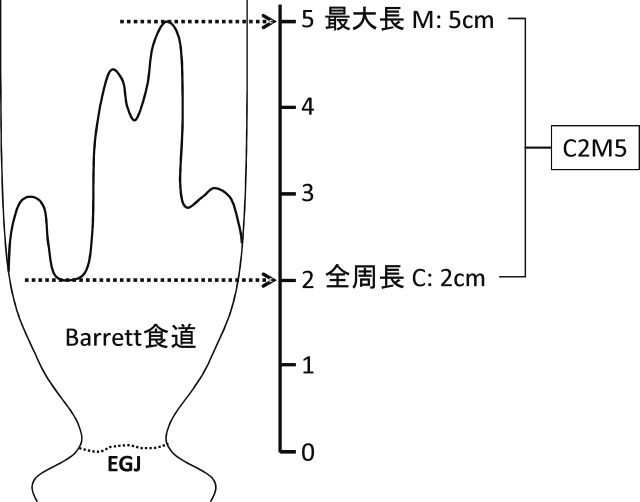
プラハ(C&M)診断基準:バレット食道長の表記法.
(EGJ・Barrett食道の観察のコツ)
食道胃接合部とその近傍の観察に際し,食道胃接合部が呼吸性に移動することを利用する.下部食道括約筋の収縮が強く観察が困難な症例に対しては,深呼吸させると良好な視野を確保できる場合がある(Figure 4,電子動画1).これは呼吸運動で横隔膜食道裂孔が収縮・弛緩することを利用したもので,深吸気時に食道・胃接合部が弛緩しつつ口側に展開した時に,素早く観察・撮影を行う.
呼吸運動を利用した食道胃接合部の観察法.
電子動画1
本邦ではBarrett食道は組織学的に,①円柱上皮下の粘膜層に食道腺導管あるいは粘膜下層に固有食道腺,②円柱上皮内の扁平上皮島squamous island,③粘膜筋板の二重構造のいずれかが認められると定義されている 9).これらのうち,②のみが内視鏡的に診断可能である.しかし,扁平上皮島が極小(<3mm)な場合,通常光観察では視認困難なことも少なくないが,NBIを用いれば明瞭に描出される(Figure 5-a,b:黒矢頭は扁平上皮島).Barrett長が短く(<1cm),柵状血管や胃縦走襞が不明瞭な場合に特に有用で,Barrett食道の存在を内視鏡的に診断できる.
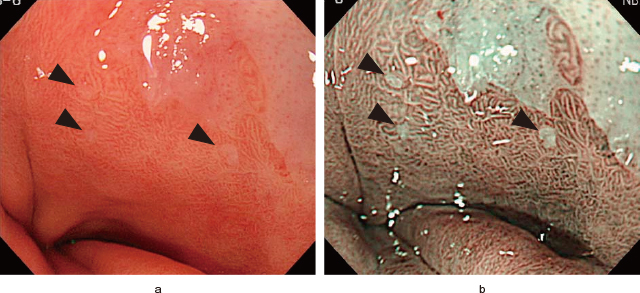
微小な扁平上皮島の内視鏡像.
a:通常白色光.
b:NBI.
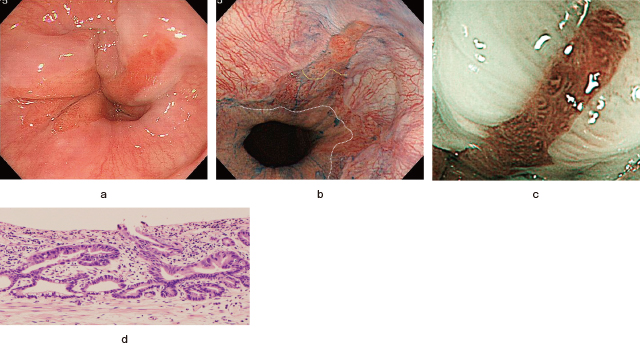
Barrett食道・腺癌症例の多くは,滑脱型の食道裂孔ヘルニアを伴っている 13).従って,われわれは胃内観察時に,スコープの上下・左右アングルを最大限にした反転観察でヘルニア内を詳細に観察している.そうすれば,挿入時の順視で死角になりやすい食道裂孔ヘルニア内をくまなく観察できる.さらに順視でBarrett食道の診断が難しい場合も(Figure 6-a),ヘルニア嚢を十分に伸展させた反転観察時には,柵状血管が明瞭に描出され(Figure 6-b),Barrett食道の存在診断が可能となる.

ヘルニア内反転観察によるBarrett食道・腺癌診断.
a:順視ではBarrett食道の診断は困難.
b:ヘルニア嚢の反転観察では,下部食道の柵状血管の下端(黄色破線)が明瞭に描出される.
c~e:扁平上皮で被覆されたBarrett腺癌(白・青矢印a~cにおける微小白点・屈曲したBarrett粘膜と扁平上皮の境界).
人は“知っているものしか見えていない”という言葉ある.内視鏡的には“知っていることのみ異常として認識できる”と私自身解釈している.
実はFigure 6の内視鏡写真内に癌病変がある.通常白色光では病変は視認不可能で(Figure 6-a,b),NBI光観察をもってしても病変を視認することは極めて困難である(Figure 6-c).しかし,食道胃接合部CaやSSBEでSCJにかかる小病変(特に<10mm)は,生検後,非腫瘍性の扁平上皮で被覆される場合も少なくない(特に生検後,PPIが投与された場合,食道内PHが上昇し扁平上皮の増殖を促すためとされる).このことを筆者自身が“知っていた”ため,NBI光で観察される扁平上皮で被覆された淡いbrownish areaに着目することができ(Figure 6-c),引き続き行った拡大観察において扁平上皮下の異常血管を視認できたものと考えている(Figure 6-d).前医ではEGJの発赤調粘膜からの生検で腺癌が検出されていることより,生検後に扁平上皮で被覆されたものと思われる.実際,内視鏡的に切除した結果,粘膜固有層から一部,粘膜筋板まで浸潤する高分化型腺癌を認めた(Figure 6-e).
よって,Barrett食道表在癌を見逃すことなく拾い上げるには,まずBarrett食道表在癌の典型的内視鏡像を明らかにし,それをターゲットとして各内視鏡医が頭の中で明確にイメージできている(すなわち“知っている”)ことが肝要である.
西洋・東洋を問わず,通常の白色光による観察が消化器内視鏡検査の基本である.本邦ではHigh- definition(HD,ハイビジョン)内視鏡システムが広く普及しつつあり,その病変検出力は格段に向上している.ところがBarrett表在癌は症例数の少なさもあり,通常内視鏡像に関する検討は皆無に等しく,その典型的内視鏡像は不明であった.そこで,われわれは国内10施設によるCase series studyを実施し,内視鏡的・外科的に切除されたBarrett食道表在癌168例175病変の特徴的内視鏡像について解析した 13).
その結果,大多数(85%)はSSBEから発生しており,LSBE由来の腺癌症例は少なかった.登録された“表在”腺癌175病変の95%は白色光観察で発見されており,表在癌の検出における通常内視鏡像の有用性が示唆された.175病変の大多数(90%)が発赤調を呈し,2/3以上(72%)の病変が2°方向を主体とした前壁~右側壁に局在,過半数(52%)が隆起型であった(いわゆる“表在癌3徴”:Figure 7).これらは欧米の前向き検討の結果(12°~3°方向に最頻局在,隆起型51%)とほぼ一致していた 2).“表在癌3徴”を示す典型例をFigure 8に示す.

Barrett表在腺癌3徴・粘膜内癌4徴.

表在癌3徴の典型例.
a,b:EGJ3時方向に12mm大の淡い発赤調で台状を呈する隆起性病変(0-Ⅰ型)を認める.病変は下部食道柵状血管の下端(白点線)より口側に局在しており,Barrett食道に発生したものと考えられる.
c:NBI拡大観察では頂部は茶褐色調を呈し,不規則な分岐と形状不均一を呈する異常血管がみられる.
d:組織学的には未分化型成分を伴う分化型腺癌(tub2>tub1>por2)で粘膜下層深部(T1b-SM,2,200μm)まで浸潤していた.リンパ管・静脈侵襲(ly1,v1)ともに陽性であった.
しかし,典型的な隆起型である0-Ⅰ型のリンパ節転移率(70%)は,0-Ⅱ型(11%)に比し有意に高いとされる 14).実際にわれわれの多施設検討においても0-Ⅰ型の約7割(69%)がSM浸潤癌であり,0-Ⅱb型の大多数(88%)は粘膜癌(M癌)であった.欧米でのメタ分析においてM癌のリンパ節転移率は粘膜下層浸潤(SM)癌より明らかに低く極めてまれであり(<2% vs. 29%) 15),16),最近報告された本邦の多施設検討データでは,粘膜固有層(LPM)までの101病変にリンパ節転移は皆無であった 17).
以上より,本稿において,内視鏡的切除で根治可能であるリンパ節転移のない“真の早期癌”を発見するコツとして,①完全平坦型(0-Ⅱb),②前・右側壁に局在(2°中心),③発赤域,④下部食道柵状血管の透見性低下からなる“粘膜内癌4徴”を提案したい(Figure 7).④は経験的にえられた所見であり,Matsuiらの検討においても20mm以下のBarrett表在腺癌の約半数(43.3%)柵状血管像の視認できない発赤域を示すSSBEであったと報告している 18).“粘膜内癌4徴”を示す典型例をFigure 9に示す.
粘膜内癌4徴の典型例.
a:EGJ2時方向に指様に伸びた円柱上皮(Barrett粘膜)は発赤調を呈している.
b:インジゴカルミン撒布像において発赤部は平坦で領域性を示し(黄色点線より口側),下部食道柵状血管の下端(白点線)より口側のBarrett粘膜内に局在している.発赤域(黄色点線より口側)において柵状血管は透見されない.
c:発赤域のNBI拡大観察では,大きさ・形状共に不均一な粘膜微細構造を認める.
d:組織学的には12mm大の0-Ⅱb型で浅層の粘膜筋板までに留まる(T1a-SMM)高分化型腺癌(tub1)であり,脈管侵襲は陰性であった(ly0,v0).
しかし,柵状血管の透見性低下は炎症性変化によっても起こりえるため,逆流性食道炎を伴っている場合,プロトンポンプ阻害剤を2~4週間投与した後,再精査することを推奨したい.さらに,後述するNBI・酢酸などによる画像強調観察あるいは拡大観察の併用も試みるべきと考える.
以上より,表在癌3徴を念頭にBarrett食道全体を観察し,明らかな隆起性病変がなければ,粘膜内癌4徴(特に柵状血管の透見性低下)について詳細な観察を加えていくことが,Barrett腺癌を早期に発見するための強力な通常観察ストラテジーになりえると考えている.
(狙撃生検 vs. ランダム生検)
Barrett食道の主な組織学的発癌経路はmetaplasia(specialized intestinal metaplasia:SIM)- dysplasia-carcinoma sequenceと考えられている.しかし,通常の内視鏡観察では,発癌の前段階にあたるSIM,dysplasiaと非SIMバレット粘膜とを識別できず,早期癌でさえ病変検出は容易でない.
そこで欧米ではBarrett食道の全域にわたり1-2cmおきに4点生検するランダム生検法(いわゆるSeattle protocol)が推奨されてきた.ランダム生検法はサンプリング・エラー,高コスト,手間(検査時間の延長),安全性(出血)など様々な問題をはらんでおり,経年的に繰り返し継続していくことの難しさも指摘されている.
そこで,粘膜表層の詳細な観察に基づいた“狙撃生検”によるBarrett食道サーベイランスの可能性を追求すべく,色素法(インジゴカルミン,メチレンブルー,クリスタルバイオレットなど),酢酸法やNBI・AFIに代表される光学・デジタル画像強調技術に拡大内視鏡を併用して,SIMに特徴的な内視鏡像を明らかにする試みが数多くなされた.しかし最近では,dysplasiaや表在癌に対する内視鏡的治療の発達・普及は著しく,最近の拡大内視鏡診断の主なターゲットはSIMではなく,治療方針決定に直結するdysplasia・表在癌となっている.
欧米に多いlong segment Barrett’s esophagus(LSBE)はdysplasiaを含めた腫瘍病変が多発性・びまん性に発生する頻度が高く,dysplasiaは内視鏡的な診断が困難なことも少なくないため,ランダム生検に頼らざるをえない部分がある.一方,本邦のBEの大多数はshort segment Barrett’s esophagus(SSBE)であり,SSBEに発生する腫瘍は単発性・限局性であることが多い 19),20).また,SSBEは観察面積が小さく画像強調内視鏡(image enhanced endoscopy;IEE)・拡大内視鏡を駆使した詳細な内視鏡観察に適しており,それに基づいた関心部位に対する狙撃生検が本邦における一般的なBarrett腫瘍の検出法である.現状では本邦においてランダム生検法は基本的に行われていない.英国を除く欧米諸国と異なり,BEの診断基準に“組織学的腸上皮化生の証明”が含まれていないこともランダム生検法が導入されない理由の1つである 9).さらに,BE腺癌と同様に慢性炎症をベースに発生する早期胃癌を,本邦内視鏡医は長年,狙撃生検によって検出してきた経緯があることも,ランダム生検法が浸透しない背景にある.
アメリカ消化器内視鏡学会(ASGE)の行った最新のメタ分析において,ランダム生検法と置換し得る診断精度の基準(感度≧90,陰性的中率≧98%,特異度≧80%)を満たした先進イメージング(による狙撃生検)は,酢酸法とNBI,一体型共焦点内視鏡であった 21).
共焦点内視鏡は本邦において薬事承認されていないため,本稿ではBarrett食道における拡大観察の基本手技に加え,酢酸法・NBIを用いた診断・手技のポイントについても解説したい.
(拡大観察の基本手技)
前処置・観察のポイント(ターゲットとは病変部・関心部位):Figure 10-a
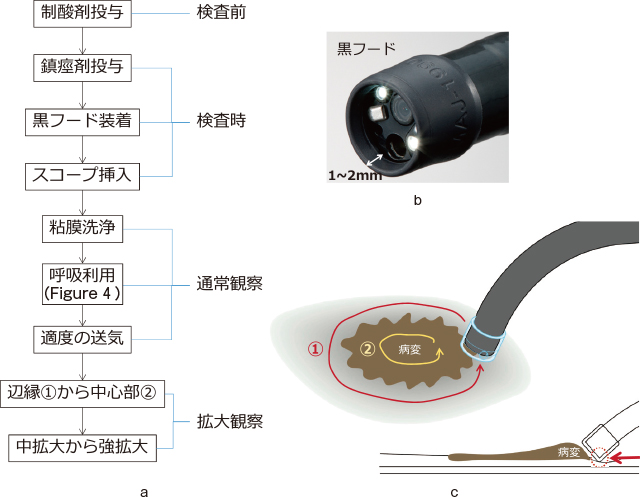
Barrett食道における拡大観察.
a:前処置~拡大観察フローチャート.
b:黒ソフトフード MB-46 or -162,オリンパス社製.
c:病変部シェーマ.
1)制酸剤の投与:高度の逆流性食道炎を伴った症例に対しては,拡大内視鏡検査前に1週間以上PPIを内服させると,発赤を示すことの多い表在癌の視認性の向上,生検時の出血のリスク軽減にもつながる.
2)鎮痙剤の投与:本邦におけるBarrett食道の大多数はShort segment typeであり,下部食道の蠕動・括約筋収縮や心拍動の影響を受ける食道胃接合部またはその近傍で拡大観察を行う場合がほとんどである.蠕動・収縮や心拍動は,①スコープと病変との接触による出血を助長する,②焦点があった撮像を困難にする,などの要因となる.よって,われわれは糖尿病に配慮しつつ,鎮痙剤として心拍動に影響しないグルカゴン®の投与を第一選択としている.
3)黒ソフト・フードの装着:内視鏡先端にフードを1~2mm程度出した状態(Figure 10-b)で装着することは,内腔狭小化したEGJや蠕動時の視野確保に有用であり,拡大観察時の焦点距離の保持に有用である.出血予防の観点からも,透明プラスチック・フードでなく,軟らかい黒ゴム・フードを推奨したい.
4)水で可及的にBarrett食道を含めた食道内腔面を洗浄し粘液・唾液の除去に努める.
5)深吸気時の観察:横隔膜‐食道裂孔部が腹腔側にずれることにより,腹腔内圧と縦隔内圧との圧較差が大きくなり,胃噴門部が食道側に逸脱するため,SCJが全周性に視認可能となる(電子動画1).
6)適度の送気:出血は拡大観察を妨げる最大の要因となるため(特にNBI観察時),以下の点に留意する.非拡大観察時は管腔内が十分に広がるよう送気し,拡大観察時は管腔内の空気量をやや少なめにする.粘膜面の伸展を弱めると内視鏡の先端が接触した際の衝撃・摩擦が吸収され,出血のリスク低減につながる.
7)弱~中拡大観察:まずはBarrett食道全体を中等度の拡大倍率で粘膜模様のみ観察する.粘膜模様の異常(消失・不整)があれば,その領域性を把握する.安定した中拡大像をえるコツとして,空気量をやや少なめ,拡大レバーで焦点を合わせつつ,フード先端を粘膜面上でゆっくりと滑らせつつ回旋させながら粘膜模様を観察する(Figure 11-a~e).
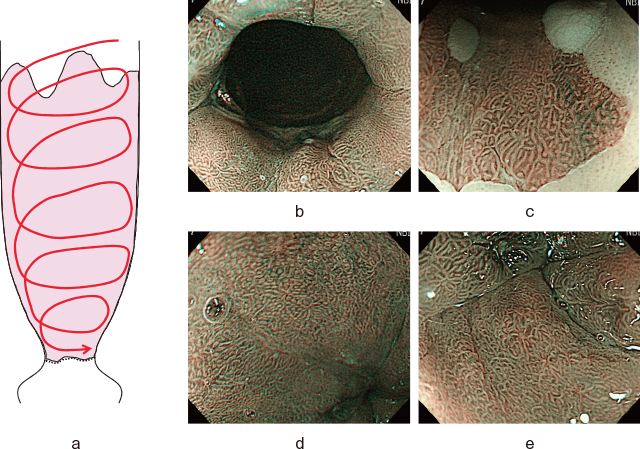
Barrett食道全体の弱~中拡大観察.
a:スコープ回旋操作のシェーマ.
b:弱~中拡大観察時の空気量.
c~e:弱~中拡大内視鏡像(非癌部).
8)中~強拡大観察:病変部の観察は“辺縁から中心へ”のアプローチが鉄則である(Figure 10-c).基本的に病変部は易出血性のため,病変部へはゆっくりと慎重に近づき,拡大観察は病変部の辺縁から始める.その際,スコープを安定させるためのフードの支点は必ず病変の外側におき,病変部と周囲粘膜との表面構造(mucosal pattern)の差異を評価しつつ,上皮性・非上皮性病変の鑑別と共に上皮性なら腫瘍境界(demarcation line)有無を診る.最後にターゲット中心部の強拡大観察を行う.そこでは微小血管構造(vascular pattern)を含めた表面構造を詳細に観察し,異常所見の種類・程度を判定しつつ,組織学的異型度の推定すなわち良・悪性診断を進めていく.出血防止の観点から拡大観察・撮像した後,直ちに一旦,病変から離れることに心がける.
9)扁平上皮下進展:扁平円柱上皮境界(squamocolumnar junction:SCJ)にかかる癌病変の場合,その52%に扁平上皮下進展(Figure 12-a)を認めたと報告されており 13),Barrett食道内の円柱上皮だけでなく,口側の扁平上皮も注意深い観察が必要である.Yamagataらは酢酸併用拡大観察による扁平上皮下進展部の特徴的内視鏡像としてsmall white signs(Figure 12-b:小孔,小白斑,溝状の構造)があり,それらの所見を用いれば100%正診できると報告している 22).small white signは組織学的に扁平上皮下進展した癌腺管が扁平上皮内に浸潤し表面に開口した像(Figure 12-c:黄色矢印)と捉えたものと考えられている.酢酸を用いなくともNBI拡大のみでも,扁平上皮に被覆された茶褐色調領域(しばしば異常血管を伴う)として診断可能であった症例も報告されている 23),24)(Figure 12-d).
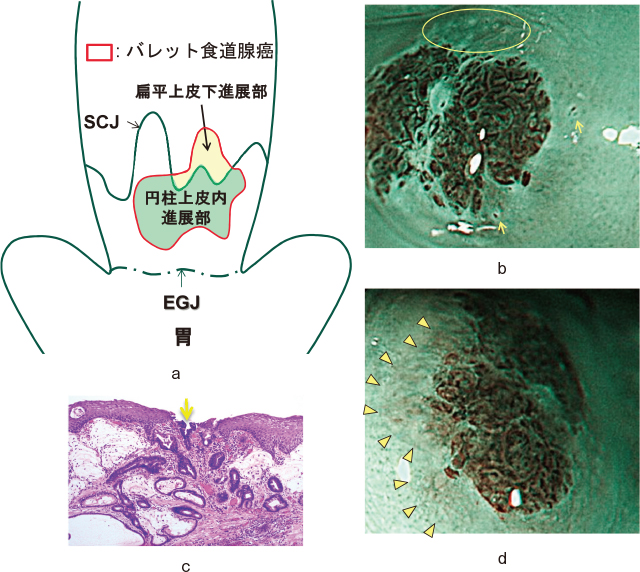
Barrett食道腺癌の扁平上皮下進展.
a:扁平上皮下進展のシェーマ.
b,d:酢酸NBI拡大像(黄色矢印・楕円内:小孔,黄色矢頭:扁平上皮で被覆されたbrownish area).
c:small white sign(小孔)の組織学的所見(H.E.染色:黄色矢印は癌腺管開口部).
(酢酸法)
酢酸は細胞質の蛋白を可逆的に変性させて光の透見性が低下し,白色化(acetowhitening)させることにより,粘膜微細模様の視認性を向上させる.さらに拡大観察の併用や白色化の消失時間が異なる現象を活用することによって,dysplasia・表在癌の検出や範囲診断に有用である.
酢酸法の内視鏡検査には,0.6~5%と様々な濃度の酢酸溶液が用いられ,主に薬局方酢酸(約30%,純度100%に近いものは“氷酢酸”と呼ばれる)を希釈して使用されてきた.しかし,安全性を考慮し,あらかじめ希釈した酢酸を各施設の薬剤部で調合することを推奨されている.
酢酸法は粘膜を刺激するため,粘液産生が亢進する.拡大観察の際のスコープ先端と粘膜との接触により,粘液産生はさらに亢進するため,酢酸撒布後,長時間にわたり拡大観察を行うと粘膜表面に白濁した粘液が付着し,拡大観察の妨げとなる.よって,酢酸撒布後は粘膜との不要な接触を避け,可及的に速やかな(拡大)観察に心掛けるよう留意する 25).
酢酸を用いた内視鏡観察・診断テクニックとして,以下の4つの方法があるとされる.
1)酢酸拡大法
Barrett食道の観察に初めて応用したGuelrudら 26)に続き,Toyodaらは酢酸と拡大内視鏡との併用で描出されるpit patternを分類し,ridge/gyrusおよびvillous patternがBEのSIMに特徴的patternであることを示した 27).その後,dysplasiaの検出にも酢酸法+拡大内視鏡併用の有用性が報告されるようになった.最近,dysplasiaの既往のないlow risk BE患者に対する大規模コホート試験の成果が報告され,酢酸法による狙撃生検はランダム生検より生検個数は15倍少ない上に,その検出率は有意に高かった(12.5% vs. 2%) 28).
2)酢酸ダイナミック・ケミカル法
Yagiらが胃がんに対して考案した診断法で,酢酸による角化の消失時間が組織学的異型度と相関することが示され,Barrett食道にも応用された 29).Barrett食道における報告では,HGD/cancerは120秒以内で酢酸による白化が消失しており,白化の消失時間のカット・オフ値を142秒とした場合,感度98%,特異度84%の精度でSIMなどのcolumnar metaplasiaとの鑑別が可能とされている.さらにBarrett腺癌部においては,白化消失時間が深達度(M/SM)と相関する可能性も示唆されている 30).
3)酢酸・インジゴカルミン併用法
早期胃癌の範囲(広がり)を診断する際に用いられる方法で,Barrett食道への応用も可能と思われるが,まとまった症例の報告はない.1.5%酢酸撒布した後にインジゴカルミンを追加撒布する酢酸・インジゴカルミン・サンドイッチ法 31)と0.6%酢酸とインジゴカルミンの混合液を撒布する方法(acetic acid-indigocarmine mixture:AIM) 32)がある.1.5%酢酸とインジゴカルミンを混合すると粘液の増加と固着化が起こり,病変の観察が不明瞭になる場合もあるため,AIM法では低濃度(0.6%)の酢酸が使用される.癌部にはインジゴカルミンが付着しないが非癌部にはインジゴカルミンが付着するという現象に基づいた診断法であり,酢酸ダイナミック・ケミカル法に準じて10秒から20秒後に観察すると癌部は赤,非癌部は青という良好なコントラストで範囲診断が可能になる.ただし,非癌上皮で被覆され,粘膜中層を癌が伸展しているような病変(未分化型癌・一部の中分化型管状腺癌)では,非癌粘膜と同様にインジゴカルミンが付着するため注意を要する.
4)酢酸・NBI併用法
1.5%酢酸撒布後にNBIを用いて病変の(拡大)観察を行う方法で,本邦報告例に限られるものの,酢酸法の中で最も多くのBarrett食道に関する検討がされてきた観察法である 33),34).酢酸による白色化で視認性が向上した粘膜微細模様をNBIでさらにコントラストを強調されるため,NBIのみでは視認不可または不明瞭な粘膜模様をも描出できる.拡大観察を併用することにより,癌・非癌の質的診断から範囲診断まで可能となる.われわれも酢酸NBI併用法が有用であったLSBEに発生したBarrett食道腺癌の1例を経験したので内視鏡像をFigure 13に示す.

a:C10M12のLong segment Barrett’s esophagus(LSBE).
b,c:酢酸撒布するとBarrett食道全体が白色化したが,1-2分後に3カ所の発赤域を認めた(①~③).①・③は丈の低い隆起と発赤調を呈する浅い不整形の陥凹からなり,②は類円形の平坦な発赤域を示した.
d,e:①の酢酸NBI拡大像.浅い不整形陥凹部は領域性の茶褐色調を呈し,表面構造は主に微小化・不明瞭化している(d).demarcation lineを認め(黄色点線),陥凹の中心部には大型かつ不整な絨毛様構造もみられる(黄色矢頭).
f:①は組織学的に高分化型管状腺癌(tub1)の像を示し,一部には乳頭状構造もみられた.
g:②の酢酸NBI拡大像.比較的均一な円形~類円形のピット様構造が規則的には配列している(組織学的にはgoblet cellを伴う単腺管で構成された腸上皮化生粘膜).
h:③の酢酸NBI拡大像.陥凹の周囲から中心部に伸びる大型化した表面構造がみられる(組織学的にはgoblet cellを伴う再生上皮が認められた).
(NBI拡大法)
通常の白色光内視鏡の光がRed/Blue/Greenの3色で構成されているのに対し,NBIは主に粘膜表層で反射・吸収されるBlue/Greenのみを使用しているため,表面構造(粘膜・血管)のコントラストが向上し,さらにヘモグロビン吸光特性に合わせ狭帯域化されているため(Blue,415nm;Green,540nm),微小血管の微細構造が強調される.NBI観察のターゲットは粘膜表層に限局した腫瘍病変であり,Barrett食道では基本的に拡大観察を併用し,その粘膜微細構造(mucosal pattern,MP)と微小血構造(vascular pattern,VP)に基づいて内視鏡的診断を行う.
現時点において,国内外を問わず,最も臨床研究が進んでいるIEEはNBIであり,拡大観察を併用することによって,その有用性が最も発揮される 35).前述したごとく,NBI拡大内視鏡診断のMP/VPに基づいており,欧米においていち早く体系化された 36)~38).しかし,それらは非SIM/SIM/dysplasia・癌の3段階に分類されており,分類が複雑であること,複数の分類が提唱されたことにより混乱が生じ,実臨床の場に普及するに至らなかった.
そこで,非SIMからの発癌機序の存在を指摘する報告が増加しておりSIM診断の臨床的意義が低下してきていること,内視鏡的治療の適応となりえるdysplasia/表在癌など臨床的取扱いに直結した診断がより重要視されるようになったことによりMP/VPをそれぞれregular/irregularの2つに大別するのみの簡略化された分類の標準化が試みられている.
この簡略化分類は,BING(Barrett International Group)分類と呼称され,Dual scope(GIF-HQ290;Olympus Corporation, Tokyo, Japan)を用いた国際間多施設検討(アメリカ・日本・オランダ・ドイツ)が行われた.6人のexpertsが前向きに取得した画像を評価した結果,早期癌に対する診断精度はAccuracy/Sensitivity/Specificityは85.4/80.4/88.4(%)で,観察者間一致度はκ=0.68と良好な結果が得られている 39).
Barrett食道におけるNBI拡大診断の難点の一つとして,胃や大腸とことなり,Flat patternと称されるMPが消失した非腫瘍粘膜の存在にある.MPの消失・不明瞭化は早期胃がんに特徴的なNBI拡大所見と捉えている本邦内視鏡医にとって,欧米の内視鏡医以上にFlat patternを非癌として認識できない可能性があり,より明確に定義する必要があると考えられた.
そこで筆者らはFlat patternに特徴的な所見として,①明らかな領域性がない(no demarcation line) ②模様のない完全に平坦な光沢のある粘膜面 ③NBI拡大で上皮下に緑色調の太い静脈が透見される(Green thick vessel:Figure 14)があることを報告した 40).さらに内視鏡初学者8人に対して,改訂版BING分類の講義前後のラーニング・カーブを検討した所,Flat patternの正診率は講義前の13%から講義後の92%へと著明に向上しており,われわれの追加したFlat patternの定義の有用性が示唆された(unpublished data).

Flat patternを伴うBarrett食道のNBI像.
a:弱拡大:画像右側には円形ピット様の粘膜模様が密在している(白線内)が,左側の扁平上皮に接した部位(白破線内)において,円形ピット様の粘膜模様は点在するのみで大部分消失している.
b:中拡大:粘膜模様の消失した部位は完全に平坦で,円形ピットの粘膜模様の密在する部位との境界は不明瞭であり,複数の太い緑色の血管が透見される(Green thick vessels:黄色矢印).
BING分類は簡素化・標準化を目的に作製されたが,Regular/Irregularの分類では拡大内視鏡像がイメージし難く,一般の内視鏡医にまで広く普及させるのは難しいのではないか,また,内視鏡分類は作成するだけでは,片手落ちであり,効率的かつ高精度の最適な診断アルゴリズムを示せなければならない,などの意見がある.現在,日本食道学会においてBarrett食道・表在癌の拡大内視鏡作成委員会(委員長:小山恒男先生)が組織され,本邦の内視鏡診療に即した新規拡大内視鏡分類が検討されている.
本稿ではBarrett腺癌に対する通常および拡大内視鏡の手技・診断について,実際の症例を供覧しつつ概説した.われわれ内視鏡医は内視鏡治療で根治可能な早期の段階で癌病変を発見する使命を担っていると筆者らは考えている.本稿で述べたBarrett食道における通常内視鏡・拡大内視鏡のテクニックと診断体系が,その使命を果たす一助となることを切に望みたい.
本論文内容に関連する著者の利益相反:なし