2018 年 60 巻 3 号 p. 223-229
2018 年 60 巻 3 号 p. 223-229
症例は40歳,男性.前医で上部消化管内視鏡(esophagogastroduodenoscopy;EGD)にて前庭部小彎に10mm大の隆起性病変(0-Ⅱa)を認め,精査目的で当院受診となった.背景胃粘膜に萎縮性変化は認めず,同病変に対して内視鏡的粘膜下層剥離術(Endoscopic submucosal dissection:ESD)を施行した.病理組織学的には高分化型管状腺癌(粘膜内癌)であり,免疫組織化学染色ではCDX2とCD10が陽性,MUC5ACとMUC6が陰性で腸型形質を発現していた.周囲の胃粘膜において鏡検法でHelicobacter pylori(HP)は認めず,血清HP抗体と尿素呼気試験は陰性であり,HP除菌歴もなかった.本症例はHP未感染の患者に発生した腸型形質を有する胃癌であり,比較的まれなため報告する.
Helicobacter pylori(HP)感染による慢性胃炎が胃癌の危険因子であることは証明されているが 1),HP未感染の胃粘膜に発生する胃癌の頻度は全体の約1%程度と言われており 2),発癌機序は未だ明らかにはなっていない.近年,HP感染率の低下 3)や疾患概念の定着もあり,HP未感染胃癌の報告例が増加している.今回われわれは,これまで報告されているHP未感染胃癌の特徴とは異なる稀な症例を経験したので文献的考察を加え報告する.
症例:40歳,男性.
主訴:なし.
既往歴:左大腿ガングリオン.
生活歴:喫煙歴は15本/日を20年間.飲酒歴は2合/日(日本酒換算)を20年間.
家族歴:父 胃癌.
現病歴:HP除菌歴はない.2016年2月に前医にて健康診断の再検査のためEGDを施行し,前庭部小彎に隆起性病変を指摘された.生検組織診でGroup 3 or 4と診断され,3月に当院紹介受診となった.
内服薬:なし.
現症:身長169cm,体重73kg.体温35.9℃,血圧152/107mmHg,脈拍80bpm(整).心音整,肺音清,腹部は平坦軟で圧痛なし.
検査所見:血清HP抗体<3.0U/ml,尿素呼気試験0‰でありともに陰性であった.CEA 1.1ng/ml,CA19-9 9.22U/mlと腫瘍マーカーの上昇はなく,一般検査に特記事項はなかった.
上部消化管内視鏡所見:胃角~胃体下部小彎にregular arrangement of collecting venules(RAC)を有しており,背景胃粘膜に萎縮性変化や腸上皮化生は認めなかった.前庭部小彎やや後壁よりに10mm大の隆起性病変を認めた(Figure 1-a).病変は正色調から軽度発赤調であり,前医での生検の影響もあり表面に軽度陥凹を有していた.インジゴカルミン撒布像では境界は明瞭となった.Narrow band imaging(NBI)併用拡大観察では,明瞭なdemarcation lineを認め,内部の表面微細構造と微小血管構築像は共に不整であった(Figure 1-b).

上部消化管内視鏡.
a:通常観察像.前庭部小彎やや後壁よりに10mm大の隆起性病変を認めた.
b:NBI観察像.明瞭なdemarcation lineを認め,内部の表面微細構造と微小血管構築像は共に不整であった.
臨床経過:生検組織診では一部に異型腺管があり,円形~楕円形核を有し,核配列の乱れを認めたため,Group 5を指摘された.腹部造影CTで明らかな転移を認めないため,早期胃癌0-Ⅱa(cT1aN0M0 stageⅠA)と診断し,ESDを施行した.経過良好にて術後6日目に退院となった.治療後,現時点で再発は認めていない.
病理組織学的所見:切除標本の肉眼的所見は,9×9mm大の0-Ⅱa病変であった.組織学的には腫瘍部では分岐した腺管が密に配列し,核の大小不同やmitosisを認めるため,高分化型腺癌に合致する所見であった.深部には非腫瘍性の幽門腺を認め,線維化はほとんど認めなかった(Figure 2).免疫組織化学染色像では,胃型形質マーカーであるMUC5ACとMUC6は陰性であり,腸型形質マーカーであるMUC2は一部陽性,CDX2とCD10は陽性であった(Figure 3).細胞増殖能マーカーであるKi-67染色では,増殖細胞は腫瘍腺管の全層にびまん性に分布しており,表層でより強く染色されていた.ESD検体における背景粘膜(非腫瘍部)の組織所見では,腺窩上皮の過形成が見られたが,炎症細胞の浸潤は乏しく,幽門腺の萎縮や腸上皮化生は認めず,組織学的に胃炎像は認めなかった.また,鏡検法によるHPは確認されなかった.最終病理診断は,L,Less,Type 0-Ⅱa,9×9mm,tub1,pT1a,UL(-),ly(-), v(-),pHM0,pVM0であった(胃癌取扱い規約 第14版 4)).

ESD検体の病理組織像(HE染色).
腫瘍部では分岐した腺管が密に配列し,核の大小不同やmitosisを認めた.
a:40倍.
b:400倍.
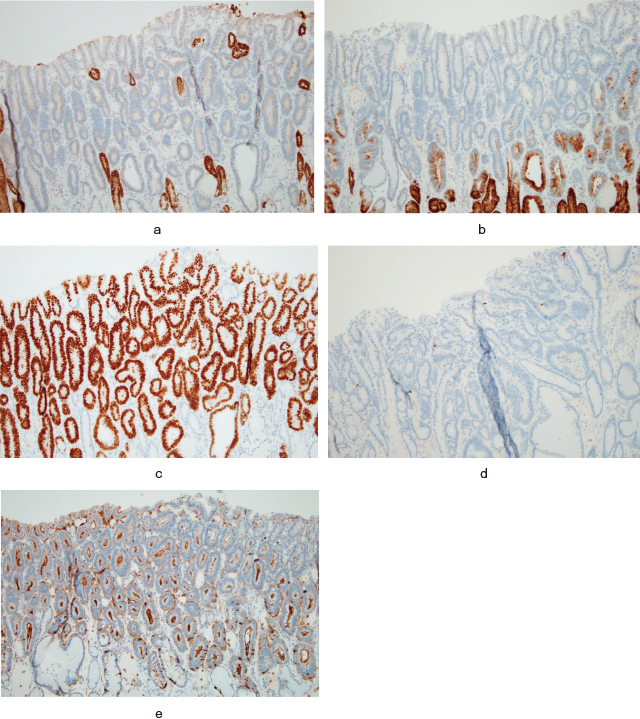
免疫組織化学染色像.
MUC5ACとMUC6は共に腫瘍部では陰性であった.CDX2とCD10は陽性,MUC2は一部陽性であった.
a:MUC5AC.
b:MUC6.
c:CDX2.
d:MUC2.
e:CD10.
本邦におけるHP未感染胃癌の頻度は,全胃癌の約1%程度と言われている 2).HP未感染の定義で定まったものはないが,Onoら 5)や藤崎ら 6)の厳密な診断基準では「内視鏡所見で萎縮がないこと」,「病理所見で萎縮がないこと」,「2つ以上の臨床検査所見(尿素呼気試験,血清IgG抗体,迅速ウレアーゼテストなど)でHP陰性」,「血清ペプシノーゲン(PG)法陰性」,「除菌歴がないこと」を満たすものとしている.山本ら 7)は必要最小限の診断基準として,「内視鏡所見で萎縮がないこと」,「病理所見で萎縮がないこと」,「血清PG法陰性」の2つ以上を満たし,「尿素呼気試験または血清IgG抗体が陰性」,「除菌歴がないこと」を提唱している.このようにHP未感染の証明には自然除菌例や既往感染などを除外するために複数の検査結果で慎重に判断する必要がある.本症例は除菌歴がなく,血清IgG抗体と尿素呼気試験が陰性,内視鏡的にRACを有し胃粘膜に萎縮を認めないこと,九嶋ら 8)の報告のようにESD検体を用いたupdated Sydney Systemのvisual analogue scale 9)に準じた評価で組織学的胃炎の所見はなく,鏡検法でHP陰性であることから,HP未感染と考えた.
HP未感染胃癌の発癌機序は未だ明らかにはなっていないが,若年者のHP感染率の低下 3)や内視鏡的病理学的な検討 6),10)~12)もあり,HP未感染胃癌の報告例が増加している.これまでに報告されているHP未感染胃癌の内訳としては,胃体部から胃底部に好発する印環細胞癌などの未分化型癌が多く,多くの症例では褪色調を呈し,粘膜内の発育態度も粘膜中層のみ,もしくは中層から上層に発育するとされ 6),CDH1遺伝子変異などの関与が知られている 12).分化型癌では近年報告例が増加しているものとして胃体上部に好発する胃底腺型胃癌があり,初期の肉眼型は0-Ⅱa/0-Ⅱc型の形態をとり,高率に粘膜下層へ浸潤するが,悪性度は低く予後は良好であるとされ 11),GNAS変異が報告されている 12).いずれも胃型の粘液形質を有する傾向にありHP未感染胃癌の特徴であるとされている 10).本症例は前庭部に発生した低異型度高分化型管状腺癌で,MUC5ACとMUC6が陰性,CDX2とCD10が陽性のため腸型形質を発現しており,これまで報告されている多くのHP未感染胃癌の特徴とは異なっている.本症例では,腫瘍部に杯細胞が少数含まれるためMUC2が一部陽性となるが,MUC2やCD10の発現がなくともCDX2が陽性であれば腸型への分化を示唆するとされている 8).粘液形質の検討は胃癌の分化傾向や発生母地を推測するのに有用とされ,HP未感染では組織学的胃炎を認めないため,そこから発生した胃癌は胃型形質を示すと推測されている 13).癌細胞の腸型化は癌の進展に伴う変化のひとつと言われているが 8),粘膜内癌である本症例では癌の進行による二次性変化とは考えにくく,初期段階から腸型形質を有していることが予想される.
HP感染以外の胃癌の原因として,自己免疫性胃炎,Epstein-Barr virus(EBV)感染,生活習慣(塩分摂取,高血糖など),遺伝的要因などが挙げられる.EBV関連胃癌は,胃体上中部に発生することが特徴的で,病理学的には高度のリンパ球浸潤を伴う中~低分化腺癌が特徴とされている 14).本症例ではEBER-ISH(EBV encoded small RNA in situ hybridization)によるEBV感染の検索を行っていないが,病理学的にリンパ球浸潤が目立たないためEBVが関与している可能性は低いと考える.遺伝性胃癌の中で代表的なものとしては,CDH1変異を特徴とする遺伝性びまん性胃癌(hereditary diffuse gastric cancer;HDGC)や家族性大腸腺腫症(familial adenomatous polyposis;FAP)に合併した胃癌がある.HDGCは,明確な腫瘤形成を伴わず,低分化腺癌や印環細胞癌が正常粘膜下にびまん性に浸潤する特徴が報告されている 15),16).FAPに合併した胃癌の内視鏡的特徴としては,胃穹窿部から胃体部大彎に多発する胃底腺ポリポーシスと前庭部に発生する腺腫が知られ 17),APC遺伝子の体細胞性変異が原因と報告されている 18).本症例では遺伝子検索は行っていないが,HDGCとFAPの家族歴はなく,内視鏡所見などの臨床像がそれらと異なっていると考える.
医学中央雑誌(会議録を除く)にて「H.pylori陰性」,「胃癌」を,PubMedにて「Helicobacter pylori negative」,「gastric adenocarcinoma」をkey wordに,1983年から2017年6月の期間で検索を行った.内視鏡所見の詳細な記載かつ粘液形質の検討があり腸型もしくは腸型優位の混合型を発現している分化型癌の症例報告は5例 19)~23)であり,それらに自験例を加え臨床的特徴について記載したものをTable 1に示す.なお,腸型形質を一部有し胃型優位の混合型を発現する高分化型管状腺癌 24),胃底腺ポリープや過形成性ポリープの癌化例,食道胃接合部癌は除外した.年齢は30歳代~70歳代まで幅があり,男性2例,女性4例であった.肉眼所見は0-Ⅱcが2例,0-Ⅱa+Ⅱcが2例,0-Ⅱaが2例と様々であり一定の傾向はなかった.内視鏡的には全例でdemarcation lineを認め,内部の微小血管構築像や表面微細構造に不整を伴うため,腫瘍性病変を想起することは可能であったと推察される.病理学的に分化型癌と腸型腺腫の鑑別に苦慮することがあり,本症例でも前医での生検ではGroup 3 or 4の診断であった.具嶋ら 25)の検討では高異型度腺腫と低異型度腺癌の鑑別にはHE染色による核形態や核配列の診断が重要であると述べている.本症例では核配列に乱れがあり,核は円形~楕円形を呈しており,分化型癌と診断し得たが,紡錘形核が極性を保持している部分もあり,生検部位によっては腸型腺腫と診断されていた可能性もある.腸型腺腫との診断に迷う場合はESDにて一括切除し病理学的に検討することが肝要と考える.注目すべき点としては,全例前庭部に発生しており,高分化型管状腺癌(粘膜内癌)を呈し,ESDで治癒切除されていることである.限られた症例数ではあるが,発生部位が前庭部に偏在していることは,本症例のようなHP未感染胃粘膜に生じる腸型形質の高分化型管状腺癌の特徴であると思われる.本症例では腫瘍周囲に腺窩上皮の過形成が見られ化学性/反応性胃炎と言える組織像であるが,胆汁が貯留した胃小窩を認めなかったため,厳密には胆汁逆流の証明は困難であった.胆汁酸が腸上皮化生や発癌に与える影響についての報告 26)~28)は散見されるが,十二指腸液逆流の暴露期間や量と発癌の関連性は定かではない.Table 1で示すように,発症年齢にはばらつきがあり,少なくとも暴露期間は大きく関与していないと思われる.病理学的に胆汁逆流を証明できなかったため,胆汁酸がどの程度発癌に関与したかは不明であるが,胆汁酸によりde novoに発癌が惹起された可能性は否定できない.しかしESD検体の背景粘膜において腸上皮化生など組織学的胃炎を認めないため,胆汁酸の暴露のみが発癌の原因とは考えにくい.癌化の経路として遺伝子異常が存在する可能性もあり,検討していく必要があると思われる.また,背景粘膜に炎症が乏しいHP未感染胃癌では発育が緩徐であると言われており,HP未感染胃に生じる腸型形質を有した高分化型管状腺癌の生物学的態度についても明らかにしていく必要がある.
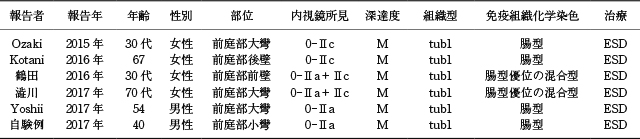
H.pylori未感染胃粘膜に発生した腸型形質を発現する高分化型管状腺癌の報告例.
ESDによって治癒切除し,免疫組織化学染色にて腸型形質であることを明らかにしたHP未感染の低異型度高分化型管状腺癌の1例を経験した.病態の把握のためにも今後さらなる症例の蓄積が必要である.
本症例の病理学的な評価につきご指導頂きました製鉄記念広畑病院 病理診断科 伊藤敬先生に深謝申し上げます.
本論文内容に関連する著者の利益相反:なし