要旨
近年,良好な予後が期待出来るStage 0,Ⅰ膵癌の画像および臨床徴候の報告が散見される.多数例の集積報告から,契機となる画像所見はUSの膵管拡張が最も重要で,CTで腫瘍が描出されなくてもMRI(MRCP),EUSで膵全体を俯瞰する必要性が示唆されている.膵癌診療ガイドライン2016では,小型腫瘍性病変が同定された場合はEUS-FNAの施行を検討し,膵管狭窄および口径不同,周囲の膵嚢胞性病変を認めた場合はERCP下連続膵液細胞診(SPACE)の施行を提案している.小型腫瘍性病変に対するEUS-FNAの正診率は高率であるが,経胃的穿刺の場合はtract seedingの可能性を念頭におく.SPACEは特に上皮内癌の診断に有用であるが,検査後の膵炎に注意する.また,危険因子を有する症例に対するEUSの介入は,早期診断に有用である可能性があり,一部の地域医療圏では病診連携を生かした取り組みが成果をあげている.一方で,内視鏡的に採取した十二指腸液,膵液中の遺伝子異常,miRNAの変化に着目した新規マーカーの研究も進捗している.早期診断され切除となった症例では,再発の形式が進行癌と異なる可能性が報告されており,今後CTにEUSを加えた長期的な経過観察法の検討が求められる.
Ⅰ はじめに
膵癌は画像診断技術が進歩した現在でも,早期診断は困難であり,その予後は依然として不良である.一方最近,日本膵臓学会(以下JPS)の膵癌登録の成績
1),米国の成績
2),また2018年初頭に報告された200例のStage 0およびⅠ膵癌の国内多施設共同研究の成績
3)などから,早期診断された膵癌,特に腫瘍径が10mm以下の膵癌では良好な予後が期待されている.
膵癌は大半が膵管由来の膵管癌であり,癌のごく早期の段階から膵管に閉塞や狭窄が生じて膵液の通過障害が生じた結果,癌そのものの画像による認識が不可能な段階でも,膵管の口径不同,狭窄,拡張,および分枝膵管の部分的な拡張を小型貯留性の膵嚢胞性病変として把握できる可能性が推測されている
4).
本稿では,膵癌早期診断における内視鏡検査とくにEUSとERCPの役割,およびその診断上の課題について概説する.
Ⅱ 膵癌診療ガイドライン
JPSでは,2006年に膵癌診療ガイドラインの初版を作成し
5),以降定期的な改訂を行い,現在は2016年版を発刊している
6).現行版では,早期診断に関するClinical Questionが設定されている(Figure 1).具体的には,腫瘍径10mm以下を“早期診断”の目標とすること,USやCTで腫瘤を直接認めない症例でも,膵管の拡張,膵嚢胞性病変などの間接所見が指摘された場合は,EUS,MRI(MRCP)を用いて膵全体を俯瞰すること,腫瘤性病変が認められる場合はEUS-FNAを,腫瘤は認めないがEUSやMRCPで膵管の異常や膵嚢胞性病変がみられる場合はERCPを施行し,膵管所見に応じて内視鏡的膵管ドレナージ(ENPD)を留置し,複数回の膵液細胞診を行うことを提案している.
Ⅲ 早期診断された膵癌の徴候と画像所見
2014年に設立された膵癌早期診断研究会(JEDPAC)では,膵癌早期診断例の詳細な症例検討を通じて,画像所見や病理学的診断の問題点などを討議しているが,2017年に多施設共同で,外科的に切除され病理学的にStage 0,Ⅰと確定診断された症例の集積を行った.その結果Stage 0が51例,Stage Ⅰが149例,合計200例が登録され,臨床徴候,画像所見の特徴,病理学的な確定診断などに関して検討が行われた
3).
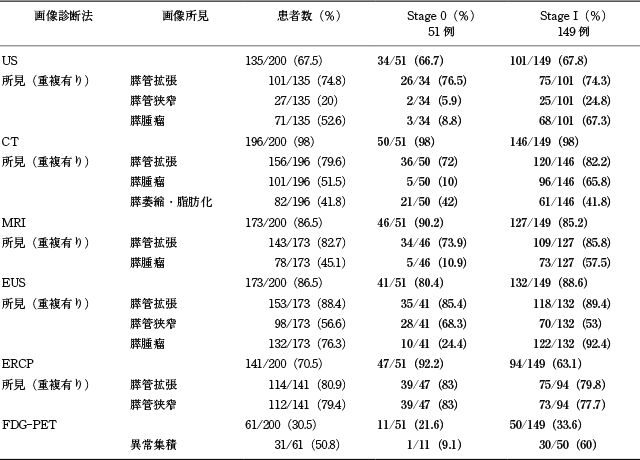
臨床徴候に関しては,無症状例が75%と多数であり,精査中の発見例ではUSでの膵管拡張が契機となった症例が多い.一方でCEA,CA19-9など血中腫瘍マーカーの上昇は極めて低率であった.また,糖尿病や冠動脈疾患など他疾患スクリーニング中の診断症例が半数を占めていた(Table 1).
次に画像所見のまとめをTable 2に示す.上皮内癌に該当するStage 0の所見(Figure 2)に関しては,膵管拡張がUS,CT,MRI(MRCP),EUS,ERCPで72%~85.4%に認められ,EUSが最も高率であった.膵管狭窄の描出はUSでは極めて低率であり,EUSで68.3%,ERCPで83%とERCPが最も高率であった.また,興味深い所見として間質浸潤していないStage 0でも画像で膵腫瘤として描出された症例があり,特にEUSでは24.4%であった.近年,膵上皮内癌成分の周囲間質に限局性の膵管周囲炎,線維化,脂肪組織の沈着がみられるとの報告が散見され
7)~14),今回のCT所見でも42%で萎縮・脂肪化が指摘されていることから,上皮内癌の周囲間質の随伴所見がEUSでは低エコー腫瘤様に描出されている可能性がある
7),8),14).
一方Stage Ⅰの所見に関しては,Stage 0と同様に膵管拡張がUS,CT,MRI(MRCP),EUS,ERCPで74.3%~89.4%に認められ,EUSが最も高率であった.膵腫瘤の描出はUS,CTでは60%後半であったが,EUSでは92.4%と非常に高率であった.なお,FDG-PETの異常集積は60%であり早期診断には限界があることが示唆された.
以上の結果から,膵癌の早期診断においてEUSは膵管の異常や膵腫瘤の描出に関して重要な位置づけにある.また,従来のUS,CTを用いた“腫瘤”の同定から“腫瘤”を認めない症例でも膵管拡張が見られる場合には,EUS,MRI(MRCP)およびERCPを介入し,膵管の異常所見を確認する診断アルゴリズムの変換が求められている
3),4),6),8).
Ⅳ 早期診断におけるEUSとERCPの位置づけ
現在の膵癌診療ガイドラインでは,各種画像診断にて膵に腫瘤性病変を認める場合はEUS-FNAを,腫瘤は認めないが膵管の異常がみられる場合はERCPおよび複数回の膵液細胞診を提案している
6).
EUSは膵の分解能に優れており,腫瘍径が1cm以下の膵癌症例においてもその描出率は高率である
15),16).また2010年に保険収載されたEUS-FNAに関しては,今回のJEDPACの報告などでも高率な正診率が報告されている(Table 3)
4),17).一方で,EUS-FNAは腫瘤がなければ施行することは困難である.膵上皮内癌では約40%の症例において癌周囲の線維化,炎症,脂肪沈着がみられ,この部位がEUSで淡い低エコー領域として描出されることがあり
3),4),癌が浸潤していない部位を誤って穿刺する恐れ,また癌が検出された場合でも結果的に膵管穿刺となり,播種の恐れが危惧される
18).また,近年,膵体尾部癌の術前確定診断の目的にて経胃的ルートから主に22G針を用いてEUS-FNAを施行した後に,穿刺ライン上の胃壁にtract seedingを認めた症例が報告されている
19)~26).中には,術前の進行度がT1N0M0でありながら,術後2年以内に胃壁に再発し,5年生存を達成し得なかった症例もみられる
26).Tract seedingの可能性は低率と推測されているが,患者の予後を大きく左右する現象であるため,長期生存を目指す早期診断例においてEUS-FNAによる組織採取を施行する際には,穿刺ラインを可能な限り術野に含めることを念頭に置くべきである
20).また今後,小径25G針の使用,穿刺針先端の形状,吸引条件などに関してtract seedingを避けるための検討が必要であろう.
次に,ERCPに関する成績について概説する.ERCPの特徴として,膵管の直接造影から主膵管の狭窄や閉塞,分枝膵管の描出,嚢胞性病変の膵管との交通の確認など細かな膵管の画像情報が得られ,膵管生検やブラッシング細胞診の併用で,標的病変から膵外に逸脱なく検体採取が可能なことなどがあるが,検査後に膵炎,出血,胆管炎を合併する可能性がある
27).膵管生検単独の成績は陽性率が低率であり
28),膵管ブラッシングの併用で68%に改善したとの報告
29)があるが,早期診断例を対象とした報告はほとんどみられない.
近年,小型の膵腫瘍性病変を認めた場合,確定診断を目的にEUS-FNAを先行して選択する施設が増加しているが,腫瘍性病変が認められず,主膵管に限局的な狭窄,口径不同,その周囲に嚢胞性病変を認めた場合,ENPDを留置して複数回の膵液細胞診を施行する方法(Serial pancreatic-juice aspiration cytologic examination:SPACE)が,膵上皮内癌を含む微小膵癌の診断に有用との報告が増加しており
3),4),8),9),12)~14),現行の膵癌診療ガイドラインでも提案されている
6).SPACEの特徴として,腫瘍径がより小径の症例で感度が良好であり
4),30)~32),特に上皮内癌では良好(70-100%)である可能性が報告されている(Table 3)
4),30),31).一方で,SPACEの標準的な方法はまだ確立されておらず,留置する症例の適応,至適チューブ径及び留置時間,膵液採取の間隔などに関して今後の検討が待たれる.また,SPACEでは膵液細胞診の判定も重要であるが,特にクロマチンの増量,不均等分布,多彩性に着目して判定する方法が報告されている
33).ENPD後膵炎に関しては,4Fr.と5Fr.チューブの前向きな比較試験の結果,4Fr.では4.1%と5Frより有意に低率であったとの報告
34)がみられ,検査後膵炎を回避するためチューブの小径化が有用である可能性が示唆される.
Ⅴ 膵癌高危険群に対するEUSおよびERCP
現行の膵癌診療ガイドラインでは,Table 4に示すような膵癌の危険因子が記載されている.
これらを有する症例に対して,内視鏡検査(特にEUS)を用いたスクリーニングの成績が散見される.海外からは,家族性膵癌,遺伝性膵炎の家系
35),BRCA2,STK11変異などの異常を有する症例
36)~38)に対する定期的なEUSの介入が,膵腫瘍性病変の描出,膵管拡張やIPMNを含む膵嚢胞性病変など間接所見の描出に有用であり,早期診断に寄与する可能性が推測されている.国内からは,分枝型膵IPMNに対してCTとEUSを用いた前向き経過観察
39)およびERCPの介入
40)が,併存する通常型膵癌の早期診断に有用であったとの報告がみられる.また,JPSでは,家族性膵癌に該当する登録症例に対してEUSを含めたスクリーニングを行う研究(家族性膵癌登録制度)
41),2,000例を超える分枝型膵IPMNに対しCT,EUS,MRCPを半年ごとに5年間施行して経過観察する前向き研究が進行中であり
42),早期診断に関する今後の成果に期待が寄せられている.
国内の地域医療圏では,膵癌診療ガイドラインに記載された膵癌危険因子を複数以上有する症例に開業医でのUSを介入し,膵管拡張,膵嚢胞等の異常所見がみられた場合,中核施設で積極的にEUSを行った結果,多数の早期診断例が得られ,一部の地域では5年生存率の改善がみられている
3),8),43).今後は地域医療圏での病診連携を生かした膵癌早期診断の取り組みの拡散も期待される.
Ⅵ 十二指腸液及び膵液を用いた早期診断マーカー
実地臨床で膵癌早期診断を非侵襲的に行うために,現在も広く用いられている血清CEA,CA19-9を上回る感度,特異度を目指した新規診断マーカーの開発が進捗している.
内視鏡的に回収された十二指腸液中のK-rasやp53変異に着目した検討
44),45),上記を含めてSMAD4,GNAS,CDK2Aなど多数の遺伝子を組み合わせての検討
46),S100PおよびCEAを組み合わせての検討
47)などが報告されている.また,膵液を用いた報告ではmi-RNAの変化に着目し,高い感度及び特異度が得られたとの報告
48),膵上皮内癌でも変化を検出した報告
49)がみられ,早期診断への応用が期待されている.
Ⅶ 早期診断例の切除後経過観察の問題点
従来実地臨床において,切除された膵癌の経過観察法には一定の指標がなく,各施設の判断に委ねられていた.Miyazakiらは進行膵癌症例の術後再発形式について,約70%に肝臓,肺,腹膜など膵以外の部位に認められ,残膵再発はわずか6.7%であったと報告している
50).膵癌診療ガイドライン2016年版では,切除後の経過観察法はFigure 3のとおり記載されているが,術後に内視鏡を用いた経過観察法の提案はみられない
6).Miyazakiらの報告は主として進行癌を対象にした成績である.Ikemotoらは,16例のStage 0,14例のStage Ⅰ症例を前向きに追跡した成績を報告したが
51),観察期間の中央値が53.9カ月の段階で,Stage 0で2例,Stage Ⅰで7例の再発を認め,うち8例は残膵再発であった.造影CTで残膵に嚢胞性病変や膵管拡張を指摘した後,EUSで小型腫瘤性病変を残膵に指摘可能であった症例がみられる.以上の結果から,膵癌早期診断例の術後では,膵以外の臓器に加えて,EUSを含めた残膵の厳重な観察が求められ,術後経過観察法の再検討が必要と考えられる.
Ⅷ おわりに
膵癌早期診断に関する内視鏡の役割と今後の課題について概説した.本論文の内容が,今後実地臨床における早期診断技術の進歩に繋がることを期待する.
本論文内容に関連する著者の利益相反:花田敬士(ガデリウス・メディカル)
文 献
- 1. Egawa S, Toma H, Ohigashi H et al. Japan Pancreatic Cancer Registry;30th Year Anniversary. Pancreas 2012; 41: 985-92.
- 2. Hur C, Tramontano AC, Dowling EC et al. Early pancreatic ductal adenocarcinoma survival is dependent on size. Pancreas 2016; 45: 1062-6.
- 3. Kanno A, Masamune A, Hanada K et al. Multicenter study of early pancreatic cancer in Japan. Pancreatology 2018; 18: 61-7.
- 4. Hanada K, Okazaki A, Hirano N et al. Effective screening for early diagnosis of pancreatic cancer. Best Pract Res Clin Gastroenterol 2015; 29: 929-39.
- 5. 科学的根拠に基づく膵癌診療ガイドライン2006年版.日本膵臓学会膵癌診療ガイドライン作成小委員会編,金原出版,東京,2006.
- 6. 膵癌診療ガイドライン2016年版.日本膵臓学会膵癌診療ガイドライン改訂委員会編,金原出版,東京,2016.
- 7. 花田 敬士, 南 智之, 岡崎 彰仁ほか.膵上皮内癌の臨床病理学的特徴.肝胆膵 2017; 75: 561-6.
- 8. Hanada K, Okazaki A, Hirano N et al. Diagnostic strategies for early pancreatic cancer. J Gastroenterol 2015; 50: 147-54.
- 9. Satoh T, Kikuyama M, Kawaguchi S et al. Acute pancreatitis-onset carcinoma in situ of the pancreas with focal fat replacement diagnosed using serial pancreatic-juice aspiration cytologic examination(SPACE). Clin J Gastroenterol 2017; 10: 541-5.
- 10. Matsuda Y, Furukawa T, Yachida S et al. The prevalence and clinicopathological characteristics of high-grade pancreatic intraepithelial neoplasia:autopsy study evaluating the entire pancreatic parenchyma. Pancreas 2017; 46: 658-64.
- 11. Miyata T, Takenaka M, Omoto S et al. A case of pancreatic carcinoma in situ diagnosed by repeated pancreatic juice cytology. Oncology 2017; 93(Suppl 1): 98-101.
- 12. 菊山 正隆, 花田 敬士, 植木 敏晴.膵体部高度脂肪化をCTにて確認した膵上皮内癌の3例.膵臓 2015; 30: 626-32.
- 13. 進藤 浩子, 深澤 光晴, 高野 伸一ほか.分枝型膵IPMNに併存した膵上皮内癌の1例.膵臓 2015; 29: 742-8.
- 14. 前平 博充, 杉浦 禎一, 金本 秀行ほか.周囲に線維化領域を形成した膵上皮内癌の1例.膵臓 2014; 29: 919-25.
- 15. 坂本 洋城, 北野 雅之, 竹山 宣典ほか.1cm以下小膵癌の診断のためのアプローチ―各画像診断の比較―.胆と膵 2009; 30: 335-41.
- 16. Yasuda I, Iwashita T, Doi S et al. Role of EUS in the early detection of small pancreatic cancer. Dig Endosc 2011; 23(Suppl 1): 22-5.
- 17. Uehara H, Ikezawa K, Kawada N et al. Diagnostic accuracy of endoscopic ultrasound-guided fine needle aspiration for suspected pancreatic malignancy in relation to the size of lesions. J Gastroenterol Hepatol 2011; 26: 1256-61.
- 18. 真口 宏介.早期膵癌発見への努力と今後の方向性.日消誌 2018; 115: 317-26.
- 19. Sakamoto U, Fukuba N, Ishihara S et al. Postoperative recurrence from tract seeding after use of EUS-FNA for preoperative diagnosis of cancer in pancreatic tail. Clin J Gastroenterol 2018; 11: 200-5.
- 20. Minaga K, Takenaka M, Katanuma A et al. Needle tract seeding:an overlooked rare complication of endoscopic ultrasound-guided fine-needle aspiration. Oncology 2017; 93(suppl 1): 107-12.
- 21. Iida T, Adachi T, Ohe Y et al. Re-recurrence after distal gastrectomy for recurrence caused by needle tract seeding during endoscopic ultrasound-guided fine-needle aspiration of a pancreatic adenocarcinoma. Endoscopy 2016; 48(suppl 1):E304-5.
- 22. Kita E, Yamaguchi T, Sudo K et al. A case of needle tract seeding after EUS-guided FNA in pancreatic cancer. Gastrointest Endosc 2016; 84: 869-70.
- 23. Tomonari A, Katanuma A, Matsumori T et al. Resected tumor seeding in stomach wall due to endoscopic ultrasonography-guided fine needle aspiration of pancreatic adenocarcinoma. World J Gastroenterol 2015; 21: 8458-61.
- 24. Sakurada A, Hayashi T, Ono M et al. A case of curatively resected gastric wall implantation of pancreatic cancer caused by endoscopic ultrasound-guided fine-needle aspiration. Endoscopy 2015; 47(suppl 1):E198-9.
- 25. Katanuma A, Maguchi H, Hashigo S et al. Tumor seeding after endoscopic ultrasound-guided fine needle aspiration of cancer in the body of the pancreas. Endoscopy 2012; 44(suppl 2):E160-1.
- 26. Paquin SC, Gariepy G, Lepanto L et al. A first report of tumor seeding because of EUS-guided FNA of a pancreatic adenocarcinoma. Gastrointest Endosc 2005; 61: 610-1.
- 27. 花田 敬士.膵胆道領域における経乳頭的細胞診・組織診.Gastroenterol Endosc 2018; 60: 260-9.
- 28. 菅野 敦, 正宗 淳, 吉田 直樹ほか.経乳頭的胆管・膵管生検細胞診.胆と膵 2015; 36: 947-54.
- 29. 小山内 学, 真口 宏介, 高橋 邦幸ほか.通常型膵癌診断における経乳頭的生検・ブラッシング細胞診の成績.Gastroenterol Endosc 2008; 50: 400-5.
- 30. Iiboshi T, Hanada K, Fukuda T et al. Value of cytodiagnosis using endoscopic nasopancreatic drainage for early diagnosis of pancreatic cancer. Pancreas 2012; 41: 523-9.
- 31. Mikata R, Ishihara T, Tada M et al. Clinical usefulness of repeated pancreatic juice cytology via endoscopic naso-pancreatic drainage tube in patients with pancreatic cancer. J Gastroenterol 2012; 48: 866-73.
- 32. Kato S, Zakimi M, Yamada K et al. Efficacy of repeated cytology of pancreatic juice obtained by endoscopic nasopancreatic drainage tube for early diagnosis of pancreatic cancer:a case series including a case of carcinoma in situ. Clin J Gastroenterol 2015; 8: 240-6.
- 33. 佐々木 健司, 杉山 佳代, 神田 真規ほか.内視鏡的経鼻膵管ドレナージ留置下膵液細胞診における膵上皮内腫瘍性病変の鑑別.J Jpn Clin Cytol 2017; 56: 1-8.
- 34. Mouri T, Sasaki T, Serikawa M et al. A comparison of 4-Frwith 5-Frendoscopic nasopancreatic drainage catheters: A randomized, controlled trial. J Gastroenterol Hepatol 2016; 31: 1783-9.
- 35. Joergensen MT, Gerdes AM, Sorensen J et al. Is screening for pancreatic cancer in high-risk groups cost-effective? - Experience from a Danish national screening program. Pancreatology 2016; 16: 584-92.
- 36. Poley JW, Kluijt I, Gouma DJ et al. The yield of first-time endoscopic ultrasonography in screening individuals at a high risk of developing pancreatic cancer. Am J Gastroenteol 2009; 104: 2175-81.
- 37. Canto MI, Hruban RH, Fishman EK et al. Frequent detection of pancreatic lesions in asymptomatic high-risk individuals. Gastroenterology 2012; 142: 796-804.
- 38. Canto MI, Goggins M, Yeo CJ et al. Screening for pancreatic neoplasma in high-risk individuals:an EUS-based approach. Clin Gastroenterol Hepatol 2004; 2: 606-21.
- 39. Ohtsuka T, Ideno N, Aso T et al. Role of endoscopic retrograde pancreatography for early detection of pancreatic ductal adenocarcinoma concomitant with intraductal papillary mucinous neoplasms of the pancreas. J Hepatobiliary Pancreat Sci 2013; 20: 356-61.
- 40. Kamata K, Kitano M, Kudo M et al. Value of EUS in early detection of pancreatic ductal adenocarcinoma in patients with intraductal papillary mucinous neoplasms. Endoscopy 2014; 46: 22-9.
- 41. 森実 千種, 北野 雅之, 肱岡 範ほか.膵癌早期診断に向けた家族性膵癌登録.膵臓 2017; 32: 23-9.
- 42. 真口 宏介, 大塚 隆生.IPMN登録事業と前向き予後調査.Annual Review消化器2016,竹原徹郎ほか編,中外医学社,東京,2016;163-7.
- 43. Sakamoto H, Harada S, Nishioka N et al. Asocial program for the early detection of pancreatic cancer:The Kishiwada Katsuragi Project. Oncology 2017; 93(suppl 1): 89-97.
- 44. Eshleman JR, Norris AL, Sadakari Y et al. KRAS and guanine nucleotide-binding protein mutations in pancreatic juice collected from the duodenum of patients at high risk for neoplasia undergoing endoscopic ultrasound. Clin Gastroenterol Hepatol 2015; 13: 963-9.
- 45. Kanda M, Sadakari Y, Borges M et al. Mutant TP53 in duodenal samples of pancreatic juice from patients with pancreatic cancer or high-grade dysplasia. Clin Gastroenterol Hepatol 2013; 11: 719-30.
- 46. Yu J, Sadakari Y, Shido K et al. Digital next-generation sequencing identifies low-abundance mutations in pancreatic juice samples collected from the duodenum of patients with pancreatic cancer and intraductal papillary mucinous neoplasms. Gut 2017; 66: 1677-87.
- 47. Mori Y, Ohtsuka T, Kono H et al. A minimally invasive and simple screening test for detection of pancreatic ductal adenocarcinoma using biomarkers in duodenal juice. Pancreas 2013; 42: 187-92.
- 48. Wang J, Raimondo M, Guha S et al. Circulating microRNAs in pancreatic juice as candidate biomarkers of pancreatic cancer. J Cancer 2014; 5: 696-705.
- 49. Yu J, Li A, Hong SM et al. MicroRNA alterations of pancreatic intraepithelial neoplasms. Clin Cancer Res 2012; 18: 981-92.
- 50. Miyazaki M, Yoshitomi H, Shimizu H et al. Repeat pancreatectomy for pancreatic ductal cancer recurrence in the remnant pancreas after initial pancreatectomy:is it worthwhile? Surgery 2014; 155: 58-66.
- 51. Ikemoto J, Hanada K, Minami T et al. Prospective follow-up study of the recurrence of pancreatic cancer diagnosed at an early stage. The value of endoscopic ultrasonography for early diagnosis of recurrence in the remnant pancreas. Pancreas 2018; 47: 482-8.