2019 年 61 巻 10 号 p. 2372-2378
2019 年 61 巻 10 号 p. 2372-2378
症例は79歳男性.高度貧血を主訴に近医を受診し小腸腫瘍が疑われたため当院紹介となった.造影CT,PET-CTで空腸に腫瘤性病変を認めたため,経口シングルバルーン小腸内視鏡検査と小腸カプセル内視鏡検査を行った.2型病変を空腸に認める以外に十二指腸水平部にも0-Ⅱc病変を認め,いずれの病変も腺癌の病理結果であった.リスク因子となる炎症性腸疾患や遺伝性疾患(FAP,Lynch syndrome,Peutz-Jeghers syndrome)を認めない,非常に稀な原発性同時多発小腸癌を経験したため報告をする.
原発性小腸癌は消化管原発の悪性腫瘍として比較的稀であるが,原発性同時多発小腸癌は特に稀であり,本邦報告でも数例しか認めていない.今回われわれは貧血を契機にみつかった原発性同時多発小腸癌の1例を経験したので報告をする.
患者:79歳,男性.
主訴:息切れ,黒色便.
既往歴:直腸癌,高血圧,高尿酸血症.
家族歴:母;胃癌.
内服歴:Vonoprazan fumarate 20mg/day,Azilsartan/Amlodipine besilate combination tablet(20mg/5.0mg)/day,Quinapril hydrochloride10mg/day,Febuxostat 10mg/day.
手術歴:47歳時に直腸癌手術(Well differentiated adenocarcinoma in adenoma,INFα,m,aw(-),ow(-),ly0,v0,n(-)).
現病歴:2018年3月上旬頃から体動時の息切れと黒色便を認めたため,かかりつけ医を受診した.採血でHb 4.1g/dLと高度の貧血を認めたために近医に緊急入院となった.上下部内視鏡検査では明らかな出血部位は特定できなかった.小腸造影検査で空腸に腫瘍性病変を認め,同部位が貧血の原因と考えられたため,精査加療目的で2018年4月上旬に転院となった.
入院時検査所見:WBC 4,390/μL,RBC 253×104/μL,Hb 7.7g/dL,HCT 24.3%,Plt 16.5×104/μL,CRP 0.03mg/dL,T-Bil 0.4mg/dL,LDH 200U/L,AST 32U/L,ALT 43U/L,ALP 229U/L,γ-GTP 71U/L,Na 142mEq/L,K 4.4mEq/L,Cl 111mEq/L,BUN 16mg/dL,Cr 1.20mg/dL,TP 5.0g/dL,Alb 3.1g/dL,CEA 1.4ng/mL,CA19-9 5.8U/mL,CA125 9.8U/mL,IL-2R 541U/mL.
腹部造影CT検査:空腸の一部に壁肥厚を認め,空腸周囲腸管膜にリンパ節腫大を認めた.
PET-CT:空腸壁肥厚と一致した部位に局所性集積を認め,空腸周囲腸管膜に異常集積を伴うリンパ節を認めた.
経口シングルバルーン小腸内視鏡:Treitz靱帯よりやや肛門側に周堤隆起を伴う不整形な潰瘍性病変(2型)を認めた(Figure 1-a).自然出血を伴い全周性の狭窄を呈しているが,肛門側への通過は可能であった(Figure 1-b).インジコカルミン撒布で腫瘍と正常組織との境界がより明瞭になった.十二指腸水平部に辺縁が白色化(milk-white mucosa)した発赤調の浅い不整な陥凹性病変(0-Ⅱc)を認めた(Figure 1-c).NBI非拡大観察で辺縁の白色化と病変腺管のirregularityが強調され(Figure 1-d),インジコカルミン撒布で境界がより明瞭になった.生検病理で2病変ともWell differentiated tubular adenocarcinomaの結果であった.
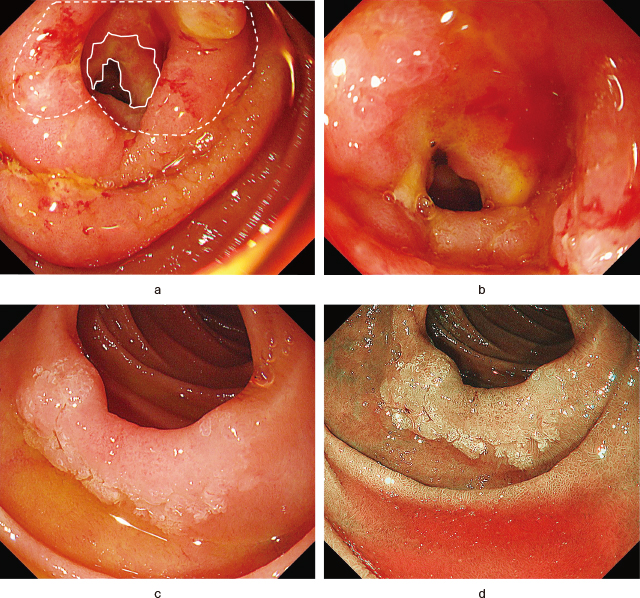
a:経口シングルバルーン小腸内視鏡.
空腸の腫瘍性病変(2型),通常観察遠景像.2型病変(実線)より連続する術後判明した0-Ⅱa病変を認めた(実線と点線の範囲内).
b:経口シングルバルーン小腸内視鏡.
空腸の腫瘍性病変(2型),通常観察近景像.自然出血を伴う潰瘍性病変であり,全周性の狭窄を呈していた.
c:経口シングルバルーン小腸内視鏡.
十二指腸水平部の腫瘍性病変(0-Ⅱc),通常観察像.辺縁が白色化(milk-white mucosa)した発赤調の浅い不整な陥凹性病変を認めた.
d:経口シングルバルーン小腸内視鏡.
十二指腸水平部の腫瘍性病変(0-Ⅱc),NBI非拡大観察像.辺縁の白色化と病変腺管のirregularityが強調された.
小腸造影:経口シングルバルーン小腸内視鏡下でガストログラフィン小腸造影を行った.Treitz靱帯よりやや肛門側に50mmほどの狭窄を伴った全周性の2型病変を認めた(Figure 2).十二指腸水平部の浅い陥凹性病変(0-Ⅱc)は小病変のため描出できなかった.それぞれの病変に対して口側の1cm離した部位にマーキングクリップを施行した.

小腸造影.
Treitz靱帯より肛門側に狭窄を伴った全周性の腫瘍性病変を認めた(矢印).
小腸カプセル内視鏡検査:Treitz靱帯近傍の2病変を認める以外に併存する腫瘍性病変は認めなかった(Figure 3).
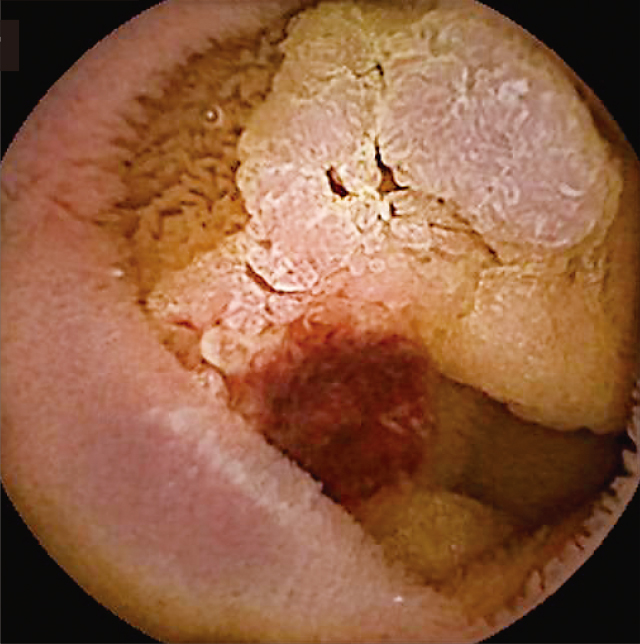
小腸カプセル内視鏡.
0-Ⅱc病変近景像,腫瘍中央部に生検による出血を認めた.
上部内視鏡検査:H. Pylori除菌後の,萎縮性化生性胃炎を認めた.
下部内視鏡検査:直腸(Ra)に術後瘢痕を認めるが明らかな再発所見は認めなかった.
以上より空腸と十二指腸水平部に存在する原発性同時多発小腸癌(2型,T3,N1,M0,cStageⅢA+0-Ⅱc,Tis,N0,M0,cStage0)の診断で外科手術となった.
手術所見:正中切開で開腹手術を行った.30年前の大腸癌手術の影響で腹腔内の癒着は高度であり,広範囲に渡る剝離が必要であった.切離範囲は口側の0-Ⅱc病変に対して行った術前マーキングクリップを目印として,肛門側の2型病変と転移リンパ節を含めて切離をした.十二指腸水平部断端と空腸断端との端々吻合を行って手術を終了した.
切除標本肉眼所見:口側断端から14.5cm,肛門側断端から28.0cm部位に49×38mm大,全周性の腫瘍を認めた.腫瘍は0-Ⅱa様の粘膜進展と2型様の比較的境界明瞭な潰瘍形成性の形態を呈しており,浸潤の最も深い部分では漿膜側に突出する隆起を認めた.よって2型+0-Ⅱaの混合型である5型病変とした.腸管膜には切除縁近傍に27×19×13mm大のbulkyな腫瘤形成を認めた.また口側断端から1.0cm,肛門側断端から47.0cmの十二指腸水平部に26×7mm大の0-Ⅱc病変を認めた.
病理組織所見:5型(2型+0-Ⅱa)病変では,0-Ⅱa部位で管状から乳頭状の増殖をしており,また2型部位で乳頭腺管状から篩状の浸潤増殖を主体としていた(Figure 4-a).2型部位のMP以深の浸潤部で胞巣状,シート状,柵状の組織像を呈しており腫瘍全体としての組織型はtub2>por1-2>tub1-papであった.腫瘍は慢性炎症細胞浸潤,線維増生,硝子化を伴って浸潤をしており,漿膜表面に近接はするものの露出は見られなかった.粘膜下層から漿膜下層で中等度のリンパ管侵襲を認め,静脈侵襲は粘膜下層で軽度見られた.また腸管膜の腫瘤は腺癌のリンパ節転移であった.0-Ⅱc病変は管状乳頭状の高分化腺癌であった(Figure 4-b).上皮内癌であり明らかな浸潤,脈管浸潤は認めなかった.
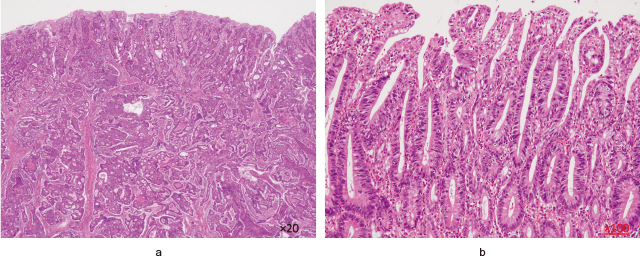
a:病理組織所見.
5型(2型+0-Ⅱa)病変は乳頭腺管状から篩状の浸潤増殖を主体としていた(HE×20).
b:病理組織所見.
0-Ⅱc病変は管状乳頭状の高分化腺癌であった(HE×100).
以上より進行空腸癌(5型,pT3(SS),pN1,cM0,pStageⅢA)と早期十二指腸癌(0-Ⅱc,pTis,pN0,cM0,pStage0)の同時多発小腸癌と最終病理診断をした(Figure 5).術後の追加検査としてPromegaパネルを行いMSS(microsatellite stable)の結果であった.
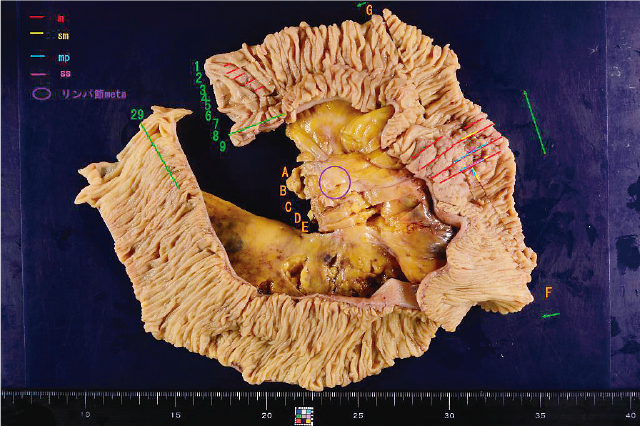
切除標本マッピング.
進行空腸癌と早期十二指腸癌の同時多発小腸癌と最終病理診断をした.進行空腸癌5型(2型+0-Ⅱa)は,2型部位がmp,ssに一致,0-Ⅱa部位がm,smに一致する.
原発性小腸癌は全消化管悪性腫瘍の0.1~0.3%を占めるに過ぎず,稀な疾患とされる 1).好発年齢は40~70歳代であり,性差は男性が女性の1.2倍とやや多い傾向にある 2).発生部位としては空腸が回腸の1.25倍で空腸に多く,空腸癌ではTreitz靱帯より60cm以内が,回腸癌では回盲部より60cm以内がそれぞれ約80%を占めており好発とされる 2).本症例においても空腸病変はTreitz靱帯より15cm肛門側に認め,過去の報告にある好発部位に一致している.本症例ではさらに十二指腸水平部にも病変を認めており,他臓器に原発となる病変を認めないために他臓器からの転移は考えられない事と,2病変が約10cm離れて存在し,壁内転移も考え難い事から,最終的に原発性同時多発小腸癌と診断をした.小腸癌統計における多発症例を見ると,1995年~1999年の統計では0%(0例/151例)であり多発例は非常に稀な症例と考えられる 2).過去10年間(2009年~2018年)で,原発,多発,小腸癌のkey wordを用いて医中誌で検索をしたところ,十二指腸のみの多発症例を除いた原発性同時多発小腸癌は6症例(空腸と空腸:1例,空腸と回腸:2例,回腸と回腸:3例)を認めるのみであった(Table 1) 3)~8).小腸癌の原因はいまだ良く判っておらず,リスク因子としては,Crohn病や潰瘍性大腸炎などの炎症性腸疾患が,また家族性大腸腺腫症やLynch症候群やPeutz-Jeghers症候群などの遺伝性疾患が知られている.上記6症例でリスク因子が判明しているものはCrohn病2症例,Lynch症候群2症例の計4症例であり,リスク因子が不明なものは2症例のみであった.今回われわれが経験した空腸と十二指腸の原発性同時多発小腸癌は基礎疾患に炎症性腸疾患は認めず,また家族性大腸腺腫症やPeutz-Jeghers症候群を疑う消化管病変は認めなかった.しかし母親が胃癌の家族歴がある事と,改訂ベセスダガイドラインでの第1次スクリーニング基準に当てはまる,50歳未満で診断された大腸癌の既往歴がある事から,Lynch症候群の可能性を考える必要があった.第2次スクリーニング検査として5種類(BAT25,BAT26,NR21,NR24,MONO27)のマイクロサテライトマーカーで構成されたPromegaパネルを用いたMSI(Microsatellite Instability)検査を行ったが,いずれのマーカーもMSIを示さないMSSの結果であり,Lynch症候群の可能性は低いと考えられた.以上より本症例はリスク因子が不明な非常に稀な原発性同時多発小腸癌と考えられた.現在考えられている小腸癌の発生頻度が低い理由としては,①小腸では内容物の滞留時間が少ないため発癌物質の暴露時間が少ない事,②発癌物質の分解酵素(benzpyrene hydroxylase)活性が大腸より高い事,③胆汁を発癌物質に変化させる嫌気性菌が少ない事,④液性,細胞性免疫が活発である事,などが挙げられている 9).本症例ではリスク因子が不明な事から,これらの発癌抑制機構のいずれかが,もしくは複合的な破綻を起こしたものと考えられ,結果として同時多発するような小腸癌が発生したのではないかと考えられる.
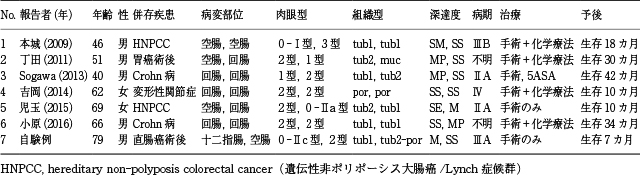
原発性同時多発小腸癌の文献報告例(自験例を含む).
近年,小腸癌の発見率,正診率は年々上昇してきていると三澤らが述べている 10).これは従来用いられていた造影CT,小腸造影検査に加え,直接小腸管腔内の観察を行う事ができるバルーン内視鏡,小腸カプセル内視鏡といった画像診断としてのmodalityが急速に増えた事により,小腸病変に対する画像診断能が各段に上昇したためと考えられる.本症例においても造影CTにおいては進行病変1病変のみと診断をしていたが,経口シングルバルーン小腸内視鏡,小腸カプセル内視鏡での詳細な小腸粘膜の観察を行う事で,さらに同時多発した早期小腸癌を発見できた.しかしこの様に画像診断能が各段に上がっているにも関わらず,小腸に対しては一般的に病変が少ないとされる事からスクリーニング検査を行う事が少ないのが現状である.そのため発見した時点ですでに進行癌になっている場合が多く,それ故に小腸癌の早期発見は難しいものと考えられている.過去の原発性同時多発小腸癌6症例中5症例(83%)でイレウスを起こして受診をしており,本症例ではイレウスではないものの高度貧血を認めて受診をしている.この様に進行病変症状を認めてからはじめて医療機関を受診して,進行小腸癌の診断に至る症例が多いと考える.早期での小腸癌の発見には,本症例の様なリスク因子が不明な症例では一般的に小腸スクリーニング検査を行わないため現実的には困難と思われるが,リスク因子のある患者に対しては低侵襲の小腸カプセル内視鏡をスクリーニング検査として積極的に用いる事が有効と考えられる.しかし現時点でのエビデンスがないために,リスク因子症例の具体的な選定基準が不明確であり,今後の研究課題と考える.
小腸癌は外科的根治手術が原則であるが,領域リンパ節以外の転移リンパ節や他臓器転移があるような根治手術が難しい症例も多く,予後改善につながる切除としての姑息手術が行われる場合も多い.本症例においては,領域リンパ節転移が造影CT,PET-CTで指摘をされていたが,それ以外に明らかな他臓器転移は認めなかったために根治手術を行っている.一般的に小腸癌の予後は不良とされ,米国の報告ではあるが5年生存率は十二指腸癌が28.2%,空腸癌が37.6%,回腸癌が37.8%と報告されている 11).また米国のNational Cancer Data Base(1985-2005)を基にした小腸癌25,053例の検討では,予後不良因子として男性,55歳以上,黒人,十二指腸と回腸,T4,リンパ節転移や遠隔転移の存在,低分化腺癌,切除縁浸潤などが挙げられている 12).米国の結果ではあるが,この結果をもとに本症例に当てはめて見ると,男性,55歳以上,十二指腸,リンパ節転移,低分化腺癌成分といった項目が予後不良因子として一致をしており,再発リスクが高いと考えられ術後の補助化学療法が必要と考える.
本邦における小腸癌の化学療法は,切除不能進行再発小腸癌,術後補助化学療法のいずれにおいても,その希少性が故に治療開発は進んでおらず,胃癌または大腸癌に準じて行われているのが現状であった.しかしPhaseⅡ試験での切除不能進行再発小腸癌24例に対するmFOLFOX6療法の有効性を見た試験で,抗腫瘍効果として全奏効率が45%,無増悪生存期間5.9カ月(1年無増悪生存割合23.3%),全生存期間17.3カ月との報告があったため 13),2018年9月よりmFOLFOX6がはじめて保険適応として認可をされている.補助化学療法としては,進行再発小腸癌で保険適応となったFOLFOX療法またはCAPOX療法が,現在小腸癌の補助化学療法として最も期待をされている.現在JCOG(日本臨床腫瘍グループ)が,CAPOX療法に対して,治癒切除後病理学的Stage Ⅰ/Ⅱ/Ⅲ小腸腺癌に対する術後化学療法ランダム化比較第Ⅲ相試験(J-BALLAD試験)として試験登録を開始している.今後本邦での新たなエビデンスのある小腸癌補助化学療法としてその結果が期待される.
今後原因不明の多発小腸癌・小腸癌の症例蓄積を行っていく事が,いまだに不明な小腸癌の発癌メカニズムに対する理解への手かがりになると考える.
稿を終えるにあたり,御指導賜りました一般・消化器外科 木南伸一先生,病院病理部 山田壮亮先生,塩谷晃広先生に深謝いたします.
本論文内容に関連する著者の利益相反:なし