2021 年 63 巻 6 号 p. 1248-1254
2021 年 63 巻 6 号 p. 1248-1254
【症例】77歳,男性.急性膵炎後の被包化膵壊死で経過観察中であった.6カ月前の腹部造影CTで病変は認めていなかったが,上部消化管内視鏡検診で胃噴門部に約2cm大の胃粘膜下腫瘍を疑う隆起を認めた.腫瘤は画像検査で鑑別診断がつかなかったこと,また増大傾向にあったため,EUS-FNAを行い炎症性筋線維芽細胞腫瘍の診断となった.腹腔鏡下腫瘍摘出術および胃部分切除で腫瘍は完全切除でき,病理組織学的には後腹膜原発炎症性筋線維芽細胞腫瘍と最終診断した.切除後18カ月再発はない.
【考察】上部消化管内視鏡検診で胃粘膜下腫瘍を疑う隆起を指摘され,炎症性筋線維芽細胞腫瘍の術前診断にEUS-FNAが有用であった症例を経験した.確定診断に低侵襲なEUS-FNAが有用であった.
炎症性筋線維芽細胞腫瘍(Inflammatory myofibroblastic tumor:IMT)は,筋線維芽細胞の増殖とリンパ球,形質細胞,好酸球などの炎症細胞浸潤を伴う腫瘍で,後腹膜から発生することは稀である.上部消化管内視鏡検診で胃粘膜下腫瘍を疑う隆起を指摘され,EUS-FNAで術前診断し,腹腔鏡下腫瘍摘出術で切除できた後腹膜原発のIMTを経験したので報告する.
患者:77歳,男性.
主訴:なし.
現病歴:約2年前に胆石性急性膵炎を発症し入院となり,急性膵炎改善後に内視鏡的乳頭切開術および胆管結石除去術を行った.急性膵炎では膵尾部腹側を中心に被包化膵壊死を合併していたため,定期的に腹部CTを行い被包化膵壊死は自然消退していた.また6カ月前の腹部造影CTでは後腹膜に腫瘤性病変はみられなかった.今回は,近医で行った上部消化管内視鏡検診で,胃噴門部に約2cm大の胃粘膜下腫瘍を疑う隆起が指摘され当院へ紹介となった.
既往歴:10歳代 急性虫垂炎に対して虫垂切除術,60歳代 発作性心房細動,非定型抗酸菌症,前立腺肥大症,70歳代 胆石性急性膵炎,腹腔鏡下胆嚢摘出術.
生活歴:飲酒なし,喫煙なし.
内服歴:リマプロストアルファデクス,トコフェロールニコチン酸,ミラベグロン,シロドシン,ラベプラゾールナトリウム,エリスロマイシンステアリン酸塩,ラクトミン.
血液生化学検査:血算,血液生化学検査に異常所見はなく,CEA 1.3ng/ml,CA19-9 8.3U/ml,sIL-2R 378U/mlで基準値内であった.
腹部造影CT(Figure 1):単純CTでは胃噴門部背側に約25mm大の境界やや不明瞭な低吸収値を示す腫瘤性病変を認め,造影CTでは淡く造影された.
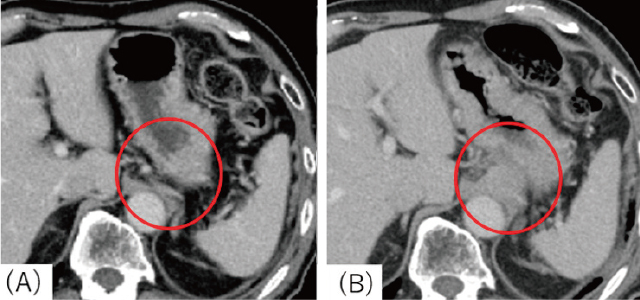
造影CT(平衡相).
A:胃粘膜下腫瘍を疑う隆起指摘6カ月前:病変は認められなかった.
B:胃粘膜下腫瘍を疑う隆起指摘時:胃噴門部背側に約25mm大の低吸収を示す腫瘤性病変を認められた.腫瘤性病変と胃は接していたが,境界は保たれており浸潤はないものと判断した.造影では病変部は染影された.
EUS(Figure 2,3):胃噴門部背側に約20mm大の胃粘膜下腫瘍を疑う隆起が認められた.胃と接していたが胃の壁外に存在していた.腫瘤は約22mm大の境界明瞭で輪郭はやや不整,内部は低~等エコーが混在し,パワードプラでは血流シグナルが内部に一部認められ,観察範囲内にリンパ節の腫大はなかった.
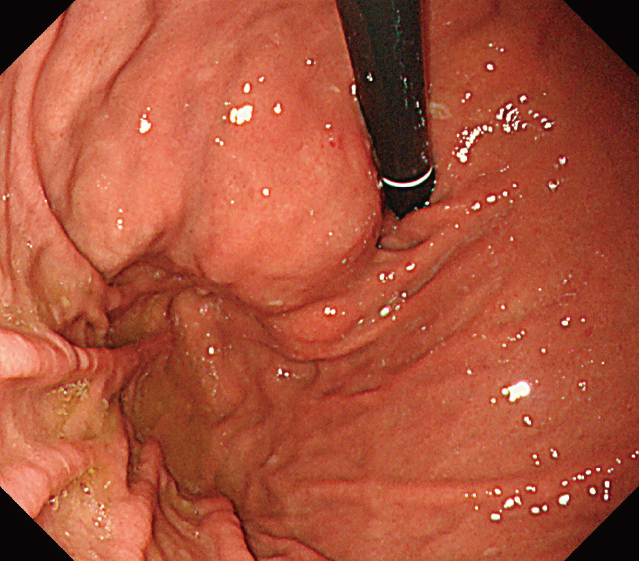
EUS施行前の上部消化管内視鏡検査所見.
胃噴門部背側に約20mm大の胃粘膜下腫瘍を疑う隆起あり.
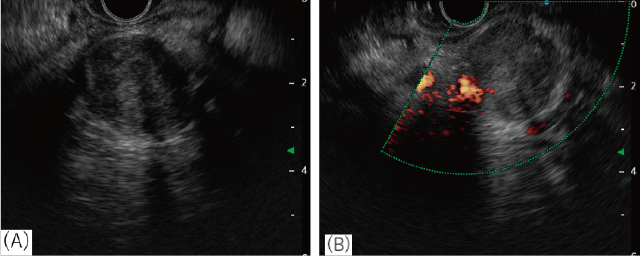
EUS,B-modeで胃噴門部から観察.
A:約22mm大の境界明瞭で,内部は低~等エコーが混在した腫瘤であり,胃の壁外に存在していた.
B:パワードプラでは血流シグナルが内部に一部認められた.
PET-CT:腫瘍にFDGの集積が認められ,早期SUV max=4.6,後期SUV max=6.2であった.
病変は6カ月前の腹部造影CTではみられていなかったことから,増大傾向にある後腹膜腫瘍と考えた.2カ月後に施行した腹部造影CTで,腫瘍は35mm大に増大が認められた.造影では早期濃染はなかったものの,後期相で腫瘍辺縁のみ造影された.腫瘍の増大が認められたことから,消化管間葉系腫瘍や後腹膜腫瘍を考慮し,EUS-FNAを行う方針とした.
EUS-FNAおよび病理組織所見:GF-UCT260(OLYMPUS社),Aquire 22G(Boston Scientific社)を使用した.EUS-FNAは経胃的に穿刺し,シリンジで20mlの陰圧をかけ,各20ストロークで生検を3回施行した.病理組織所見では,核の腫大した紡錘形細胞の増生があり,免疫染色でVimentin陽性,α-SMA陽性,DOG-1陰性,C-KIT陰性,S-100陰性であったことからIMTを第一に考え,鑑別疾患として平滑筋肉腫,炎症性線維性ポリープ,腹腔内デスモイドを考慮した.期間での腫瘍の増大が認められたことから悪性の可能性も考慮し,先ずは腹腔鏡下腫瘍摘出術による切除の方針とした.
術中所見および病理組織所見(Figure 4):腹腔鏡下で胃部分切除および腫瘍摘出を施行した.腫瘍は胃噴門部背側にあり,左横隔膜脚と連続していた.また,胃と癒着しており,浸潤の可能性も考えられたため,腫瘍摘出および胃部分切除を行った.切除検体は40×37×25mm大の結節状腫瘤で,病理組織所見では,腫瘍は胃壁には浸潤しておらず,後腹膜原発の腫瘍がEUS-FNAの穿刺により,胃壁に癒着していたものと考えられた.腫瘍は紡錘形細胞の増生からなり,間質にはリンパ球や形質細胞,好中球などの炎症細胞浸潤が認められた.免疫染色ではVimentin陽性,α-SMA陽性,Desmin陰性,anaplastic lymphoma kinase(以下ALK)陰性,DOG-1陰性,C-KIT陰性,S-100陰性,Ki-67 10%程度であり,炎症細胞が中心であったことからIMTの診断となった.腫瘍の切除断端は陰性であった.術後経過は問題なく,術後18カ月経過しているが再発は認めてない.
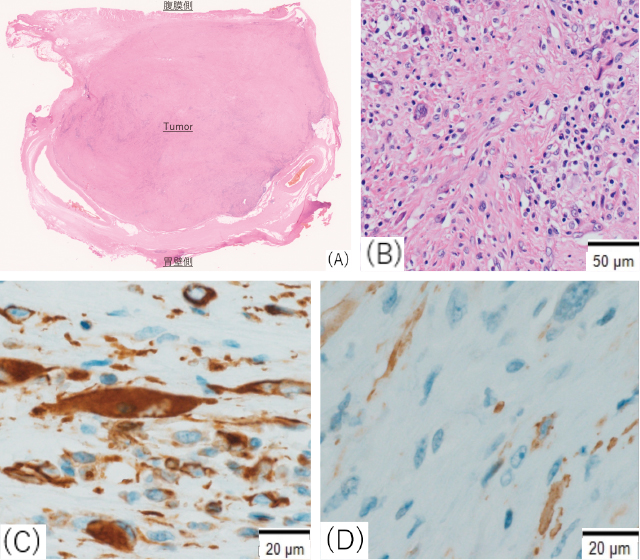
病理組織所見(手術検体).
A:ルーペ像:胃壁外に腫瘍が確認され,浸潤は認められなかった.
B:HE染色:腫瘍は紡錘形細胞の増生からなり,間質にはリンパ球や形質細胞,好中球が認められた.
C:Vimentin:陽性.
D:α-SMA:陽性.
以上の所見からIMTに矛盾しない所見であった.
IMTは,WHOの軟部腫瘍分類が2013年に改訂され,筋線維芽細胞の増殖とリンパ球,形質細胞,好酸球などの炎症細胞浸潤を特徴とする中間悪性腫瘍と定義されている 1).IMTという用語は,以前は炎症性偽腫瘍と呼ばれていたが,1990年にPettinatoらが肺の炎症性偽腫瘍の検討を行い,腫瘍を構成している主な細胞が筋線維芽細胞であることからIMTとして報告したのが最初である 2).病理組織学的には良悪性の中間群とされているが,局所浸潤所見や再発をすることもあるため悪性腫瘍との鑑別が困難とされている 3).また成因としては,炎症性病変であるIMTは,感染症や外傷,手術後の炎症,悪性腫瘍が報告されており 4),本症例も病変部近傍の被包化膵壊死の既往および胆嚢摘出術の既往が成因となった可能性が考えられた.また一方で,腫瘍細胞にクローナルな染色体異常がみられた症例の報告 5)もあり,成因はいまだ不明である.
IMTの発生部位は肺に多いとされているが,大網,腸間膜,後腹膜,消化管,泌尿器などの肺外病変からの報告や,稀に中枢神経組織や骨にも発生するといわれている 6).IMTは10~20歳代に多く,明らかな性差はないとされている 6).臨床症状では,無症状での発見の報告は少なく 7),発熱や体重減少,貧血などが報告されているが,病変の発生部位によって症状が異なり,特異的な症状はない 8).また血液生化学検査所見も特異的な項目はない.自験例も約6カ月と比較的短期間で増大したが無症状であり,上部消化管内視鏡検診で偶発的に2cm大の胃粘膜下腫瘍を疑う隆起として早期発見できたことが完全切除につながったと考えられた.
腹部発生IMTの画像所見の検討では,CTでは筋と比べて低~等吸収値とされ,造影効果はみられるが染まり方は多様であり 9),また腫瘍が大きければ内部に壊死を伴うこともある.MRIではT1強調画像で低信号,T2強調画像では高信号を呈し,造影では不均一に濃染される.FDG-PETがIMTの補助診断として有効であったとの報告例もあるが 10),IMTでは悪性腫瘍と同様に遅延相でSUVが増悪することも多く,鑑別は困難であると考えられた.
診断は生検や外科的切除により初めて確定することが多い 11).近年ではEUS-FNAで術前診断されている症例の報告もある 12),13).自験例の造影CTでは遷延性の造影効果を認め,壊死などを反映する造影不良域はなかった.FDG-PETでは集積が認められ,経時的に増大していることから悪性腫瘍を考えたが確定診断は困難であったため,EUS-FNAによる組織診断が必要であった.
病理組織学的には,リンパ球や形質細胞を主とする炎症細胞の浸潤を伴う紡錘形細胞の増殖が特徴である 6).IMTでみられる紡錘形細胞に多形性はなく,比較的均一な形態を示し,核分裂像は症例により異なるものの異常分裂像はないとされている 14).免疫組織化学的には,IMTは筋線維細胞の特徴を有することから,Vimentin,α-SMA,Desminの陽性率が高く,上皮マーカーの陽性率は低いとされている 15).また筋線維芽細胞におけるチロシンキナーゼ受容体蛋白であるALK蛋白の発現がIMTの50%程度で陽性とされており,免疫組織化学検査が鑑別に有用であると考えられている 16),17).またIMTで遠隔転移を認めた症例は,すべてALKが陰性であったとの報告もあり 17),18),ALK陰性がIMTの予後不良因子になるという考えもある 19).自験例は免疫組織化学検査で,C-KITおよびDOG-1が陰性であることからGISTは否定的であり,Vimentin,α-SMAが陽性であることがIMTの診断の一因となった.しかしALKは陰性であり,遠隔転移や局所再発など術後の経過はより注意してみていくべきであると考えられた.
IMTの治療法の第一選択は,浸潤のある臓器を含めた外科的完全切除である.切除不完全例では,腫瘍摘出後の比較的早期に再発を来すことが多いとされている 20).また局所再発の過程で悪性転化例の報告もあるため 21),浸潤所見が認められる症例を中心に完全切除の可否や,十分な切除範囲を得るのも重要であると考えられた.再発または切除不能な腫瘍に対する標準的な治療法は現時点で確立されていない.etoposideやcisplatin,adriamycin,methotrexateなどを使用した化学療法が報告されており 6),22),epirubicin,dacarbazine,docetaxelの3剤併用の化学療法で腫瘍の部分奏効の報告もある 23).また最近は,ALK変異を有する非小細胞肺癌に適応とされているALK阻害薬のcrizotinibが有効であることが報告されている 24).
1983年から2020年までの医学中央雑誌で「炎症性筋線維芽細胞腫瘍」,「後腹膜」をキーワードとして検索したところ,詳細な記録がある症例は自験例を含めて9例であった(Table 1).患者の平均年齢は55.3歳(24~77歳),男女比は6:3,腫瘍の平均長径は6.9cm(2.5~16cm)であった.自覚症状を認めない症例が3例(33.3%)であり,検診を契機に診断された症例は自験例を含めて2例(22.2%)であった.IMTおよび炎症性偽腫瘍の切除後再発は2例(22.2%)であった.術前の病理組織学的診断が可能であった症例は3例(33.3%)のみで,経皮下生検が1例,腹腔鏡下生検が1例で,EUS-FNAで診断した症例は自験例のみであった.治療は8例(88.9%)で外科的切除が行われていたが,治療に至らなかった症例が1例(11.1%)みられた.またALK陽性例は1例もなかった.また医学中央雑誌で「炎症性筋線維芽細胞腫瘍」,「EUS-FNA」およびPub medで「inflammatory myofibroblastic tumor」,「EUS-FNA」をキーワードとして検索したところ,胃原発のIMTで1例の報告 25)があるものの,術前診断はGIST疑いで切除後の病理組織診断でIMTの診断されていたため,EUS-FNAで正しく術前診断が行われていた症例はなかった.
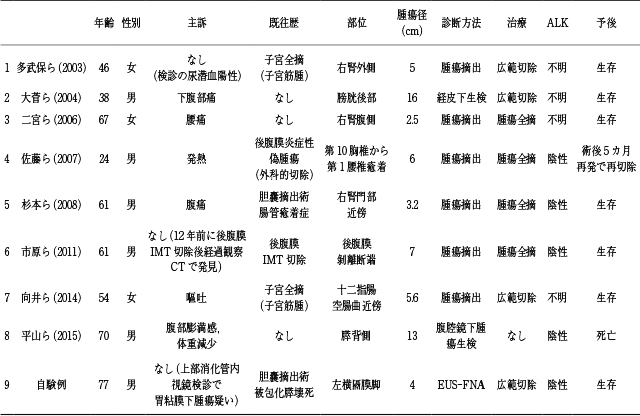
本邦での後腹膜原発IMTの報告例.
自験例は上部消化管内視鏡検診において,偶発的に発見され診断に至った症例であり,他疾患の経過観察のため施行した6カ月前のCTでは腫瘍はみられていなかったことから,比較的早期に腫瘍が増大したものと考えられた.上部消化管内視鏡検診で胃粘膜下腫瘍を指摘した場合は,前回所見との比較も重要であるが,短期間に増大する壁外性の腫瘍にも注意が必要と考えられた.また,自験例は画像所見だけでは確定診断が困難であり,確定診断には病理組織学的診断が必要であった.病理組織学的診断には,侵襲の低いEUS-FNAは有用であるが,IMTに対するEUS-FNAの報告が少ないため,腫瘍の播種などの偶発症については十分な注意を払い,症例を蓄積していくべきである.
後腹膜原発IMTの術前診断にEUS-FNAが有用であった症例を経験したので報告した.上部消化管内視鏡検診における胃粘膜下腫瘍では,短期間に増大する胃壁外性腫瘍の鑑別が重要である.
本論文内容に関連する著者の利益相反:なし