要旨
症例は74歳女性.肺癌の術前の大腸内視鏡検査で,盲腸と上行結腸に1つずつ,S状結腸に2つの側方発育型腫瘍(LST:laterally spreading tumor)を認め,横行結腸に2つの大腸癌を認めた.術前に4つのLSTに対して内視鏡的粘膜下層剝離術(ESD:endoscopic submucosal dissection)を行ったのちに,横行結腸癌に対して,外科的切除が行われた.約1年後に,術後サーベイランス目的に大腸内視鏡検査を行ったところ,ESDを施行した部位である,盲腸とS状結腸に2型癌を認めた.その形態と経過から大腸癌のimplantationによる再発と考えられたが,大腸癌のESD後のimplantationによる再発の報告は稀であり,本症例は2つの部位で同時に再発があったことから非常に稀な症例と考えられた.
Ⅰ 緒 言
早期大腸癌に対する内視鏡的粘膜下層剝離術(ESD:endoscopic submucosal dissection)を施行した後の再発形式として,腫瘍からのimplantationが原因による報告は,過去に数例が報告されている
1)~3).しかし,ESDを施行した2つの部位に同時にimplantationが原因と考えられる再発を確認した報告はない.今回,2カ所のESDを行った部位に,両者にimplantationによる再発と考えられた1例を経験したため,報告する.
Ⅱ 症 例
患者:74歳,女性.
主訴:大腸腫瘍の内視鏡的治療目的.
既往歴:25歳時に虫垂切除,69歳時に胃癌(pT1b2N0M0)に対して幽門側胃切除.
生活歴:喫煙歴なし,飲酒歴なし.
家族歴:第1度,2度,3度近親者に悪性腫瘍の家族歴なし.
入院時現症:身長 150.4cm,体重 40.7kg,体温 36.7℃,血圧 161/84mmHg,脈拍 69/min,表在リンパ節腫大なし,腹部は平坦,軟.圧痛はなく,腫瘤は触知しなかった.
血液検査所見:WBC 6,340/μL,Hb 11.7g/dL,plt 41.6×104/μL,Alb 3.4g/dL,BUN 14.6mg/dL,Cre 1.19mg/dL,T-Bil 0.4mg/dL,AST 20IU/L,ALT 14IU/L,LDH 240IU/L,Na 142mEq/L,K 3.1mEq/L,CRP 0.3mg/dL,CEA 8.4ng/ml,CA19-9 29.1U/mlであった.貧血は認めず,炎症所見も認めなかった.腫瘍マーカーはCEAの上昇があり,CA19-9は基準値内であった.
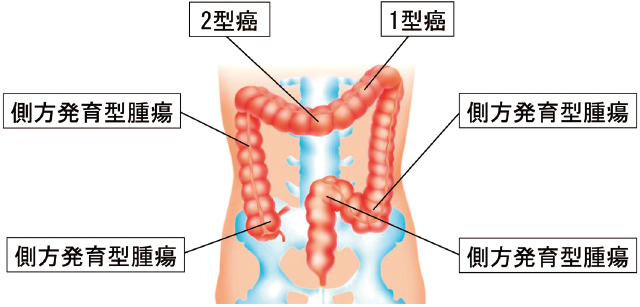
現病歴:胃癌の術後スクリーニング検査である胸部CT検査で右肺に結節を認め,肺癌の疑いで手術予定となっていた.術前のスクリーニング検査として下部消化管内視鏡検査を施行したところ,盲腸と上行結腸に1つずつ,S状結腸に2つの側方発育型腫瘍(LST:laterally spreading tumor)を認め,横行結腸中部に2型癌,横行結腸左側に1型癌を認めた(Figure 1,2-a,b).その他,16個のポリープを認め,LSTに対してはESDを,2つの横行結腸癌に対しては外科的切除を,ポリープに対してはポリペクトミーを行う方針となった.また,ESDを行う前に肺結節に対して胸腔鏡下肺上葉部分切除術を施行した.病理組織学的診断はAdenocarcinomaであり,免疫染色でCDX-2が陽性であった.よってAdenocarcinoma,metastaticと診断し,大腸癌の肺転移と診断した.
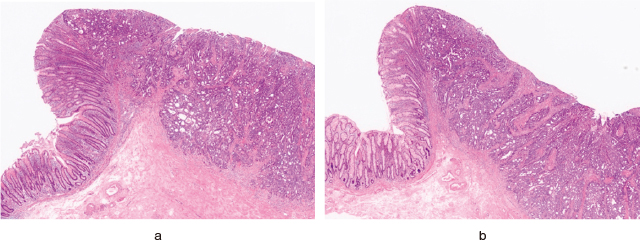
経過:第1病日に盲腸と上行結腸のLST並びにS状結腸のうち肛門側のLSTに対してESDを行い,3つのポリープに対してポリペクトミーを行った.第15病日に残りのS状結腸のLSTに対してESDを行い,切除適応と考えた5mm以上のポリープを4つ切除した.残りのポリープに関しては5mm以下であったため,経過観察を行う方針となった.病理組織学的検査所見は第1病日に切除したLSTはいずれもTubular adenocarcinoma,well differentiated type(tub1)で,深達度は盲腸,上行結腸の病変は粘膜内病変であったが,S状結腸の病変は粘膜下層浸潤(100μm)をきたしていた(Figure 3-a,b).いずれの病変もpVM0であり,盲腸と上行結腸のLSTはpHM0であったが,S状結腸の病変はpHMXであった.また,検体の深切りを行ったところ,いずれもLy0,V0であった.第15病日に切除した残りのS状結腸のLSTはTubular adenomaであり,pHMX,pVM0であった.
第27病日に2つの横行結腸癌に対して腹腔鏡下横行結腸切除術が施行された.病理組織学的検査所見(Figure 4)では口側の2型癌はTubular adenocarcinoma, moderately differentiated type(tub2),pT3(SS)で,肛門側の1型癌と術前診断したものはWell differentiated tubular adenocarcinoma(tub1) with tubular adenoma component, pT1a(SM)でいずれの病変もLy0, V0, pPM0, pDM0, pRM0であった.
経過観察目的に第345病日に大腸内視鏡検査を行ったところ,ESDを施行された部位である,盲腸とS状結腸に2型癌を認めた(Figure 5).また,S状結腸の2型癌の口側にはESD瘢痕を認め,他にはESD瘢痕を認めなかった.生検結果はいずれもTubular adenocarcinoma, moderately differentiated typeであった.2カ所の大腸癌はESD後の部位に一致しており,第419病日に外科的切除を行った.病理組織学的検査所見(Figure 6)は盲腸,S状結腸の病変はいずれもTubular adenocarcinoma,moderately differentiated type(tub2), pT3(SS)で,盲腸の病変は,Ly1b, V1a, Pn0, PM0, DM0, RM0であり,S状結腸の病変はLy0, V0, Pn0, PM0, DM0, RM0であった.
術後約2年が経過した現在,再発なく経過している.
Ⅲ 考 察
大腸ESDは通常の内視鏡的粘膜切除術(EMR)では切除困難と考えられるような大きな病変や高度な線維化のある病変に対して一括切除が期待できる手技である.ESD施行後,5年間の局所再発率は1.6%(95%信頼区間0.1~3.0%)とする報告もあり,再発率は低い手技である
4).そして,ESD後に再発している症例はほとんどが非治癒切除とされた病変であったとの報告もあり
5),病理組織学的に明らかに断端陽性と判定された症例など,非治癒切除と判断した病変に対しては追加の外科的切除が必要になる場合がある.
ESD後のimplantationによる再発の報告は稀であり,2000年から2020年5月の期間において医学中央雑誌とPubMedでキーワードを「ESD」,「implantation」及び「再発」(「recurrence」)として検索すると,報告例は5例
1),2),6)~8)であった.そのうち大腸癌のESD後のimplantationが原因で再発が生じたと考えられる症例は4例
1),2),6),7)であり,年齢は52歳から78歳(中央値72.5歳),性別は男性が3例,女性が1例であった.Implantationによる腫瘍の再発が生じたと考えられる局在はS状結腸が1例,直腸が3例であった.再発後の分化度は,3例が高分化型腺癌で,1例が絨毛状腺腫内腺癌であり,再発後の組織型は再発前の組織型と一致していた.再発腫瘍の深達度は漿膜下層浸潤癌が2例,筋層浸潤癌が1例,粘膜下層浸潤が1例であった.筋層以深の浸潤癌は内視鏡治療適応外と判断され,結腸切除術が実施された.粘膜下層浸潤癌に対しては再度,ESDが実施された.以上から,再発病変の多くは,内視鏡治療適応外と判断されている.
本症例の大腸癌のESD後の再発に関しては,4つの可能性がある.
1つ目はリンチ症候群やLi-Fraumeni症候群を始めとした遺伝性大腸癌が急速に発育した可能性である.本症例は胃癌の既往歴もあることから,同時多発性の遺伝性大腸癌の可能性も考慮した.しかし,本症例は74歳で,胃癌の既往も69歳時であり,第1度,第2度,及び第3度の近親者に遺伝性非ポリポーシス大腸癌関連癌に罹患している者はいなかった.以上からアムステルダム基準Ⅱは満たさず,Li-Fraumeni症候群にも当てはまらなかったため,遺伝性大腸癌の可能性は低いと考えた.
2つ目はESDを行ったLSTの切除断端が陽性であり,その遺残腫瘍から再発をきたした可能性である.本症例においては盲腸,S状結腸のLSTはいずれもpVM0・pHMXであった.大腸腫瘍は正常粘膜と腫瘍の境界は明瞭であり,大腸癌のESDを行う際には,腫瘍を確認しながら全周切開を行うため,病理組織学的にpHMXであっても,実臨床では問題とならないことが多い.本症例も病理組織上はpHMXであったが,切開時の動画を再確認しても腫瘍への切込みなどはなく,剝離時の標本の正常粘膜部分に熱凝固が加わって病理組織学的にpHMXの診断となったと考えられる.そのためpHMXではあったものの実際に遺残があった可能性は低いと考えられた.また,第1病日にESDを施行されたLSTと,第419病日に手術が行われた盲腸及びS状結腸の大腸癌は病理組織学的に分化型という点では一致したが,分化度が異なり,類似性はほとんど認められなかった.よって,この点からも病変の遺残による再発の可能性は低いと考えられた.
3つ目は今回の大腸癌を大腸内視鏡検査で見落とした可能性である.盲腸の再発部位はESD時の潰瘍部に一致しており,本症例ではESD時に大きな切除標本を回収する際に,スコープごと標本を回収せざるを得ない病変が数カ所あったため,再挿入を含めると,計7回のスコープ挿入が行われた.1回の大腸内視鏡検査において,10mm以上の腫瘍を見逃す可能性はわずか2%との報告もあり
9),今回の挿入回数を考慮すると,S状結腸の再発部が見逃しの可能性は極めて低いと考えられた.
4つ目として,ESDが施行された大腸癌から,あるいは横行結腸の進行癌からのimplantationの可能性である.Asaiらは内視鏡の物理的接触により,ESDを施行された潰瘍部にimplantationが生じる可能性があると述べており
10),Inoueらは,大腸癌に対するESDの操作中に腫瘍細胞が腸管内に遊離すると述べている
11).本症例では,ESD実施後から横行結腸切除術を行うまでの間に,内視鏡挿入が複数回行われている.そのため,横行結腸癌の腫瘍細胞が内視鏡と接触し,遊離した可能性は十分にあり,ESDが行われた潰瘍部に癌細胞が付着し,implantationによる大腸癌発生をきたした可能性がある.病理組織学的に検討を行ったところ,第27病日に手術が行われた横行結腸の口側の2型癌と,第419病日に手術が行われた盲腸及びS状結腸の病変はいずれも潰瘍を形成するような2型の中分化型腺癌であり,先に手術で切除された横行結腸癌との類似性が認められた.そのため,横行結腸癌からのimplantationを生じた可能性も考えられた.ただし,NakanoらはESDを行った病変以外には進行癌を認めず,ESD瘢痕部に再発をきたした症例を報告しており,この所見はESDの術中にimplantationが生じたと考えられている
2).本症例では,盲腸の進行癌はESD瘢痕部位と一致し,S状結腸の2型癌は口側にESD瘢痕を認め,他にはESD瘢痕を認めなかった.よっていずれの病変もESD後の瘢痕部と一致すると考えられ,術中にimplantationが生じた可能性は十分にあると考えられる.
以上より,本症例ではimplantationによる再発の可能性が最も高いと考えられた.ESDはいずれも横行結腸癌が外科手術で切除される以前に行われており,内視鏡が横行結腸癌に接触し,癌細胞が遊離した結果,ESDの瘢痕部に生着した可能性と,ESDの術中にimplantationが生じ,再発をきたした可能性が示唆される.しかし,今回のimplantationがLST由来なのか横行結腸癌由来なのかは,遺伝子検索などがなされておらず,断定ができなかった.
ESD後に剝離した腫瘍細胞を管腔内から除去するためにはInoueらは1,000ml以上の水で管腔内を洗浄することが有効であったと述べている
11).ESD後のimplantationを回避するためには,術後に腸管腔内を洗浄することが有効である可能性がある.
大腸癌のESD後にimplantationによる再発が認められる症例は稀にあるが,本症例のように2つの病変で同時に再発を認めた例は,われわれが検索し得た限りでは報告がない.ESDに携わる内視鏡医は,implantationによる再発を念頭におく必要がある.
Ⅳ 結 語
2カ所のESDを施行された腫瘍の潰瘍部にimplantationによる再発が疑われた1例を経験したので,報告した.
本論文の要旨は第103回日本消化器内視鏡学会近畿支部例会(2020年1月18日,大阪)にて報告した.
文 献
- 1. Inoue T, Fujii H, Koyama F et al. Local recurrence after rectal endoscopic submucosal dissection:a case of tumor cell implantation. J Clin Gastroenterol 2014; 7:36-40.
- 2. Nakano Y, Toyonaga T, Nishino E et al. Recurrence of adenoma after curative endoscopic submucosal dissection for a rectal intramucosal adenocarcinoma in adenoma. Endosc Int Open 2019; 7:E621-4.
- 3. Shinhata H, Yamamoto H, Sunada K et al. Advanced rectal carcinoma caused by tumor cell implantation after curative endoscopic submucosal dissection of an intramucosal rectal carcinoma. Endoscopy 2015; 47:E192-4.
- 4. Yamada M, Saito Y, Takamaru H et al. Long-term clinical outcomes of endoscopic submucosal dissection for colorectal neoplasms in 423 cases:a retrospective study. Endoscopy 2017; 49:233-42.
- 5. 山田 真善, 高丸 博之, 坂本 琢ほか.早期大腸癌内視鏡治療後の転移再発と予後の実態.INTESTINE 2019;23:221-6.
- 6. 久保田 晴菜, 清水 洋祐, 森内 俊行ほか.手縫い吻合部にImplantationによる局所再発を来したS状結腸癌の1例.癌と化学療法 2020;47:475-7.
- 7. 上平 大輔, 田波 秀朗, 村形 綾乃ほか.ESD後瘢痕にImplantationによる再発が疑われた同時性多発直腸癌の1例.日本外科系連合学会 2019;44:1090-7.
- 8. 大浦 亮祐, 片山 裕視, 行徳 芳則ほか.隆起形成を呈した未分化型胃粘膜内癌に対し内視鏡治療を施行した1例.Dokkyo Journal of Medical Sciences 2016;43:125-9.
- 9. van Rijn JC, Reitsma JB, Stoke J et al. Polyp Miss Rate Determined by Tandem Colonoscopy:A Systematic Review. The American Journal of Gastroenterology 2006; 101:343-50.
- 10. Asai S, Takeshita K, Kano Y et al. Implantation of esophageal cancer onto post-dissection ulcer after gastric endoscopic submucosal dissection. World Journal of Gastroenterology 2016; 22:2855-60.
- 11. Inoue T, Fujii H, Koyama F et al. Intraluminal lavage to remove exfoliated tumor cells after colorectal endoscopic submucosal dissection. Surgical Endoscopy 2016; 30:2773-8.