2022 年 64 巻 4 号 p. 1018-1024
2022 年 64 巻 4 号 p. 1018-1024
孤立性胃静脈瘤(isolated gastric varices:iGV)からの出血は致死的となるため,その予防治療を行うことは非常に重要である.以前からiGVに対する内視鏡治療として,組織吸着薬(Cyanoacrylate:CA)と硬化剤(Ethanolamine oleate:EO)を併用したCA/EO法が行われているが,近年ではEUS下穿刺術を応用したコイル留置術が良好な成績をもって報告されている.本法は,EUSでiGV内腔を直接観察しながら穿刺すること,また,使用するコイルはiGV径の150%のコイルを用いること等から,安全かつ効果的な治療が可能である.われわれはコイル留置に引き続きEOの注入を行うEUS-guided coil deployment with sclerotherapy(EUS-CS)を施行し,iGVのみならず供血路の塞栓化も図っている.なお,治療に際しては各種画像診断による門脈圧亢進症の血行動態を事前に評価し,十分に理解しておくことが必要である.
門脈圧亢進症に伴う消化管静脈瘤治療は,内視鏡治療,血管内治療(interventional radiology:IVR),手術療法,薬物治療など多岐に渡る.特に,孤立性胃静脈瘤(isolated gastric varices:iGV)からの出血は致死的になり得るため,いわゆるrisky varicesに対しては予防的治療が積極的に行われている.本邦ではバルーン閉塞下逆行性経静脈的塞栓術(balloon occluded retrograde transvenous obliteration:B-RTO)が広く施行されているが,iGVを直接観察しながら組織吸着剤であるCyanoacrylate(CA)を注入する内視鏡治療を第一選択としている施設も多い.いずれも良好な成績が報告されており 1),2),このことも相まって新たな治療手法の確立は久しくされてこなかった.
近年のInterventionalな超音波内視鏡(EUS)の発展は目覚ましく,様々な病態・疾患に対するEUS下治療が開発・施行されている.この治療法の大きな利点は,EUSにより病変内部を直接観察しながら穿刺できることであり,最近ではiGVに対しても,コイルを用いたEUS下治療(EUS-guided coil deployment:EUS-CoD)が施行され,良好な成績が報告されている.本稿では,iGVに対するコイルを用いたEUS下治療の手技について解説する.
EUS下胃静脈瘤治療は,2010年にスペインのRomeroら 3)が4人のiGV患者に対して施行した経験を初めて報告して以来,徐々に本法の研究が進み,有効性そして安全性について検討されてきた.特に,CAを用いた内視鏡治療においては,高濃度のCAであっても径の大きなiGVの速い血流化 4)を瞬時に遮断することができず,注入したCAの門脈大循環短絡路を介した大循環への流出(肺梗塞等) 5),6)が危惧されているため,EUSで測定したiGV径に応じた大きさのコイル(120-150%径)を用いる本手技の安全性は高く評価されている 7)~9).本手技は,EUSに搭載されているカラードプラを用いることで,血流制御を確実に得られたか否かについてもリアルタイムに判断でき,一度穿刺した針は抜去することなく確実な血流制御が得られるまで何本でもコイルを留置することが可能である.さらには,経食道的に胃漿膜側からiGVを穿刺するため(経胃的のみアプローチが可能な際にはその限りではない),抜針後は穿刺孔が胃の固有筋層に裏打ちされ後出血はほとんどない.このように,EUS下の穿刺治療には様々な利点がある.
最近では,コイル留置だけではなく,コイル留置後にCA系薬剤を注入する方法が開発され 8),10),最近報告されたコイル留置単独治療とCA併用治療を比較したメタアナリシスにおいても,併用治療のほうが治療効果および安全性が高いことが示されている(コイル+CA vs.コイル単独:治療効果 96% vs. 90%;p<0.001,偶発症発生率 10% vs. 3%;p=0.057) 9).筆者らは,コイルを留置したiGVのみならず広範囲に供血路塞栓まで行うことが再発抑制に関わると考えており,EUS-CoD後に引き続き,硬化剤であるEthanolamine oleate(EO)の注入を行うEUS-guided coil deployment with sclerotherapy(EUS-CS)を施行している.これにより,コイルだけでは完全塞栓が困難なiGVおよびその供血路まで塞栓できると考えている 11).8例に施行したcase series 12)では,EOの注入ができなかった1例を除き良好な長期予後が得られている.また,特に問題となる偶発症は発生していない.
iGVに対する内視鏡的治療を行う際には,事前に門脈血行動態を把握しておくことが,安全かつ効果的な治療に繋がる.胃静脈瘤(gastric varices:GV)は,肝内血管抵抗と門脈血流量の増大により門脈圧が上昇し,門脈からの逆流現象が生じた結果形成されるが,iGVは穹窿部にみられる病変であり,食道静脈瘤や噴門部GVとは血行動態が異なり,多くは短胃静脈から供血され,腎静脈系短絡路を排血路とする.通常のCA系薬剤を使用した内視鏡治療では胃内腔に存在するiGVのみの観察となり,その静脈瘤の発達に関与している壁外の側副血行路を観察することはできない(Figure 1)が,B-RTOやEUS下胃静脈瘤治療時は血行動態をリアルタイムに血管造影下に把握できる.先述の様に,EUS-CSを行う際には,根治性を考えてコイル留置後に供血路へのEO注入を行うため,治療前には造影CT(3D構築)を用いて門脈域全体の血行動態把握をしておく必要がある.つまり,治療前に塞栓させるべき側副血行路(iGVの供血路)を把握しておくことで,より効果的な治療遂行が可能となる.また,EUS下コイル留置術の際には,iGV径に応じたコイル(概ね120-150%径)を用意しておく必要があるため,あらかじめEUSを施行してiGVの観察を行っておく.さらには,カラードプラを用いて供血路や排血路の同定をあらかじめ行っておくと,実際に治療を行う際の穿刺部位決定がスムーズに行える(Figure 2).
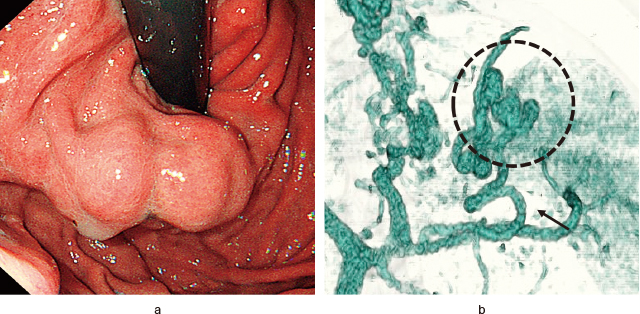
通常内視鏡の胃静脈瘤と治療前の3D-CT像.
a:Lg-f,F2~3程度の胃静脈瘤.通常内視鏡では静脈瘤の発達に関与している壁外の側副血行路を観察することは困難である.
b:門脈圧亢進症に伴い,脾静脈から分岐する後胃静脈(黒矢印)を供血路とした胃静脈を生じていることが確認できる(黒点線内).

胃静脈瘤のEUS像.
a:コンベックス走査式EUSによる観察.
b:コンベックス走査式EUSによるカラードプラ観察.上方向への血流が赤色,下方向への血流は青色に示される.この静脈瘤では画面左から右側への血流方向であることが確認できる(矢印).
基本的には,出血危険因子(Red color sign, Erosion,F2以上) 13),14)を有するiGVが予防治療の対象である.なかでも静脈瘤径が7mm以上,食道静脈瘤がない症例(EUS-CoD, EUS-CSは食道側からの穿刺を基本とするため,食道静脈瘤合併例は事前に治療して消失させておく必要がある)がEUS-CSの治療適応となる.原則として緊急止血例は適応としていないが,食道胃バルーンチューブ(Sengstaken-Blakemore tube:SB-tube)等で止血後には施行可能である.
iGVに対する予防治療はカテーテル治療や内視鏡治療など様々あるが,B-RTOは複雑な血行路で術前の評価が不十分である場合や胃腎短絡路等がない場合はその施行は難しい.その場合は内視鏡治療の適応となるが,iGV径が非常に大きい場合(10mmを越える際など)は,先述の様に注入したCAが門脈大循環短絡路を介したCAの大循環への流出が危惧される.このような症例は,iGV径に応じたコイルを用いるEUS-CoD,ひいてはEUS-CSの良い適応となる.また,高度肝障害例においてはEOの使用は難しいが,コイル留置のみであれば肝機能に悪影響を与える可能性は極めて低く,その適応範囲は極めて広いと言える.
一方,EUS-CoDの禁忌としては,金属アレルギーを除いて特筆すべきことはない.ただし,コイル留置後にEOを用いるEUS-CSを施行する場合はEOの有害事象に注意が必要である(心不全,肝不全,腎障害等がある場合はEOの注入の可否を事前に検討する).また,造影剤アレルギーがある患者ではコイル留置のみにする,もしくはコイル留置後に造影剤非混合下でEOを注入する.抗血栓薬内服中の患者においては,通常の出血高危険度に応じた対応で良い.
2)手技の実際iGV(Figure 3-a)に対するEUS-CoD/CSの手技を以下に記す.

EUS-CS.
a:Lg-f,F3の胃静脈瘤症例.発赤やびらんは認めないも,静脈瘤が増大傾向であり治療する方針とした.
b:治療前のカラードプラ像.胃静脈瘤の供血路側を同定する.カラードプラ機能で供血路側は画面左側であることが分かる.
c:穿刺対象となる静脈瘤の最大短径を測定する.
d:0.035インチのwool coil.超合金インコネル性コイルであり高い拡張力があること,また,高い不透過性によって透視下での視認性に優れている.不規則な方向へ展開されるため,排血路への流出リスクも軽減される.
e:19ゲージのEUS-FNA針で穿刺する.穿刺の際には切り込むように初速をつけて穿刺することが成功のポイントである.穿刺後は静脈瘤内の針先を描出するように心掛けておく(矢印).
f:コイル(測定した120~150%径)を静脈瘤内に展開する(矢印).コイル展開時には穿刺針が静脈瘤から押し出される力が加わるため,針先の動きに注意しながらコイルを展開していく.
g:透視上でも確認しながらコイルを追加していく.
h:コイル留置後に造影剤を注入し,X線透視下に造影剤の停滞が確認された後に造影剤添加5%EOを注入する.EO注入は供血路までとし,門脈までの注入は避けるべきである,事前に注入した造影剤量を確認し,その量に応じたEO量が必要になることを認識しておくことが必要である.
i:パワードプラで静脈瘤の血流がほぼ消失していることが確認できる.
①準備品
基本的な準備品は以下の通りである.ⅰ)コンベックス走査式EUSスコープ並びに観察装置,ⅱ)19ゲージの超音波内視鏡下針生検(EUS-FNA)用穿刺針:筆者らはBoston Scientific社製のExpectⓇを主に使用している.この穿刺針はリング状のエコージェニックパターンが先端部まで達しておりiGV内での視認性が良いこと,針先をより鋭利に研磨しておりスムーズな穿刺ができること,段差が少なくスムーズにコイルを展開できることが本法に適していると考えている,ⅲ)血管塞栓用コイル(MReye® Embolization Coil,0.035inch,8mm~20mm,COOK社):このコイルは超合金インコネル性コイルであることからプラチナ製コイルより高い拡張力を有しており,また,高い不透過性によって透視下での視認性に優れている.さらに,iGV内では不規則に展開されるため,排血路への流出リスクも軽減される,ⅳ)ヨード造影剤と造影剤添加5%EO,ⅴ)生理食塩水.
②EUSによるiGV観察
コイル展開をX線透視下でも確認するため,透視室で施行する.送気を必要とする場面はあまりないが,二酸化炭素を使用することが望ましい.鎮静・鎮痛を十分に行い,コンベックス走査式EUS(GF-UCT260,Olympus社)を用いて,経食道的(難しい場合には経胃的)に治療対象となるiGVを描出する.描出の際には一度胃内まで押し込み,脱気水を注入した後に穹窿部を意識しながらスコープを引きながら観察すると良い(脱気水を注入することで観察された血管が胃内のiGVであることを確認しやすくなる).胃内のiGVを確認すると同時に,カラードプラを用いてiGVから連続した供排血路を描出・同定する(Figure 3-b).短胃静脈から供血され胃腎短絡路に排血される血行動態を持つiGVの場合は,その血流は画面左から右側方向に流れるように描出されることが多い.この理解は,供血路と排血路の同定に役立つ.
③iGVへの穿刺
穿刺をする前には仰臥位にしておく.仰臥位にすることで事前に確認した血行動態と処置中の透視画像がリンクしやすくなる.穿刺対象となるiGVをプローブの5~6時方向に位置させ,穿刺部位の決定を行う.適切な穿刺部位としてはiGVの供血路と排血路の真ん中あたりが良い.あまり排血路側を穿刺すると展開したコイルが大循環に流出する危険がある.穿刺部位を決めたら,EUSから通常光画面に戻し,経食道的な穿刺になるか否かを確認しておく.続いて,穿刺対象としたiGVの最大短径を測定し(Figure 3-c),計測したiGV径の120-150%径のコイルを用意する(筆者らは,初回は150%径を用いる)(Figure 3-d).次にスタイレットを抜き内腔を生理食塩水で満たしたFNA針を鉗子口に通し固定する.
穿刺対象のiGVまでの距離を測定し,その距離に応じて穿刺デバイスのストッパーをしっかり固定する.穿刺ルート上に血管がないこと,胃内腔のiGVであることを確認した後に穿刺を行う(Figure 3-e)(時に胃壁外の側副血行路をiGVと見間違うことがあるため,分からなくなった際には先述の様に胃内に脱気水を注入して確認すると良い).経食道的アプローチの際には胃の漿膜側からの穿刺となるため,手首のスナップを利かせてiGVを切り込むように初速をつけて穿刺することが成功のポイントである.
④コイル留置
穿刺後には血液の逆流を確認し,EUS上で穿刺針がiGV内腔であることを確認する.その後,生理食塩水で穿刺針内腔をフラッシュした後に,EUS-FNA穿刺針のスタイレットを用いてコイルを穿刺針内腔に押し進めiGV内に展開・留置する(Figure 3-f).iGV内にコイルが展開された後に,造影剤注入もしくはカラードプラで静脈瘤の血流を確認する.もし血流残存が確認された場合には,コイルを追加留置する(Figure 3-g).コイル追加の際には,残存管腔の大きさから使用するコイル径を決定する(初回のコイルと同等もしくは小さめの径が良い).iGV内の血流がなくなるまでコイル留置を繰り返す.
⑤Ethanolamine Oleateの注入
複数本のコイルを留置した後に造影剤を注入し,造影剤がiGV内に停滞,ひいては供血路の造影が得られたら,造影剤添加5%EOを注入し,透視下にiGVと供血路の完全塞栓化を図る(Figure 3-h).EOが供血路まで注入できたとしてもそこで治療を終了とはしない.すなわち,すぐに抜針せずに1~2分ほどそのままの状態を待ってから造影剤を再注入する.新たな供血路が描出されるのであれば追加でEO注入を行う.1回のEO総注入量はショックや腎不全などを防止するために0.4ml/kg以内とする.EO注入で重要なことは,十分に供血路までEOを注入して治療効果を得ながら,門脈へのEO注入を避けることである.そのためには事前の画像検査で血行動態を把握しておくこと,また,注入した造影剤量を確認し,その量に応じたEO量が必要になることを認識しておくことが必要である.
⑥治療効果判定
カラードプラでiGVの血流消失を確認して抜針する(Figure 3-i).この際に,別なiGVの血流が確認された際には,同部位を穿刺し上記の手技を行う.治療1週間後には直視鏡とEUSにて治療効果を判定する.通常観察でiGV表面のアレア強調像を認めれば,iGVの血栓化が得られたと判定できる.また,細径プローブを用いたEUS観察も合わせて行い,残存管腔の有無を確認する.その後は数カ月ごとの定期的な内視鏡検査(EUSも含む)で経過観察する.
3)偶発症とその対応EUS-CoD/CSを施行した際に懸念される偶発症として,穿刺部出血が挙げられる.経食道的穿刺の場合は胃の固有筋層で裏打ちされるため腹腔内への出血のリスクは極めて低い.一方,胃内腔から穿刺した際には抜針後の大量出血もありうるため,あらかじめ,緊急止血用のSB-tubeを用意しておくと良い.また,使用するコイル径が大きすぎるとiGV内にすべてを展開することができず,穿刺した針穴からコイルの一部がiGV外に突出してしまうことがある.これは1本目のコイル留置時に起こる可能性はほとんどなく,数本目の留置時に起こりうるため,その都度コイル径の選択には十分に注意する.また,EUS-CSの際には,食道静脈瘤硬化療法施行時同様に,EO注入に伴う門脈血栓や肝不全,腎不全などにも十分に注意しなくてはならない.
筆者らは,iGVに対するEUS-CoD/EUS-CSは,その安全性と高い治療効果から,iGVに対する予防的内視鏡治療の第一選択となり得るものと考えている.しかしながら,EUS-CSは保険適応外の手技であることに注意しなくてはならない.筆者らは自院の高難度新規医療技術委員会での承認を受けた上で行っている.なお,コイルは血管塞栓術の保険適応があるものを使用している.実施にあたっては,上記を十分にご理解頂き,各施設内でのしっかりとしたコンセンサスを得ることが求められる.
安全かつ効果的なEUS下治療を遂行するためにはEUS-FNAを含むInterventional EUS手技の習得が必須であり,なによりも門脈血行動態の確実な理解が必要である.今回はEUS-CoD/EUS-CSについて解説したが,症例によっては他の内視鏡治療(CA/EO法)やIVR,外科的手術を組み合わせた集学的な治療を必要とする場合もある.様々な血行動態を持つiGV治療においては,1つの手技に固執することなく,確実な治療を目指すことが重要と考える.
本論文内容に関連する著者の利益相反:なし