要旨
表在性非乳頭部十二指腸上皮腫瘍(Superficial non-ampullary duodenal epithelial tumor:SNADET)は近年,その発見と治療の機会が増えている.膵頭十二指腸切除術の周術期の有害事象の発生割合の高さを考慮して,内視鏡切除(Endoscopic resection:ER)はSNADETに対しても行われている.ERのうちEMRは比較的型の病変に対する標準的な治療法であるが,十二指腸においては治療前の生検による粘膜下層の線維化などにより,技術的に困難なことがある.近年,Underwater EMR(UEMR)やコールドポリペクトミー(Cold polypectomy:CP)などのEMRの変法が提案された.UEMRでは,十二指腸の内腔を水または生理食塩水で満たし,粘膜下層に注入することなくスネアで病変を切除する.特に20mm以下のSNADETに対してより技術的難易度が高いESDの候補を減らしうる治療法である.CPは対象病変を高周波電流を用いずに物理的に切除する方法で,切除能に課題は残るものの,SNADETに対する安全で簡便な方法として期待されている.SNADETに対するESDは技術的に困難であり,遅発性偶発症のリスクも極めて高いと考えられている.しかし,近年報告されたwater pressure methodやpocket creation methodなどのテクニックを用いることでその成績が向上しうることが報告されている.さらに,切除後の粘膜欠損部を閉鎖することで,十二指腸ER後の遅発性偶発症が有意に減少することが示されている.治癒基準,長期成績および適切なサーベイランス方法を明らかにするためには,さらなる研究が必要である.
Ⅰ 背 景
表在性非乳頭部十二指腸上皮腫瘍(Superficial non-ampullary duodenal epithelial tumor:SNADET)は,剖検例での推定有病割合は0.02~0.5%と比較的稀な疾患と考えられて来た
1)~3).しかし,近年の内視鏡技術の進歩と内視鏡医の本疾患に対する認識の高まりにより,SNADETを発見する機会は増加傾向であることが最近の疫学研究で報告されている
4),5).十二指腸癌の標準的な外科手術である膵頭十二指腸切除術(Pancreaticoduodenectomy:PD)はリンパ節転移の危険が低いと考えられる多くのSNADETにとっては侵襲が大きすぎると考えられており
6),臓器を温存により患者の術後のQOLを維持することができる内視鏡的切除術(Endoscopic resection:ER)は,他の臓器の表在癌同様,SNADETに対しても適応されている.ERは大きく分けて,内視鏡的粘膜切除術(EMR)と内視鏡的粘膜下層剝離術(ESD)の二つの方法があるが,さらに最近では,SNADETに対してUnderwater EMR(UEMR)やコールドポリペクトミー(Cold Polypectomy)など,EMRの変法を使用した報告も増えている.本稿では,これら十二指腸ERの現状と最近の進歩を概説する.
Ⅱ SNADETに対するERの問題点
十二指腸は膵臓や胆管などさまざまな臓器に囲まれているために外科的切除は侵襲性が高く,十二指腸癌の標準術式であるPDの周術期偶発症発生割合は30-40%,死亡割合は1-4%と高いことが報告されている
7)~10).このため臓器温存により術後のQOLが維持されるERはSNADETに対しても行われている.一方,十二指腸のERは,技術的に困難であり,ER後の偶発症リスクが他の臓器よりも高いことが知られている.まず,十二指腸は口からの距離があり,内腔の屈曲(上十二指腸角・下十二指腸角など)の屈曲があるために,内視鏡の操作性が制限されやすく,ときには病変部へのアプローチすら困難なこともある.次に,十二指腸の壁は非常に薄く,筋層方向に不用意に通電すると容易に穿孔してしまう.さらに,粘膜および粘膜下層が薄い十二指腸では術前の生検によりしばしば高度の線維化を生じ,小さな病変であっても内視鏡での切除は困難となることがある
11).これに加え,切除後の潰瘍底にはファーター乳頭からの胆汁や膵液に暴露されるため,たとえ安全に治療を終えたとしても,後出血や遅発穿孔などの遅発性偶発症のリスクが他の臓器に比べて非常に高くなる
12).実際,十二指腸ERに関する過去の報告では,穿孔割合は13~50%,後出血割合は約20%と他の臓器に比べて非常に高いことが報告されている
13)~20).また,遅発性穿孔をきたした場合,PDなどの侵襲性の高い手術や長期入院が必要になることがあることも問題である.
Ⅲ COLD POLYPECTOMY(CP)
CPは最近報告されたERの方法で,スネアで病変を絞扼した後,電流を使わずに物理的に切除するコールドスネアポリペクトミー(Cold snare polypectomy:CSP)と,ジャンボ生検鉗子で病変を切除するCold forceps polypectomy(CFP)の2種類が含まれる.CPでは高周波を使用しないことで,術後の偶発症のリスクが軽減される可能性が示唆されており,実際,抗凝固剤を服用中の大腸ポリープ患者において,CSPは従来のEMRに比べて後出血が有意に減少したことが報告され
21),CPは大腸腺腫に対する安全で簡便な治療法として普及している.
SNADETに対するCPについてもいくつかの報告がある.Maruokaらは30人の患者の39病変に対してCPを実施した症例を前向きに集積し,偶発症はなかったと報告しており
22),Hamadaらは家族性大腸腺腫症(Familial adenomatous polyposis:FAP)患者10人に対してCSPを実施し,数十個の病変を一度に切除したが,重篤な偶発症はなかったと報告している(Figure 1)
23).これらの報告はいずれも比較的小規模なものであり,SNADETに対するCPの安全性・有効性については今後の研究で確認する必要があるものの,特にERが他の臓器に比べ遅発性偶発症リスクが高い十二指腸の小病変に対しては有望な治療法として期待されている.
一方で,CPには注意すべき点もある.一つは,急性膵炎などの十二指腸に特有の偶発症である.Akimotoらは,CFPによる小病変の切除直後に重篤な急性膵炎を発症した症例を報告している.この症例では,膵管癒合不全の症例において副乳等を切除したことにより重症急性膵炎を発症した症例を報告している
24).CP普及にあたっては,この稀ではあるが重篤な偶発症についても注意を払うべきである.もう一つの懸念は,CPが他の種類のERに比べて切除能が劣るのではないかということである.大腸のCSPでは,粘膜筋層とごく浅い粘膜下層のみが切除されることが報告されている
25).実際,CP後の局所再発が直腸の進行癌として発見された例も報告されている
26).十二指腸は大腸に比べて内視鏡診断が確立されておらず,SNADETの生物学的悪性度も明らかにされていない.このためすべての小さなSNADETに一律にCPを行うかどうかはまだ議論の余地がある.
Ⅳ EMR
EMRは,消化管の比較的小さな性腫瘍に対する標準的な治療法で,主に粘膜下層への局注,スネアによる標的病変の絞扼,通電による切除の3段階で構成される.十二指腸EMRでも,術中の穿孔は比較的少なく,発生割合は1%程度と報告されている
18),27).一方,術後出血の発生割合はNonakaらの報告
18)では12%(121例中14例),Yahagiらの報告
27)では1.4%(146例中2例)と差があった.この二つの報告で結果が異なる詳細な理由は不明であるが,要因の一つとして切除された病変の大きさの違いが考えられる.前者の研究では,大きな病変を分割切除で切除しており,対象となった病変の最大径は50mmであった
18).このように切除後の粘膜欠損が大きいことは,後出血のリスクと関連している可能性がある.
一般的に大腸腫瘍は直径20mm以下の病変であればEMRで一括切除が可能であり,ESDは必要ないとされている.一方,Yahagiらは20mm以下の十二指腸病変の20%以上にESDを行ったと報告している
27).比較的小さな病変でEMRが困難な理由の一つは,事前の生検によって粘膜下層が線維化していることである.粘膜と粘膜下層が薄い十二指腸では,わずかな生検でもかなり重度の粘膜下層の線維化が起こり
11),non-lifting sign陽性となり,スネアリングは不可能となる可能性がある.non-lifting signは局注をしてみるまで予測が困難なことが多く,この点が従来のEMRの課題であった.
Ⅴ UNDERWATER EMR(UEMR)
UEMRは,十二指腸の内腔を水または生理食塩水で満たし,粘膜下層への注入を行わずにスネアで病変を切除するEMRの変法で,2013年にBinmoellerらによって報告された(Figure 2)
28).UEMRの懸念として粘膜下への局所注入を行わないことで穿孔のリスクが高まるのではないかという点があるが,実際にはUEMRの術中穿孔は稀で,EMRとは差がないと報告されている
28)~34).これは,十二指腸のKerckling襞は大腸の半月襞とは異なり,粘膜と粘膜下層のみで構成されており,筋層を含まないためであると考えられる.すなわち,内腔を液体で満たすことで筋層が平坦化すること,粘膜・粘膜下層と筋層の比重差などにより,スネア絞扼時の筋層の巻き込みリスクは高くないと考えられている.
UEMRでは粘膜下層への局所注入を行わないことによる,いくつかの利点がある.まず,スネアを容易にする良好な局所注入ができるかどうかは,病変の位置や内視鏡医の技量に影響されるが,UEMRはこれらの要素に影響されない.第二に,十二指腸の粘膜下層には豊富な血管があり,局注針で損傷すると大量出血や血腫ができる可能性があるが,UEMRではこのような有害事象を避けることができる.第三に,UEMRでは局注により病変および周囲の粘膜が引き伸ばされスネアによる絞扼が困難になったり,粘膜下層の線維化によるnon-lifting signの影響を無視できる.実際にKiguchiらは,従来のEMRで治療を予定していた20 mm以下の十二指腸腫瘍の30%が技術的な困難さから実際にESDに変更されたのに対し,UEMRではESDへの変更は15%にとどまったと報告している
31).また,十二指腸EMR後の局所遺残再発に対してUEMRが有効であった症例も報告されている
35).さらに,最近の多施設共同前向き研究では,UEMRの非再発割合は97%と良好な成績が報告されている
36).これらの知見に基づき,UEMRは20mm以下のSNADETに対する標準的な治療法の一つとして注目されている.
一方で,UEMRの問題点として,局注を省略することで側方マージンが陽性になるリスクが高まることが挙げられる.十二指腸では屈曲やKerkling襞により病変肛門側の視認性が低下することがあり,結果としてその部分に病変が遺残する危険がある.実際,特に大きな病変に対しては,従来のEMRに比べてR0切除の割合が若干低くなるという報告がある
31).この問題を解決するために,部分的に粘膜下注入のみを行うUEMRの変法が報告されている(Figure 3)
37)~39).
Ⅵ ESDとその技術的困難性
ESDは十二指腸においても,病変の大きさにかかわらず,ESDは高い一括切除を達成することが報告されている
13),15),18)~20),27),33),40)~49).他方,十二指腸の大きな病変を分割切除で切除した場合,局所再発は最大で30%に達することが報告されている
18),20),50)~54).また,一括切除のもう一つの利点は,正確な病理診断ができることであり,ESDで得られる標本は質が高いため,内視鏡観察では予測しにくいわずかな粘膜下浸潤やリンパ管侵襲などの微妙な所見を拾いあげることが可能である.
一方で,SNADETに対するESDは技術的に困難であり,報告によっては術中の穿孔が約40%にも及ぶと報告されている
13),15),18)~20),27),33),40)~49).十二指腸ESDを技術的に困難にしている要因としては,口から遠く後腹膜に固定されている十二指腸では内視鏡の操作性が制限されること,壁が非常に薄く,Brunner腺が豊富なため剝離できる粘膜下層のスペースが狭いこと,粘膜下層には血管が豊富で,小さな血管でも大出血を起こしやすいことなどが挙げられる.したがって,十二指腸の手術は,high volume centerにおいて経験豊富な内視鏡医のみが行うべきである.さらに,術中の穿孔や長時間の所要時間など,技術的困難性に影響を与える要因が分析されており,上十二指腸角や下十二指腸角などの屈曲部に病変が存在すること(オッズ比2.6),病変径が40mmを超えること(オッズ比5.3),腫瘍が占める円周が円周の半分を超えること(オッズ比5.8)などが報告されている
55).
十二指腸ESDは上述のように技術的に困難であるが,いくつかの改良された治療テクニックや新規に開発されたデバイスがその治療成績を改善しうることが報告されている.Yahagiらは,十二指腸の内腔を生理食塩水で満たし,スコープのウォータージェットからの水流を利用して粘膜下層を可視化する水圧法(water pressure method:WPM)を考案した(Figure 4)
56).WPMでは,粘膜下層を直接観察することが困難な粘膜下層剝離の初期段階や,標的病変の側縁部の剝離において,粘膜下層の視認性を向上させ,術中の穿孔を減らし,治療時間を短縮することが報告されている
57).また,Miuraらは,十二指腸ESDにおけるポケット法(pocket creation method:PCM)の有用性を報告している.PCMでは,先端細径フードを用いて,全周切開をせずに粘膜下層を剝離してポケットを作る方法で,内視鏡を安定させ,粘膜下層の視認性を高めることで,安全性に寄与すると考えられている
45).また,Dohiらは,十二指腸ESDにおけるハサミ型ナイフの有用性を報告している
58).さらに,最近十二指腸ESDにおけるトラクションデバイスの有用性を報告したケースシリーズも報告されている
59).
Ⅶ 遅発性偶発症の予防と発生した際のその管理
前述のように,十二指腸ERは,潰瘍底への胆汁,膵液の露出に伴い,穿孔や出血などの遅発性偶発症のリスクが高い
12),15),18),27).このため切除後の創部の保護のため,クリップによる単純閉鎖,糸付きクリップによる縫合法(Figure 5),留置スネアによる巾着縫合,Over-The-Scope Clips(OTSC),ポリグリコール酸(Polyglycolic acid:PGA)シートによる被覆など,さまざまな方法が報告されている
20),43),60)~63).Katoらは,十二指腸ESD後の粘膜欠損部が完全に閉鎖された症例における遅発性偶発症の割合は1.7%であったのに対し,閉鎖が不完全な症例では25%,閉鎖がない症例では15.6%であったと報告している
60).同様に,4件の後ろ向き研究を分析した最近のシステマティックレビューでは,ER後の創傷を保護することで,遅発性偶発症のリスクが80%以上減少することが明らかになった
64).さらに粘膜欠損部を閉鎖することで,手技内穿孔が発生した場合に患者を保存的に管理できるだけでなく,遅発性偶発症を回避することができる.Fukuharaらは,穿孔部位だけでなく粘膜欠損部全体を閉鎖することで,穿孔内穿孔患者の臨床転帰が改善し,粘膜欠損部を完全に閉鎖した場合,CRPの最大値と入院期間は穿孔のない患者と同等であることを報告している(Figure 6)
65).
十二指腸ER後の粘膜欠損部の保護は,遅発性偶発症を防ぐために必要な手段であるが,課題もいくつかある.たとえばOTSCは79,800円,PGAシート単体は16,400円,フィブリン糊は34,017円と,機器や材料の種類によっては高価である.また,フィブリン糊は献血された血液を原料とする血液製剤であり,感染の危険性は低いが無視できないものである.糸付きクリップ縫合法は比較的安価であるが,技術的に難しく,病変部の位置や進展の程度によっては,経験豊富な内視鏡医でも完全な閉鎖ができないことがある.最近,Mizutaniらは,十二指腸ER後の不完全閉鎖の危険因子を分析し,病変の内側/前壁の位置と大きな病変サイズ(特に40mm以上)が不完全閉鎖の独立した予測因子であることを明らかにした
66).今後の十二指腸ERの成績向上のためには安価,安全,簡便,確実な創部の保護法が望まれる.
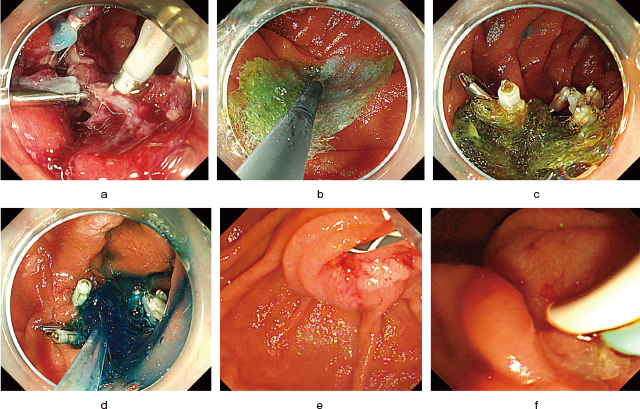
遅発性偶発症を防ぐもう一つの方法は,腹腔鏡を用いて十二指腸の外側から創部を縫合・補強することである.腹腔鏡内視鏡合同手術(Duodenal laparoscopy endoscopy cooperative surgery:D-LECS)と名付けられたこの新しい手術方法は,2015年にIrinoらによって初めて報告された
67).最近,D-LECSを受けた206例を含む多施設の後ろ向き研究では,R0切除割合95%,Clavien-Dindo分類3以上の偶発症の発生は4.4%(穿孔1.5%,狭窄1.9%,出血1%)と良好な結果が報告されている
68).
さらに,十二指腸ER後の偶発症の管理には,胆汁と膵液の外瘻ドレナージが提案されている.Fukuharaらは,内視鏡的な経鼻胆道・経膵管ドレナージを行うことで,侵襲的介入を行わずに保存的に遅発性穿孔を管理できると報告している(Figure 7)
69).本研究ではERCP後膵炎の発生割合は16%であったが,外科的治療の侵襲の大きさを考慮すれば,創部の完全閉鎖が不可能な場合のサルベージ治療としての胆汁,膵液ドレナージは選択肢の一つとなりうる.
Ⅷ 治癒切除基準
SNADETはその発生が稀であるため,ER後の治癒切除基準についてはまだ十分な情報がなく,他の消化管腫瘍とは異なり,「早期十二指腸癌」という概念はない.リンパ節転移のリスクに関しては,十二指腸の粘膜内癌からの発生割合はなかったとの報告があり
70),粘膜内癌は,病理学的に切除断端が陰性であることが確認されれば,ER単独で治癒することが可能である.一方,粘膜下癌におけるリンパ節転移の発生は最大で42%と報告
70)~72)されており,粘膜下浸潤癌症例は追加の外科的切除の候補となるだろう.しかし,これらの研究ではリンパ節転移陽性症例の数が少なく,リンパ節転移の発生についての詳細とその危険因子はまだ不明である.
Ⅸ 治療後のサーベイランス
表在性十二指腸腫瘍の内視鏡治療後の局所遺残による再発に関しては,過去に50例以上の症例を対象とし,18カ月以上の追跡調査を行った研究が日本からは4報
18),20),50),52),海外からは3報
51),53),54)の計7報が報告されている.これらによれば十二指腸ER後の局所再発割合は0~27.3%で,報告によって5%未満の低いものと20%以上の高いものに二極化していた.これらの研究を一括切除の可否で検討すると,再発割合の高い報告はすべて分割切除が多かった
52)~54).実際に再発した病変の治療については,外科的切除を必要としたのは0.6%に過ぎず,死亡例は報告されておらず,そのほとんどが再度の内視鏡治療で対応可能であった.
内視鏡サーベイランスの方法については,上記の報告の多くは,6カ月~1年後に最初の内視鏡検査を行い,再発がなければその後は毎年内視鏡によるフォローアップを行うとしており,ERで分割切除を行った患者には少なくとも年1回の内視鏡サーベイランスが必要であることが示唆されている.
文 献
- 1. Fischer HP, Zhou H. Pathogenesis of carcinoma of the papilla of Vater. J Hepatobiliary Pancreat Surg 2004; 11:301-9.
- 2. Kim HK, Lo SK. Endoscopic approach to the patient with benign or malignant ampullary lesions. Gastrointestinal endoscopy clinics of North America 2013; 23:347-83.
- 3. Kakushima N, Kanemoto H, Tanaka M et al. Treatment for superficial non-ampullary duodenal epithelial tumors. World J Gastroenterol 2014; 20:12501-8.
- 4. Goda K, Kikuchi D, Yamamoto Y et al. Endoscopic diagnosis of superficial non-ampullary duodenal epithelial tumors in Japan:Multicenter case series. Dig Endosc 2014; 26(Suppl 2):23-9.
- 5. Yoshida M, Yabuuchi Y, Kakushima N et al. The incidence of non-ampullary duodenal cancer in Japan: the first analysis of a national cancer registry. Journal of gastroenterology and hepatology 2021; 36:1216-21.
- 6. Asbun HJ. Management of duodenal polyps in the era of maximal interventional endoscopy and minimally invasive surgery:a surgical perspective. Gastrointest Endosc 2016; 84:697-9.
- 7. Yeo CJ, Cameron JL, Sohn TA et al. Six hundred fifty consecutive pancreaticoduodenectomies in the 1990s:pathology, complications, and outcomes. Annals of surgery 1997; 226:248-57;discussion 57-60.
- 8. Cameron JL, Riall TS, Coleman J et al. One thousand consecutive pancreaticoduodenectomies. Annals of surgery 2006; 244:10-5.
- 9. Kim J, Choi SH, Choi DW et al. Role of transduodenal ampullectomy for tumors of the ampulla of Vater. J Korean Surg Soc 2011; 81:250-6.
- 10. Kemp CD, Russell RT, Sharp KW. Resection of benign duodenal neoplasms. Am Surg 2007; 73:1086-91.
- 11. Kinoshita S, Nishizawa T, Ochiai Y et al. Accuracy of biopsy for the preoperative diagnosis of superficial nonampullary duodenal adenocarcinoma. Gastrointest Endosc 2017; 86:329-32.
- 12. Inoue T, Uedo N, Yamashina T et al. Delayed perforation:a hazardous complication of endoscopic resection for non-ampullary duodenal neoplasm. Dig Endosc 2014; 26:220-7.
- 13. Honda T, Yamamoto H, Osawa H et al. Endoscopic submucosal dissection for superficial duodenal neoplasms. Dig Endosc 2009; 21:270-4.
- 14. Takahashi T, Ando T, Kabeshima Y et al. Borderline cases between benignancy and malignancy of the duodenum diagnosed successfully by endoscopic submucosal dissection. Scandinavian journal of gastroenterology 2009; 44:1377-83.
- 15. Jung JH, Choi KD, Ahn JY et al. Endoscopic submucosal dissection for sessile, nonampullary duodenal adenomas. Endoscopy 2013; 45:133-5.
- 16. Matsumoto S, Miyatani H, Yoshida Y. Endoscopic submucosal dissection for duodenal tumors:a single-center experience. Endoscopy 2013; 45:136-7.
- 17. Kakushima N. Hurdles of duodenal endoscopic submucosal dissection, delayed bleeding and perforation. Dig Endosc 2015; 27:298-9.
- 18. Nonaka S, Oda I, Tada K et al. Clinical outcome of endoscopic resection for nonampullary duodenal tumors. Endoscopy 2015; 47:129-35.
- 19. Endo M, Abiko Y, Oana S et al. Usefulness of endoscopic treatment for duodenal adenoma. Dig Endosc 2010; 22:360-5.
- 20. Hoteya S, Furuhata T, Takahito T et al. Endoscopic Submucosal Dissection and Endoscopic Mucosal Resection for Non-Ampullary Superficial Duodenal Tumor. Digestion 2017; 95:36-42.
- 21. Takeuchi Y, Mabe K, Shimodate Y et al. Continuous Anticoagulation and Cold Snare Polypectomy Versus Heparin Bridging and Hot Snare Polypectomy in Patients on Anticoagulants With Subcentimeter Polyps:A Randomized Controlled Trial. Annals of internal medicine 2019; 171:229-37.
- 22. Maruoka D, Arai M, Ishigami H et al. Cold polypectomy for nonampullary duodenal adenoma. Endoscopy 2015; 47(Suppl 1 UCTN):E477-8.
- 23. Hamada K, Takeuchi Y, Ishikawa H et al. Safety of cold snare polypectomy for duodenal adenomas in familial adenomatous polyposis:a prospective exploratory study. Endoscopy 2018; 50:511-7.
- 24. Akimoto T, Kato M, Yahagi N. Severe acute pancreatitis following cold polypectomy of the minor duodenal papilla in a case with pancreas divisum. Dig Endosc 2020; 32:151.
- 25. Suzuki S, Gotoda T, Kusano C et al. Width and depth of resection for small colorectal polyps:hot versus cold snare polypectomy. Gastrointest Endosc 2018; 87:1095-103.
- 26. Kato M, Shiraishi J, Uraoka T. Second local recurrence with advanced rectal cancer after salvage endoscopic mucosal resection of local recurrence following initial cold polypectomy. Dig Endosc 2017; 29:636.
- 27. Yahagi N, Kato M, Ocihai Y et al. Outcomes of endoscopic resection for superficial duodenal epithelial neoplasia. Gastrointest Endosc 2018; 88:676-82.
- 28. Binmoeller KF, Shah JN, Bhat YM et al. “Underwater” EMR of sporadic laterally spreading nonampullary duodenal adenomas(with video). Gastrointest Endosc 2013; 78:496-502.
- 29. Yamasaki Y, Uedo N, Takeuchi Y et al. Underwater endoscopic mucosal resection for superficial nonampullary duodenal adenomas. Endoscopy 2018; 50:154-8.
- 30. Shibukawa G, Irisawa A, Sato A et al. Endoscopic Mucosal Resection Performed Underwater for Nonampullary Duodenal Epithelial Tumor:Evaluation of Feasibility and Safety. Gastroenterology research and practice 2018; 2018:7490961.
- 31. Kiguchi Y, Kato M, Nakayama A et al. Feasibility study comparing underwater endoscopic mucosal resection and conventional endoscopic mucosal resection for superficial non-ampullary duodenal epithelial tumor < 20 mm. Dig Endosc 2020; 32:753-60.
- 32. Iwagami H, Takeuchi Y, Yamasaki Y et al. Feasibility of underwater endoscopic mucosal resection and management of residues for superficial non-ampullary duodenal epithelial neoplasms. Dig Endosc 2020; 32:565-73.
- 33. Hirasawa K, Ozeki Y, Sawada A et al. Appropriate endoscopic treatment selection and surveillance for superficial non-ampullary duodenal epithelial tumors. Scandinavian journal of gastroenterology 2021; 56:342-50.
- 34. Furukawa M, Mitoro A, Ozutumi T et al. Efficacy of Underwater Endoscopic Mucosal Resection for Superficial Non-Ampullary Duodenal Epithelial Tumor. Clin Endosc 2021; 54:371-8.
- 35. Shichijo S, Uedo N, Takeuchi Y et al. Underwater endoscopic mucosal resection of residual duodenal tumor. Endoscopy 2019; 51:E329-30.
- 36. Yamasaki Y, Uedo N, Akamatsu T et al. Non-recurrence rate of underwater EMR for ≤20-mm non-ampullary duodenal adenomas:a multicenter prospective study(D-UEMR study). Clinical gastroenterology and hepatology:the official clinical practice journal of the American Gastroenterological Association 2021 Jul 2;S1542-3565(21)00707-2. doi:10.1016/j.cgh. 2021.06.043. Online ahead of print.
- 37. Takatori Y, Kato M, Nakayama A et al. A Case of Duodenal Tumor Adjacent to the Diverticulum That Was Resected by the Technique of Partial Submucosal Injection Combined with Underwater Endoscopic Mucosal Resection. Dig Dis 2021; 39:70-4.
- 38. Takatori Y, Kato M, Masunaga T et al. Feasibility Study of Partial Submucosal Injection Technique Combining Underwater EMR for Superficial Duodenal Epithelial Tumors. Dig Dis Sci 2021 Mar 15. doi:10.1007/S10620-021-06925-3. Online ahead of print.
- 39. Yamamoto K, Kanomata N, Ikeya T. Utility of under-gel endoscopic mucosal resection with partial submucosal injection for a laterally spreading tumor. Endoscopy 2021 Mar 15. doi:10.1055/a-1381-6915. Online ahead of print.
- 40. Draganov PV, Aihara H, Karasik MS et al. Endoscopic Submucosal Dissection in North America:A Large Prospective Multicenter Study. Gastroenterology 2021; 160:2317-27.e2.
- 41. Esaki M, Haraguchi K, Akahoshi K et al. Endoscopic mucosal resection vs endoscopic submucosal dissection for superficial non-ampullary duodenal tumors. World J Gastrointest Oncol 2020; 12:918-30.
- 42. Kuroki K, Sanomura Y, Oka S et al. Clinical outcomes of endoscopic resection for superficial non-ampullary duodenal tumors. Endosc Int Open 2020; 8:E354-9.
- 43. Tashima T, Ohata K, Sakai E et al. Efficacy of an over-the-scope clip for preventing adverse events after duodenal endoscopic submucosal dissection:a prospective interventional study. Endoscopy 2018; 50:487-96.
- 44. Matsuda Y, Sakamoto K, Kataoka N et al. Perforation associated with endoscopic submucosal dissection for duodenal neoplasm without a papillary portion. World J Gastrointest Surg 2017; 9:161-6.
- 45. Miura Y, Shinozaki S, Hayashi Y et al. Duodenal endoscopic submucosal dissection is feasible using the pocket-creation method. Endoscopy 2017; 49:8-14.
- 46. Ishii N, Akiyama H, Suzuki K et al. Safety and Efficacy of Endoscopic Submucosal Dissection for Non-Ampullary Duodenal Neoplasms:A Case Series. ACG Case Rep J 2015; 2:146-9.
- 47. Matsumoto S, Yoshida Y. Selection of appropriate endoscopic therapies for duodenal tumors:an open-label study, single-center experience. World J Gastroenterol 2014; 20:8624-30.
- 48. Yamamoto Y, Yoshizawa N, Tomida H et al. Therapeutic outcomes of endoscopic resection for superficial non-ampullary duodenal tumor. Dig Endosc 2014; 26(Suppl 2):50-6.
- 49. Kakushima N, Ono H, Takao T et al. Method and timing of resection of superficial non-ampullary duodenal epithelial tumors. Dig Endosc 2014; 26(Suppl 2):35-40.
- 50. Hara Y, Goda K, Dobashi A et al. Short- and long-term outcomes of endoscopically treated superficial non-ampullary duodenal epithelial tumors. World J Gastroenterol 2019; 25:707-18.
- 51. Valli PV, Mertens JC, Sonnenberg A et al. Nonampullary Duodenal Adenomas Rarely Recur after Complete Endoscopic Resection:A Swiss Experience Including a Literature Review. Digestion 2017; 96:149-57.
- 52. Tomizawa Y, Ginsberg GG. Clinical outcome of EMR of sporadic, nonampullary, duodenal adenomas:a 10-year retrospective. Gastrointest Endosc 2018; 87:1270-8.
- 53. Valerii G, Tringali A, Landi R et al. Endoscopic mucosal resection of non-ampullary sporadic duodenal adenomas:a retrospective analysis with long-term follow-up. Scandinavian journal of gastroenterology 2018; 53:490-4.
- 54. Klein A, Ahlenstiel G, Tate DJ et al. Endoscopic resection of large duodenal and papillary lateral spreading lesions is clinically and economically advantageous compared with surgery. Endoscopy 2017; 49:659-67.
- 55. Kato M, Sasaki M, Mizutani M et al. Predictors of technical difficulty with duodenal ESD. Endosc Int Open 2019; 7:E1755-60.
- 56. Yahagi N, Nishizawa T, Sasaki M et al. Water pressure method for duodenal endoscopic submucosal dissection. Endoscopy 2017; 49:E227-8.
- 57. Kato M, Takatori Y, Sasaki M et al. Water pressure method for duodenal endoscopic submucosal dissection(with video). Gastrointest Endosc 2021; 93:942-9.
- 58. Dohi O, Yoshida N, Naito Y et al. Efficacy and safety of endoscopic submucosal dissection using a scissors-type knife with prophylactic over-the-scope clip closure for superficial non-ampullary duodenal epithelial tumors. Dig Endosc 2020; 32:904-13.
- 59. Kaku H, Toyonaga T, Tanaka S et al. Endoscopic Submucosal Dissection Using EndoTrac, a Novel Traction Device. Digestion 2021; 102:714-21.
- 60. Kato M, Ochiai Y, Fukuhara S et al. Clinical impact of closure of the mucosal defect after duodenal endoscopic submucosal dissection. Gastrointest Endosc 2018; 89:87-93.
- 61. Maruoka D, Arai M, Kishimoto T et al. Clinical outcomes of endoscopic resection for nonampullary duodenal high-grade dysplasia and intramucosal carcinoma. Endoscopy 2013; 45:138-41.
- 62. Mori H, Ayaki M, Kobara H et al. Suitable closure for post-duodenal endoscopic resection taking medical costs into consideration. World J Gastroenterol 2015; 21:5281-6.
- 63. Yahagi N, Nishizawa T, Akimoto T et al. New endoscopic suturing method:string clip suturing method. Gastrointest Endosc 2016; 84:1064-5.
- 64. Tsutsumi K, Kato M, Kakushima N et al. Efficacy of endoscopic preventive procedures to reduce delayed adverse events after endoscopic resection of superficial nonampullary duodenal epithelial tumors:a meta-analysis of observational comparative trials. Gastrointest Endosc 2021; 93:367-74.e3.
- 65. Fukuhara S, Kato M, Iwasaki E et al. Management of perforation related to endoscopic submucosal dissection for superficial duodenal epithelial tumors. Gastrointest Endosc 2019; 91:1129-37.
- 66. Mizutani M, Kato M, Sasaki M et al. Predictors of technical difficulty for complete closure of mucosal defects after duodenal endoscopic resection. Gastrointest Endosc 2021; 94:786-94.
- 67. Irino T, Nunobe S, Hiki N et al. Laparoscopic-endoscopic cooperative surgery for duodenal tumors:a unique procedure that helps ensure the safety of endoscopic submucosal dissection. Endoscopy 2015; 47:349-51.
- 68. Nunobe S, Ri M, Yamazaki K et al. Safety and feasibility of laparoscopic and endoscopic cooperative surgery for duodenal neoplasm:a retrospective multicenter study. Endoscopy 2021; 53:1065-8.
- 69. Fukuhara S, Kato M, Iwasaki E et al. External drainage of bile and pancreatic juice after endoscopic submucosal dissection for duodenal neoplasm:Feasibility study(with video). Dig Endosc 2021; 33:977-84.
- 70. Sakamoto T, Saiura A, Ono Y et al. Optimal Lymphadenectomy for Duodenal Adenocarcinoma:Does the Number Alone Matter? Annals of surgical oncology 2017; 24:3368-75.
- 71. Jurisić D, Doko M, Glavan E et al. Local recurrence of primary non-ampullary adenocarcinoma of duodenum after surgical treatment--a case report and a literature review. Coll Antropol 2006; 30:225-9.
- 72. Yoshimizu S, Kawachi H, Yamamoto Y et al. Clinicopathological features and risk factors for lymph node metastasis in early-stage non-ampullary duodenal adenocarcinoma. J Gastroenterol 2020; 55:754-62.