2022 年 64 巻 4 号 p. 976-982
2022 年 64 巻 4 号 p. 976-982
リンパ節転移高リスク下部直腸粘膜下層浸潤癌に対する標準治療は,リンパ節郭清を伴う外科的切除である.しかし,術後の永久人工肛門,肛門機能の低下や合併症の問題から外科手術を拒否する患者が少なからず存在する.そのため日本臨床腫瘍研究グループ(Japan Clinical Oncology Group:JCOG)で,局所切除後に化学放射線療法を追加する試験治療が,標準治療である外科的切除に対して劣らないことを検証する試験(JCOG1612「局所切除後の垂直断端陰性かつ高リスク下部直腸粘膜下層浸潤癌(pT1癌)に対するカペシタビン併用放射線療法の単群検証的試験」)を計画した.Primary endpointは5年無再発生存割合とした.試験デザインは,多施設,単群検証的試験である.試験治療の内容は,予防照射45Gy(1.8Gy/日)とし,放射線療法の増強効果目的としてカペシタビンを承認用法用量で用いる.予定登録数は210例,予定登録期間は4年,追跡期間は登録終了後10年であり,平成30年1月10日から患者登録が開始された.
リンパ節転移高リスク下部直腸粘膜下層浸潤(T1)癌に対する標準治療は,リンパ節郭清を伴う外科的切除である.具体的な術式は,永久人工肛門となる腹会陰式直腸切断術もしくは肛門を温存して肛門括約筋切除を行う直腸切除術や低位前方切除術が一般的であり,後者によって仮に肛門が温存されても,術後に排便・性機能障害や頻回な下痢等の排便異常が多く生じる可能性があるため,外科手術を拒否する患者が少なからず存在する.一方,リンパ節郭清を伴わない局所切除のみで経過観察された患者の5年無再発生存割合は外科手術例より低く,また再発した患者の予後は不良である.手術を拒否する患者にも受容される,低侵襲で局所再発を制御する治療が必要と考えられ,その候補として追加化学放射線療法が挙げられた.過去に,局所切除+化学放射線療法(持続5-FU/RT 45Gy)の探索的試験が行われ,5年無再発生存割合が外科的切除と同等であり,重篤な有害事象はなかったと報告されていることから 1),追加化学放射線療法が最も有望と考えた.そこで,日本臨床腫瘍研究グループ(Japan Clinical Oncology Group:JCOG)の消化器内視鏡グループでは,局所切除後に化学放射線療法を追加する試験治療が,標準治療である外科的切除に対して劣らないことを検証する試験(JCOG1612「局所切除後の垂直断端陰性かつ高リスク下部直腸粘膜下層浸潤癌(pT1癌)に対するカペシタビン併用放射線療法の単群検証的試験」)を計画した.
pT1癌におけるリンパ節転移の頻度は6-12%程度と報告されており 2)~4),標準治療はリンパ節郭清を伴う腸切除とされていた時代もあった.しかし,リンパ節郭清の利益が得られる患者は10%前後であり,残りの約90%のリンパ節転移陰性の患者に対しては,本来は必要ではない外科手術が行われていることになる.そのため,リンパ節転移の可能性が低くリンパ節郭清を省略できる患者を予め同定することを狙って,リンパ節転移のリスク因子の探索のための,切除標本を用いた詳細な病理学的検討が様々に行われた.その結果,リンパ節転移リスクが極めて低い集団が存在することが判明し,大腸癌治療ガイドライン(2019年版)にもリスクに応じた治療方針が記載されることとなった 5)~7).垂直断端が陰性であり,かつ,①粘膜下層浸潤距離1,000μm以上,②脈管侵襲陽性,③低分化型腺癌,印環細胞癌,粘液癌,④浸潤先進部の簇出(budding)Grade 2/3,の4因子のうち,1因子以上が認められれば,リンパ節転移の高リスクと考えられ,追加治療としてリンパ節郭清を伴う腸切除が考慮されるとされている.逆に,垂直断端が陰性で,かつ4因子のうち1因子も有さない病変はリンパ節転移のリスクが低いため,内視鏡的切除などの局所切除後の経過観察の適応であるとされている.また,術前に脈管侵襲・簇出の有無を診断することはできず,術前に診断できるのは生検による組織型と内視鏡診断による予想深達度であって,後者については拡大内視鏡を含めた内視鏡深達度診断により90%以上の高い正診割合でcT1癌を診断できる 8).そのため,日常診療では内視鏡深達度診断で粘膜下層浸潤1,000μm以上の浸潤が疑われる場合は,リンパ節郭清を伴う腸切除が行われ,粘膜下層浸潤が1,000μm未満である可能性が高い病変または診断に迷う病変は,初めに内視鏡的切除(ポリペクトミー,内視鏡的粘膜切除術(EMR),内視鏡的粘膜下層剝離術(ESD))や外科的局所切除(経肛門的局所切除,経肛門的内視鏡下小手術(transanal endoscopic microsurgery:TEM),低侵襲経肛門的局所切除術(minimal invasive transanal surgery:MITAS))が行われている.
直腸に対する外科手術の標準的な術式は,「腹会陰式直腸切断術(abdomino-perineal resection:APR)」や「肛門を温存して肛門括約筋切除を伴う直腸切除術(intersphincteric resection:ISR)」,「低位前方切除術(low anterior resection:LAR)」である.ISRでも肛門括約筋を切除するために肛門・排便機能を損なう可能性がある.また下部直腸癌に対するLARでは,肛門括約筋を切除はしないものの,吻合部が肛門に近くなるため,術後に頻便などの排便異常が多く生じる可能性がある.
APRが施行された場合,肛門は切除され永久人工肛門となるため肛門は機能しない.ISRは肛門を温存する画期的な手術であるが,高度な技術を要することから,比較的限られた施設のみで行われている術式である.また,肛門括約筋を切除するために肛門・排便機能を損なう可能性がある.肛門機能を客観的に評価する指標として便失禁の内容や頻度を0点(最高)から20点(最低)で評価するWexner score 9)があり,齋藤らによるISR術後150例の検討では,ISR術後のWexner scoreの中央値は8.0点であったと報告されている 10).Konanzらの報告では,ISR術後のWexner scoreは12.9点でありLAR術後のscore(9.5点)より有意に高く,また下痢,頻便等の排便異常はAPR術後よりも有意にISR,LARで多いと報告されている 11).さらに,有害事象として15-20%の縫合不全,約40%の排尿障害,約50%の性機能障害を来すことが報告されている 12).LAR術後の肛門機能は,Kakodkarらによると,Wexner scoreは,治療前0点,半年後6.3点,1年後4.4点であったと報告されており 13),ISRよりは良好である.ISRやLARが行われた場合,肛門機能が良好な場合でも,頻回排便,便意切迫などの直腸機能の欠如に伴う症状が出現することが多い.これらの症状はISRやLARといった括約筋温存手術を受けた50-90%の患者に生じるとされており,低位前方切除症候群(Low anterior resection syndrome:LARS)と呼ばれる 14).いずれにしても下部直腸癌の外科的手術は侵襲が大きく,患者の中には手術を拒否する患者も少なくない.
内視鏡的あるいは外科的に局所切除され,リンパ節転移ハイリスク下部直腸pT1癌に対し,手術を拒否した患者に対しては,現状では経過観察するしかない.国立がん研究センター中央病院,国立がん研究センター東病院,静岡県立静岡がんセンター,佐久総合病院,栃木県立がんセンター,藤井隆広クリニックにて,大腸T1癌の予後の検討(以下,6施設検討)を遡及的に実施したところ,結腸pT1癌においては経過観察と追加外科手術の予後がほぼ同等であったのに対し(5年無再発生存割合:96.5% vs. 99.1%),下部直腸pT1癌では経過観察が追加外科手術に比べて劣っていた(5年無再発生存割合:77.7% vs. 96.4%) 15).つまり,下部直腸癌は結腸癌よりも手術の侵襲が大きく,術後クオリティ・オブ・ライフ(QOL)への影響も大きいが,予後の観点からは外科的手術の侵襲が大きい直腸癌こそ追加外科手術が必要という結論に至った.また,直腸pT1癌の局所治療後の局所再発例において,救済手術可能と判断された場合は救済手術が行われ,救済手術が不可能と判断された場合は延命を目的とした化学療法が行われている.Frielらの報告によると救済手術例29例における無再発生存割合は59%(17/29)(追跡期間3.3年)であった 16).また,Weiserらの報告によれば,直腸局所切除後pT1-2癌で,局所再発を来し,救済治療が行われた49例中47例で完全切除がされたものの,5年無再発生存割合は53%であり,また半数以上において広範な骨盤内臓全的術を必要としていた 17).少数例での検討ではあるが,局所再発に対する救済手術を行っても予後は不良である.
現状では手術拒否例においては経過観察する以外に方法がないが,手術を拒否する患者にも受容される,低侵襲で局所再発を制御する何らかの治療があれば,局所切除後の再発を抑制し,高リスクT1直腸癌患者の予後を改善することができるのではないかと考えた.局所切除後に追加できる低侵襲治療のうち化学放射線療法(chemoradiation therapy:CRT)が最も有効性が期待でき,かつ原発巣が切除されているために非切除例に根治的に行われるCRTにおけるブースト照射が不要なため,放射線の線量も45Gyと低く設定できることから,照射に伴う有害事象も軽く,肛門機能にもほとんど影響しないと期待されることから最も有望な治療と考えた.直腸の局所切除後の補助CRTについては,T1,T2をあわせた報告では有用との探索的な報告はあるが,T1病変に限定した検証的な報告はない.国内での試験としては,下部直腸癌T1,T2に対する局所切除+補助化学放射線療法(持続5-FU/RT)の探索的試験が行われ,T1下部直腸癌において5年無再発生存割合が外科治療と同等であり,重篤な有害事象はなかったと報告された 1).従来はCRTの併用化学療法として5-FUの持続静注が頻用されていたが,経口薬であるカペシタビンは患者の利便性が5-FUに優ることが期待される.海外においてはNCT01500993試験において,直腸癌の術前CRTとして,カペシタビン連続投与+RTの安全性が示されているが 18),わが国においてはカペシタビン連続投与の安全性試験は存在しない.そのためわれわれは,まず,局所切除にて一括切除かつ側方・垂直断端陰性であった高リスクT1直腸癌に対する,カペシタビン併用補助CRTの忍容性を評価する試験を愛知県がんセンター中央病院,石川県立中央病院,京都大学病院,国立がん研究センター中央病院,国立がん研究センター東病院,新潟県立がんセンター新潟病院,山形県立中央病院の7施設の共同にて行い,全例重篤な有害事象はなく治療が完遂され忍容性が確認された 19).以上の背景を元に,局所切除後にカペシタビン併用補助CRTを追加する試験治療が,標準治療であるリンパ節郭清を伴う外科的切除術に対して劣らないことを検証する本試験JCOG1612を計画した.
本試験は,局所切除後の垂直断端陰性かつ高リスク下部直腸T1癌を対象として,標準治療である外科的切除術と比較して,試験治療であるカペシタビン併用化学放射線療法が無再発生存割合で劣っていないことを検証することを目的としている.
リンパ節転移高リスク下部直腸T1癌に対する追加化学放射線療法の最も大きなデメリットとして想定されることは,外科的切除術に比して,局所再発や遠隔再発が増える可能性があることである.いったん再発を来すと,予後も不良であり,また救済手術が可能でも肛門温存ができず人工肛門が必要になり,また重篤な合併症も多く発生し,患者のQOLは著しく損なわれる.そのため,高リスク下部直腸T1癌にとっての無再発生存期間は患者にとってのデメリットを反映する真のエンドポイントと考えられ,primary endpointは5年無再発生存割合とした.secondary endpointsは,10年無再発生存割合,5年生存割合,10年生存割合,5年無局所再発生存割合,10年無局所再発生存割合,有害事象発生割合,重篤な有害事象発生割合である.また,追加化学放射線療法の最大のメリットは肛門温存・機能温存と考えているため,5年無人工肛門温存割合,10年無人工肛門温存割合,肛門・排便機能スコアをsecondary endpointsに加えた.
試験デザインとしては,標準治療であるリンパ節郭清を伴う外科的切除術とのランダム化比較が方法論的なgold standardであるが,標準治療,試験治療ともに期待される5年無再発生存割合は約95%と極めて良好である.一般的に,前向き研究における予後は,患者選択により,観察研究より良好になることが多いため,もし本試験をランダム化試験とした場合,標準治療群の5年無再発生存割合が約95%より低くなることは考えにくい.従って,ランダム化対照を置いても置かなくても,試験治療群の5年無再発生存割合が95%より劣っていないことが示されれば,試験治療が有用であると結論できることは変わらない.つまり,選択バイアスの影響による化学放射線療法の効果の過大評価の可能性は低く,ランダム化を行うメリットは乏しいことから,さらには患者受容性も考慮して,単群検証的試験とした.
試験治療の内容は,本試験の対象は原発巣が除去されているため,ブースト照射が必要なく,予防照射45Gyのみを週5日間連日で計25回(1.8Gy/ 日)行うこととした.放射線治療の効果増強を目的として併用する化学療法は,患者の利便性を考慮し,経口薬であるカペシタビンを承認用法用量で用いる(D法:体表面積にあわせた投与量を朝食後と夕食後30分以内に1日2回,放射線照射とあわせて5日間連日経口投与し,その後2日間休薬を繰り返し,放射線治療終了まで継続する).
対象は,年齢20-75歳,ECOG PS 0-1の高リスク下部直腸T1癌に対し垂直断端陰性で内視鏡的または外科的に局所切除され,画像診断にてリンパ節転移と遠隔転移がなく,登録前にリンパ節郭清を伴う外科的切除術が標準治療であることを外科医から説明されたが手術を拒否した患者である.高リスクは「大腸癌治療ガイドライン」に従い,局所切除後の病理診断で腺癌と診断され,①低分化型腺癌,粘液癌,印環細胞癌のいずれか,②粘膜下層浸潤距離1,000μm以上,③脈管侵襲陽性,④簇出Grade 2/3の因子を1つでも認めた病変と定義した.
標準治療の5年無再発生存割合は過去の報告から95%であるため,期待5年無再発生存割合を95%とし,試験治療は患者にベネフィットがあるとしても5年無再発生存割合で5%以上劣ることは許容できないと考え,閾値5年無再発生存割合を90%とした.片側α 5%,検出力80%とすると,必要解析対象数は203人であり,若干の追跡不能例を見込んで210人を予定登録数とした.参加予定施設は,JCOGの消化器内視鏡グループと大腸がんグループの参加施設(約70施設),予定登録期間4年,追跡期間は登録終了後10年(主たる解析は登録終了5年後)とした(Figure 1).本試験の結果,登録終了後5年時点で有害事象が事前の想定と大きく異なっておらず,閾値5年無再発生存割合90%が仮説検定により棄却されて有効性が外科手術に劣らないと判断できる場合,標準治療は外科手術だが化学放射線療法が「標準治療のオプション」であると結論することとした.また,5年時点で化学放射線療法が標準治療のオプションであると判断され,さらに10年時点での有効性が事前の想定と大きく異なっておらず,かつ晩期有害事象が事前に規定した条件を満たしている場合,本試験の対象における標準治療が外科的切除術から化学放射線療法に替わると結論することとした.
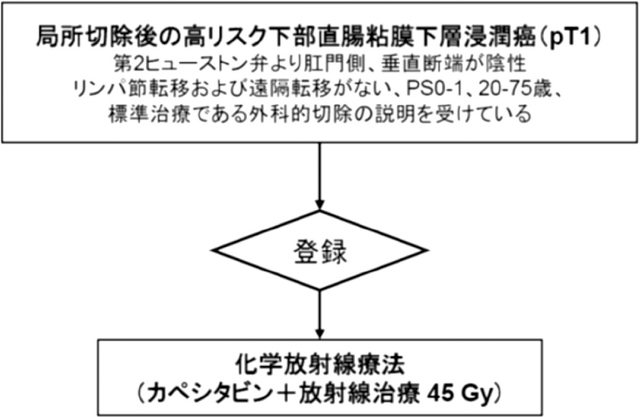
試験のシェーマ.
本試験は,JCOG消化器内視鏡グループ,JCOG大腸がんグループにて十分な話し合いが持たれ,プロトコールを作成し(JCOG1612),平成30年10月15日,国立がん研究センター東病院の認定臨床研究審査委員会において承認が得られた(jRCT番号:jRCT1031180076).平成30年1月10日から患者登録が開始された.
本試験で,手術に対する非劣性が証明されれば,主たる解析予定の登録終了5年後には,局所切除+カペシタビン併用CRTが治療の選択肢の1つになることが期待され,また晩期毒性も問題なければ,追跡期間が終了する登録終了10年後には標準治療に置き換わり,肛門機能が温存され患者のQOLが保たれる新しい標準治療が確立されると考えている.本試験の試験治療の最大のメリットは肛門温存,肛門機能温存であるが,それ以外にも経済的効果も期待できる.標準治療である外科手術の医療費は,474,837円(リンパ節郭清を伴う腸切除)+228,219円(人工肛門閉鎖が必要な場合),試験治療である化学放射線療法の医療費は217,986円であり,試験治療が標準治療に置き換われば約3分の1のコストダウンが見込まれる.
この治療法の大前提は,化学放射線療法前に病変を垂直断端陰性で局所切除することである.外科的局所切除もあるが,より低侵襲での治療を考えると内視鏡的に完全切除することがより望ましい.内視鏡治療の進歩も目覚しく,内視鏡的粘膜下層剝離術の出現により,大きさに関係なく早期病変の完全一括切除が可能となっている.しかし,T1癌においては垂直断端陽性を20%に認め,粘膜下層に高度浸潤したT1癌を完全切除する切除法はまだ確立していない.今後,高リスク直腸T1癌の標準治療が局所切除+補助化学放射線療法になった際,近年開発されている経肛門内視鏡的筋層切除術(Per Anal Endoscopic Myectomy:PAEM) 20)や全層切除等の新たな内視鏡切除法が開発されることも期待され,より低侵襲で有効な治療開発につながることが期待される.
本総説では,リンパ節転移高リスク下部直腸T1癌に対する新治療の開発に向けた検証的試験の概要を解説した.外科手術に伴う合併症を回避し,患者のQOL維持を目指す大変重要な試験と考えており,よい結果が得られることを期待している.
本論文内容に関連する著者の利益相反:なし