2022 年 64 巻 4 号 p. 992-998
2022 年 64 巻 4 号 p. 992-998
症例は78歳男性.cT4N1M1b(LYM),stageⅣAの肺大細胞癌に対するペムブロリズマブ療法中に貧血が出現した.上部消化管内視鏡検査を施行したところ,食道に非連続性に全周性の潰瘍性病変を認めた.他の薬剤性潰瘍や感染症は否定的であり,ペムブロリズマブの免疫関連有害事象による食道潰瘍と診断した.経過中に嚥下障害が増悪したため,免疫関連有害事象による大腸炎の治療に準じて,プレドニゾロン1mg/kg/日(60mg/日)の投与を開始したところ臨床症状,内視鏡所見ともに著明な改善を得られた1例を経験した.
消化管における免疫チェックポイント阻害剤の免疫関連有害事象(immune-related adverse events;irAE)として,大腸炎はすべてのgradeで4%程度に認められ,比較的高頻度で報告されているが,食道に発生したirAEの報告は非常に稀である(頻度不明) 1),2).今回われわれは肺癌に対するペムブロリズマブ療法中に食道潰瘍を発症し,ステロイド投与が著効した1例を経験したので内視鏡所見の系時的な変化を含めて報告する.
患者:78歳,男性.
主訴:全身倦怠感.
既往歴:糖尿病,高脂血症.
家族歴:特記すべき事項なし.
薬歴:ロスバスタチン,トラマドール,ビソプロロール,酸化マグネシウム,カルボシステイン,インスリン(グルリジン,グラルギン).
現病歴:他院で肺腫瘍が疑われたため当院紹介となった.cT4N1M1b(LYM),stageⅣAの肺大細胞癌と診断され,EGFR遺伝子変異,ALK融合遺伝子,ROS1融合遺伝子はいずれも陰性で programmed cell death protein ligand(PD-L1)≧75%であったため,ペムブロリズマブ療法が開始された.皮膚障害や肝機能障害などの有害事象を認めず,部分奏効が維持できていたが,30コース投与後に1カ月でHb11→7.8g/dlと急激に進行する貧血を認めたため,当科紹介となった.
初診時現症:身長170.8cm,体重59.8kg.眼瞼結膜に軽度の貧血あり.眼球結膜に黄染なし.甲状腺触知なし.腹部平坦軟,圧痛なし.皮疹なし.下腿浮腫なし.血便や黒色便なし.水様性下痢なし.
初診時血液生化学所見:RBC275×104/μl,Ht 23.6%,Hb7.6g/dlと小球性貧血を認めた.血清鉄16μg/ml,血清フェリチン22.5μg/mlと低値であった.WBC7,380/μl,CRP0.76mg/dlと軽微な炎症所見を認めた.
胸部CT検査:上部から中部食道にかけて食道壁肥厚を認めた.
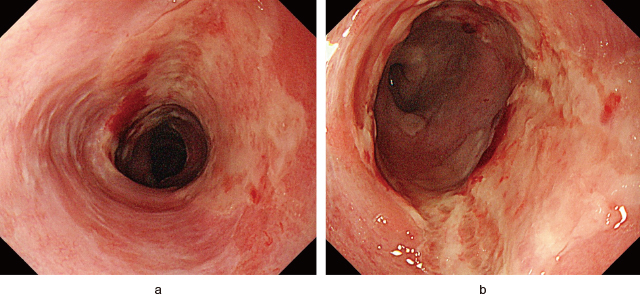
上部消化管内視鏡検査(Figure 1):頸部食道から胸部中部食道にかけて,非連続性に全周性の浅い潰瘍性病変を認めた.潰瘍底は均一な白苔で覆われており,辺縁の不整は認めなかった.同部位より生検を行った.また,下咽頭後壁にも地図状の浅い潰瘍が拡がっていた.食道胃接合部や胃および十二指腸に粘膜障害は認めなかった.

上部消化管内視鏡検査(第1病日).
a:頸部食道(Ce).
b:胸部中部食道(Mt).
CeからMtにかけて,非連続性に均一な白苔に覆われた全周性の浅い潰瘍性病変を認めた.
下部消化管内視鏡検査:大腸に潰瘍性大腸炎様の粘膜障害などは認めなかった.
生検病理組織学的所見(Figure 2):好中球が主体の炎症細胞浸潤があり,CD3,CD4,CD8,CD20陽性のリンパ球浸潤も認めたが,有意性はなく,非特異的な肉芽組織と考えられた.CD138は扁平上皮で陽性となり,評価不能であった.扁平上皮に異型はなく,陰窩膿瘍や肉芽腫性変化など潰瘍性大腸炎やクローン病に類似する所見は認めなかった.少数ではあるが,アポトーシス小体も一部で認められた.核内封入体はなく,グロコット染色では真菌は認めなかった.

生検病理組織学的所見(HE染色).
1,000倍.一部でアポトーシス小体を認めた(矢印).
臨床経過:追加で施行した検査で単純ヘルペスウイルス,サイトメガロウイルス,梅毒,結核は陰性であり,感染症による食道潰瘍は否定的であった.基礎疾患として糖尿病を有していたが,インスリン治療で血糖コントロールは良好であり,高血圧や腎不全などの動脈硬化のリスクもなく,急性壊死性食道炎の可能性は低いと考えられた.また他に原因となりうる疾患の合併や,他の化学療法,放射線治療歴はなく,新規開始の薬剤の内服もないため,ペムブロリズマブのirAEによる食道潰瘍と診断した.貧血については,当科初診前に呼吸器内科で輸血療法が行われ,その後は貧血の進行なく経過した.貧血の原因となる他疾患の合併や薬剤投与歴もなく,同部位からの出血が原因と考えられた.嚥下障害などの症状もなく,有害事象共通用語規準v5.0grade1と判断し,ペムブロリズマブの投与は継続とし,ボノプラザン20 mg/日の内服を開始した.しかし第29病日に嚥下障害が出現したため,ペムブロリズマブを休薬した.その後も嚥下障害が増悪し,有害事象共通用語規準v5.0grade3となった.第57病日に再度上部消化管内視鏡検査を施行したが,食道潰瘍の治癒傾向を認めず(Figure 3),第78病日よりirAE大腸炎の治療に準じて,プレドニゾロン1mg/kg/日(60mg/日)による点滴加療を開始した.その後,徐々に嚥下障害は改善し,第92病日の上部消化管内視鏡検査で食道潰瘍は治癒傾向にあり(Figure 4),プレドニゾロンを40mg/日の内服加療へ減量した.さらに2週間後にプレドニゾロンを30mg/日へ減量し,その後は2週間毎に5mgずつプレドニゾロンを減量した.また,初診時より最大でCRP1.13mg/dlと軽微な炎症所見が持続していたが,プレドニゾロン開始後2週間で正常化した.第162病日には症状は消失し,上部消化管内視鏡検査で食道潰瘍は完全に瘢痕化し,狭窄を認めなかった(Figure 5).また,病理組織所見上は潰瘍極期と比較しCD20とCD3,CD4/8陽性T細胞の比率や分布に著明な変化はみられなかった.プレドニゾロンは漸減後に終了とした.第366病日を経過した時点で,再発兆候は認めていない.また肺癌についてはペムブロリズマブの再投与は行っていないが,部分奏効が維持できており,無投薬で経過観察中である.
上部消化管内視鏡検査(第57病日).
a:頸部食道.
b:胸部中部食道.
非連続性に浅い潰瘍が残存し,治癒傾向は認めなかった.

上部消化管内視鏡検査(第92病日).
a:頸部食道.
b:胸部中部食道.
潰瘍の治癒傾向を認めた.

上部消化管内視鏡検査(第162病日).
a:頸部食道.
b:胸部中部食道.
潰瘍は完全に瘢痕化し,狭窄を認めなかった.
抗PD-1抗体であるニボルマブやペムブロリズマブを始めとする免疫チェックポイント阻害剤は,悪性黒色腫・肺癌・腎細胞癌・頭頸部癌・消化器癌などで高い治療効果が示され,進行癌の有効な治療法として注目されている 3).しかし,免疫チェックポイント阻害剤では自己免疫疾患・炎症性疾患様の副作用が発現することがあり,これらの免疫に関連した副作用はirAEと呼ばれている 4).irAEは,皮膚,消化管,肝臓,肺,内分泌に比較的多く生じることが知られている.抗PD-1抗体単独投与例において,全gradeで最も多いのが,皮膚障害(17-35%),次いで肺障害(6.63-10.4%),肝機能障害(7.7-18.9%)と報告されている 1),2).irAE大腸炎は,免疫チェックポイント阻害剤による治療中に下痢または腹痛が出現した場合に疑われ,感染性の下痢などが除外された場合に診断される.すべてのgradeで4%程度(grade3以上のものは3%程度)に認められ,免疫チェックポイント阻害剤による副作用としては比較的頻度が高い 2).数日単位で急速に重症化し,消化管穿孔に至った例も報告されており 5),出来るだけ早期に診断を行い重症度に応じた治療を行う必要がある.irAE大腸炎の内視鏡像については,潰瘍性大腸炎やクローン病などの炎症性腸疾患に類似した像を呈するとの報告がある 6).このような潰瘍性大腸炎類似の腸炎を発症する機序として,PD-1は活性化リンパ球に発現する受容体で,生体防御に必須なTリンパ球の過剰な活性化を抑制するとされており,抗PD-1抗体によりTリンパ球から過剰なサイトカインが産生され,自己免疫症が誘導・増強されることで大腸炎を来すと考えられている 7)~9).それらを反映し,irAE大腸炎の特徴的な病理組織像は陰窩炎を伴う炎症細胞浸潤を認め,クローン病でみられる肉芽腫とは異なると報告されている 10).また,本症例では粘膜障害を認めなかった部位からの生検を施行していないが,肉眼的な変化はなくとも顕微鏡的な変化を認めるという報告もあり 11),背景粘膜からの生検も考慮する必要があると考えられた.
一方,本症例のように食道に発症したirAEは非常に稀である.2016年から2020年までPubMed,医学中央雑誌(会議録を除く)で「免疫関連有害事象」,「免疫チェックポイント阻害剤」,「食道潰瘍」,「食道炎」をキーワードで検索したところ,内視鏡上明らかな食道潰瘍や粘膜障害を呈した報告は6例のみであり,自験例を加えた7例について検討した(Table 1).ペムブロリズマブでは2例 12),ニボルマブ単剤で2例 13),14),ニボルマブとイピリムマブ併用で2例 15),16),デュルバルマブで1例 17)であった.年齢は63歳から93歳であり,男女比は6対1で男性が多く,様々な癌腫での出現を認めた.嚥下障害は7例中6例で出現していた.発症時期はペムブロリズマブで約10~22カ月,ニボルマブで約6カ月,ニボルマブとイピリブマブ併用で6週~3カ月,デュルバルマブで約1カ月であった.irAE大腸炎の発症時期はイピリムマブ・ニボルマブでは約7~8週,ペムブロリズマブで約6カ月と報告されており 1),2),ペムブロリズマブでは食道炎・食道潰瘍の方がirAE大腸炎よりも発症が遅かった.しかしirAE大腸炎では初回治療開始から数日で発症する症例,治療終了から数カ月経過した後に発症する症例が報告されており 18),食道炎・食道潰瘍も同様に,どの時期でも出現する可能性があると考えられる.病変の発生部位は胸部上部食道ないし胸部下部食道に限局して発症した症例が2例,頸部食道から胸部下部食道にかけて非連続性に発症した症例が2例,胸部中部食道から胸部下部食道に連続性に発症した症例が1例,発症部位不明が2例であった.食道に発症したirAEの内視鏡所見は,びまん性の発赤や粘膜浮腫,全周性の浅い潰瘍や厚い白苔を伴う潰瘍,多発小潰瘍など多彩な像を呈していた.発症部位や内視鏡像に特徴的な所見はなく,食道に発症したirAEを内視鏡のみで診断することは困難である可能性が高い.食道炎・食道潰瘍が起こる機序としては,大腸炎同様に抗PD-1抗体により免疫反応が誘導されることで発症することが推測されるが,現時点でははっきりしていない.

免疫チェックポイント阻害剤による食道炎/潰瘍の報告例.
本症例では,ペムブロリズマブの再投与は行わずに経過観察を行っているが,再発時の再投与に関しては,irAE大腸炎では,ステロイドによる治療開始後12週以内に,grade1以下に回復しプレドニゾロン換算10mg/日以下まで減量できた場合には,投与再開を検討するとされている 2).しかし,再投与により同様のirAEおよび異なるirAEを発症する可能性が約50%程度に報告されており 19),20),再開に関しては患者背景や全身状態を鑑みて慎重に検討する必要があると考えられた.
大腸炎を含めた一般的なirAEの治療法は,過剰な免疫反応を抑制するためにステロイド投与が中心となる 2).一方,食道に発生したirAEに対する治療法は確立していないが,これまでの報告では全例で一般的なirAEと同様に,ステロイド投与が行われていた.5例では奏効し,中止後も再発なく経過したが,中止できなかった1例では,潰瘍病変からの生検組織分析でCD4陽性T細胞浸潤と血中IL-6値の上昇を認めたことから,トシリズマブの投与が行われ,奏効した 14).
本症例では,嚥下障害が出現し,ペムブロリズマブ中止後に有害事象共通用語規準v5.0grade3と判断した時点で,ステロイド治療の導入を考慮したが,irAEによる食道炎に対する確立した治療法がなく,患者と相談した上で経過観察とした.しかし,症状の改善がなく,患者からもステロイド投与の同意が得られたため治療を開始した.食道に発生したirAEに対しても,今後症例の検討を重ね治療方針の確立が望まれる.
ペムブロリズマブ投与中に食道潰瘍を発症した1例を経験した.免疫チェックポイント阻害剤による治療中に貧血や嚥下障害が出現した場合は,irAEの1つとして食道潰瘍が出現することに留意する必要があると考えられた.
本論文内容に関連する著者の利益相反:なし