消化管間質腫瘍(gastrointestinal stromal tumor:GIST)を含む胃粘膜下腫瘍(submucosal tumor:SMT)に対する低侵襲治療として内視鏡的胃全層切除術(endoscopic full-thickness resection:EFTR)を行ってきた.治療適応はdelleを有さない腫瘍径3cm以下の管腔内発育型SMTとしている.適応となる腫瘍の局在は,ESDの基本的な内視鏡の取り回しが可能な部位であれば技術的には可能であるが,胃壁に全層欠損(穿孔)が起こった後に,胃内腔から見ると漿膜外で裏打ち組織となる胃周囲間膜(大網や小網)のない部位では胃内から腹腔内へ脱気されてしまい,胃内の送気状態が維持できず視野確保困難となる.胃周囲間膜の裏打ちがある部位,すなわち小彎側に位置する腫瘍がEFTRの最も良い適応であり,EFTRの導入には最も適切な部位と言える.剝離を進めるうえで,腫瘍の牽引が必要となる場合がある.腫瘍自体の重さがあるために通常のESDに用いる牽引(糸付きクリップやエンドトラックなど)では不十分な場合が認められる.強力で有効な牽引を行うための工夫も供覧する.本稿では胃SMTの術前画像評価,治療適応,手技の実際,トラブルシューティング(腫瘍牽引,腹腔穿刺),周術期管理について述べる.
Endoscopic full-thickness resection (EFTR) of the stomach has been performed as a minimally invasive treatment for gastric submucosal tumors (SMTs), including gastrointestinal stromal tumors. SMTs with an intraluminal growth type, <3cm in diameter, and no ulceration are good candidates for EFTR. Among them, SMTs located in the lesser curvature are the best indication for EFTR because the mesogastrium attaches widely to the gastric serosa in such a location. The mesogastrium works as a barrier to gas flowing out of the stomach after active perforation during EFTR. The mesogastrium can help stop or, at least minimize, the escape of gas from the stomach into the peritoneal cavity; therefore, it is possible to continue endoscopic procedures under a good visual field. “Traction” is known to be one of the key steps in EFTR. Traction methods widely used in standard ESD may be insufficient due to the weight of the tumor. Devices for strong and effective traction used by the authorsʼ for EFTR are presented in this article. Additionally, perioperative management, actual procedures, and some trouble-shooting tips for EFTR are discussed.
消化管間質腫瘍(gastrointestinal stromal tumor:GIST)を含む胃粘膜下腫瘍(submucosal tumor:SMT)の治療方針はGIST診療ガイドライン 1)に示されており,当院でも基本的にはこれに則って治療方針を決定している.一方で,相対的手術適応および手術適応症例のうち,delleを有さない腫瘍径3cm以下(経口的回収が可能なサイズ)の管腔内発育型SMTは内視鏡的胃全層切除術(endoscopic full-thickness resection:EFTR)が一つの治療オプションと考え,これを適応してきた.
EFTRのメリットは「腹壁および胃外周囲組織(神経など)に傷害を加えることなく,経口内視鏡的に胃内腔からのアプローチで最小限の胃全層部分切除術が可能となる」ことであり,SMTに対する究極の低侵襲治療と言える.現在は先進医療として進められ,登録施設を中心として細々とEFTRが行われているのが本邦の現状である.本稿では当科で行っているEFTR手技の実際について解説する.
EFTRは管腔内発育型を適応とし,腫瘍径は3cm以下が妥当である.それ以上の大きさになると,経口的に内視鏡から標本を回収する際に噴門や食道生理的狭窄部を通過することが困難となるためである.一方,管腔外発育型や壁内型のSMTは種々の腹腔鏡下胃部分切除(腹腔鏡・内視鏡合同手術を含む)を基本術式としている.
EFTRの適応となる腫瘍の局在は,内視鏡的粘膜下層剝離術(ESD)の基本的な内視鏡の取り回しが可能な部位であれば技術的には可能である.しかし,前庭部病変は技術的難易度がやや上がり,また蠕動が相対的に強い箇所なので閉鎖部(特にクリップを用いた閉鎖部)が縫合不全を起こす可能性が少なからずあると考えられ,その適応は慎重に考えた方が賢明である.
EFTRによって胃壁に全層欠損(穿孔)が起こった場合に,胃内腔から見ると漿膜外で裏打ち組織となる胃周囲間膜(大網や小網)のない部位では胃内から腹腔内へ脱気されてしまい,胃内の送気状態が維持できず視野確保困難となり,EFTRの困難度および危険度が一気に上がる.したがって,胃周囲間膜の裏打ちがある部位,すなわち小彎側に位置する腫瘍がEFTRの最も良い適応であり,EFTRを安全に導入する際には最も適切な部位と言える.
術前の内視鏡検査は必ず術者が行い,内視鏡の操作性や取り回しなどをシミュレーションする.内視鏡上,管腔内発育型主体と考えられても胃壁外成分を伴うことも少なくないため,必ず造影CT検査を施行して胃壁外成分の有無やその多寡を評価する.腫瘍と胃壁漿膜側との接地面積が広い症例では大きな全層切除となるため,EFTRの困難度がある程度予想できる.胃壁外成分が大きければ,EFTRの難易度は相当高く,逆に腹腔鏡下胃部分切除術が容易であるので,このような場合(内視鏡所見上のみの管腔内発育型)は安易にEFTRの適応とはしていない.また,腫瘍と胃壁層構造との位置関係を評価するには超音波内視鏡検査(EUS)が有用であることは自明であり,可能な限りEUSを行っておくことが望ましい.
症例1噴門直下小彎前壁側のSMT症例.内視鏡では胃の短軸方向に幅広い腫瘍(Figure 1-a)である.造影CTの環状断では腫瘍漿膜側と肝臓外側区域が接しており(Figure 1-b),腫瘍の胃漿膜との接地面積も広めであることが予測される.実際,筋層・漿膜切離を進めていくと薄い漿膜越しに肝臓が透見された(Figure 1-c).

噴門直下小彎前壁側のSMT症例.
a:内視鏡では胃の短軸方向に幅広い腫瘍が認められる.
b:造影CT(環状断)で腫瘍漿膜側と肝臓外側区域が接しており,腫瘍の胃漿膜との接地面積も広めである.
c:筋層・漿膜切離を進めていくと薄い漿膜越しに肝臓が透見された.
噴門直下小彎側のSMT症例.内視鏡では管腔内発育型(Figure 2-a)であり,造影CTでは壁外成分を認めないが(Figure 2-b),腫瘍近傍には肝臓外側区域が接していることがわかる.EFTR術中に筋層・漿膜切離を進めていくと,肝臓表面が白色に変化しており,管腔内からのデバイス操作で肝臓表面にスパーク熱が及んでいたことが判明した(Figure 2-c).

噴門直下小彎側のSMT症例.
a:内視鏡では管腔内発育型.
b:造影CTでは壁外成分を認めないが腫瘍近傍には肝臓外側区域が接している.
c:肝臓表面が白色に変化しており,管腔内からのデバイス操作で肝臓表面にスパーク熱が及んでいた.
ジェット送水付き上部内視鏡スコープ(Olympus Q260Jなど).
高周波発生装置(エルベVIO 300Dなど).
太めのオーバーチューブ(トップ20ダブルタイプなど).
先端アタッチメント(Olympusディスポーザブル先端アタッチメントQ260J用:D-201-11804).
デタッチャブルフード(クリエートメディック).
針状メス(Olympusプリカッティングナイフ).
高周波ナイフ(Olympusディスポーザブル高周波ナイフIT Knife2:KD-611L).
止血鉗子(Olympusディスポーザブル止血鉗子Coagrasper).
把持鉗子(Olympusリユーザブル鰐口鉗子).
スネア鉗子(Olympusリユーザブルスネア鉗子).
インジゴカルミン散布液.
薬液散布チューブ.
局注用生理食塩水(生理食塩水100ml+ボスミン1A+インジゴごく少量).
内視鏡用粘膜下注入剤(ヒアルロン酸ナトリウム:オリンパス ケイスマート,ボストンムコアップなど).
局注針(トップ内視鏡用穿刺針スーパーグリップ26G針長4mmFE).
局注用10mlシリンジ.
内視鏡用回収ネット(Meditalia社回収用ループネット30×60mm:MED-133-NET).
内視鏡用クリップ各種(Olympus Quick Clip Pro:HX-202LR,micro-techシュアクリップ,Olympus EZクリップなど).
トロンビン液1万単位.
腹腔穿刺用物品(後述).
1.セッティング:手術室にて経鼻挿管管理,全身麻酔下に施行する(Figure 3).内視鏡の送気は二酸化炭素を用いる.内視鏡および処置具に特別な滅菌処置は施行していない.
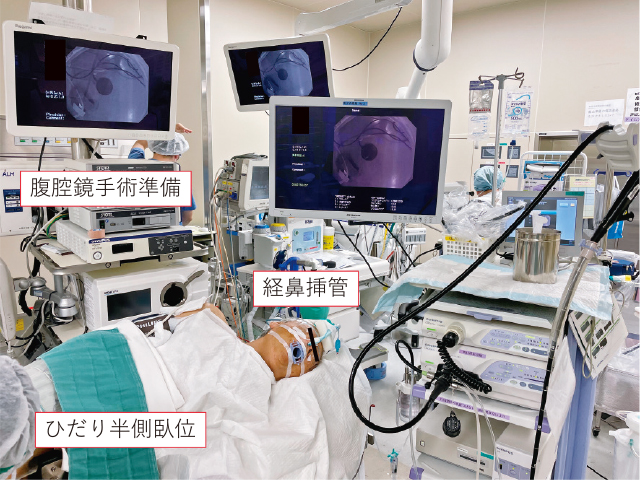
手術室セッティングと患者体位.
2.体位:胃壁穿孔後に腹部コンパートメント症候群の危険がある場合には速やかに腹腔穿刺が必要となる.腹腔穿刺に備え,体位は左側臥位ではなく腹部を少し仰向けにした左半側臥位としている.内視鏡による胃壁閉鎖ができなかった場合には腹腔鏡下手術を追加できるように腹腔鏡手術器具の準備もしておく.
3.オーバーチューブと先端アタッチメント,胃内洗浄:あらかじめ内視鏡に太めのオーバーチューブを装着しておく.後述する牽引デバイスを内視鏡の外側に着けて挿入するために通常のオーバーチューブよりも内径が太いものを用いている.内視鏡を胃内へ進め,十分にゼリーを塗布したオーバーチューブを食道損傷に注意しながら丁寧に進める.挿入時に抵抗があった場合には無理やり挿入せず,細めのサイズに変更する.内視鏡には先端アタッチメントを装着する.胃内は蒸留水を用いて可能な限り洗浄し,胃壁穿孔時に腹腔内へあからさまに汚い胃内容液が流出しないようにする.
4.マーキング:EFTRでは粘膜を広く切除する必要はなく,腫瘍からあまり離れずに腫瘍の立ち上がりの部位で針状メスを用いて全周性にマーキングを行う(Figure 4-a,b).粘膜切開線を最小限にすれば,粘膜欠損も最小限となり,後にクリップによる胃壁欠損部閉鎖が容易となる.

EFTRの実際.
a:噴門直下前壁のSMT.
b:針状メスを用いて腫瘍周囲にマーキングを行う.
c:ITナイフを用いて粘膜下層レベルで全周切開を行う.
d:腫瘍が筋層・漿膜面に対して凸になっていることをイメージ.
e:意図的に胃壁を穿孔,穿孔部から肝臓が透見される.
5.局注:インジゴカルミンをごく少量追加したボスミン加生理食塩水とヒアルロン酸ナトリウムの混注液(ヒアルロン酸は30~50%程度)を用いている.マーキング周辺へ十分に注入する.
6.腫瘍周囲切開:高周波発生装置(VIO 300D)の設定は切開(エンドカットI,エフェクト2もしくはドライカット,エフェクト4,最大ワット50),凝固(スイフトコアグ,エフェクト4,最大ワット50)を用いている.ESD手技に順じ,針状メスにてITナイフ先端が十分に入るようにプリカッティングを行う.ITナイフを用いて粘膜下層レベルで全周切開を行う(Figure 4-c).腫瘍が邪魔となって全周切開ができない場合もあるが,必ずしもこの時点で全周切開完遂にこだわる必要はなく,周囲切開ができた部位からある程度腫瘍を剝離してからこれを行っても良い.出血を認めた場合はCoaglasperを用いてソフト凝固モード(ソフトコアグ,エフェクト5,最大ワット70)で止血する.
7.粘膜下層および筋層剝離:剝離時の高周波発生装置の設定は粘膜切開と同様である.腫瘍の下に潜り込むようにして粘膜下層と筋層を切開していく.腫瘍が筋層・漿膜面に対して凸になっていることをイメージすることが重要である(Figure 4-d).適宜局注を追加しながら腫瘍あるいは偽被膜を損傷しないように丁寧に切開・剝離を進めていく.筋層の深い部分で穿孔が予想される部位では,近接操作を中心とし,針状メスなどの先端系を用いて筋繊維を一本ずつ切るつもりで丁寧に切離する.出血すると視野不良や層の認識が難しくなるため,出血させないような細心の注意を払い(いわゆる“pre-coagulation”を忘れない),出血した場合にはCoaglasperを用いてこまめに止血する.腫瘍の発生部位によっては穿孔せず切除を終了できることもある.
8.腫瘍牽引:腫瘍が重く,剝離したい部分に覆いかぶさり,視野が確保できない場合には,腫瘍を口側へ牽引したり,場合によっては肛門側へ押し込むなどの工夫が必要となる.糸付きクリップやエンドトラックなどもESD時の牽引には有効であるが,SMTは腫瘍自体が重いためこれらの牽引ではいわゆる牽引の“コシ”が不十分な場合もある.
<腫瘍牽引の工夫>
クリエートメディック社のデタッチャブルフードを使用している.先端アタッチメントとアウターシース(内視鏡用の鉗子を通すためのシースであり,これによって鉗子に“コシ”が追加される)の二つの部品から構成されている(Figure 5-a).アタッチメントの一部にはアウターシースを嵌め込む溝がある(Figure 5-b).まず内視鏡先端にアタッチメントを装着する.先端アタッチメントにアウターシースを装着する(Figure 5-c).アウターシースの中に内視鏡用把持デバイス(鰐口鉗子など)を通す(Figure 5-d).アウターシースは内視鏡の外側に沿わせて術者が把持する.術者は内視鏡とアウターシースがずれないように把持し胃内へ慎重に挿入する.その後,胃内で腫瘍の把持・牽引したい部分を把持鉗子で把持し,内視鏡にアングルをかけることにより先端アタッチメントの溝から鉗子を通したアウターシースがリリースされる(=牽引鉗子となる)(電子動画 1).術者の内視鏡動作によってアウターシースも同時にずれてしまうため,助手は術者の妨げにならない位置で,片手に把持鉗子ハンドルを保持し,もう片手でしっかりとアウターシースを把持して患者口元近くで常に微調整を行う必要がある(Figure 5-e).先端アタッチメントからアウターシースごと把持鉗子がリリースされるとこの鉗子は内視鏡とは別の動きができるようになり,鉗子単体の時よりも“コシ”があるので牽引のみならず,押す動作も可能となる(Figure 5-f,電子動画 2).

クリエートメディック社のデタッチャブルフード.
a:先端アタッチメントとアウターシースの二つの部品から構成.
b:アタッチメントの一部にはアウターシースを嵌め込む溝がある.
c:先端アタッチメントにアウターシースを装着する.
d:アウターシースの中に内視鏡用把持デバイス(鰐口鉗子など)を通す.
e:助手はしっかりとアウターシースを把持して患者口元近くで微調整を行う.
f:鉗子単体の時よりも“コシ”があるので牽引のみならず,押す動作も可能となる.
電子動画 1
電子動画 2
9.胃壁全層切開(胃壁開放):多くの症例では腫瘍最深部で筋層を切離し,意図的に胃壁を穿孔させる必要がある(Figure 4-e).可能な限り筋層欠損を最小限にするのが後の胃壁閉鎖のために一番重要である.小彎や大彎などの病変では胃周囲間膜の裏打ちがあるために胃内の送気は保たれ視野確保が困難になることは少ないが,前壁や後壁では胃周囲間膜がなく,腹腔内へのフリーな穿孔となるため,胃内が脱気され,気腹状態となり視野確保困難になることが多い.穿孔させた部位からITナイフを挿入し,漿膜面に突出した腫瘍部分に切り込まないように注意して筋層と漿膜の切離を進める.切離中に腫瘍を口側へ牽引し胃壁欠損部が直線化した場合には完全に腫瘍切除する前にクリップを用いてある程度壁閉鎖(筋層―筋層間の閉鎖)を行っても良い.
<腹部コンパートメント症候群>
気腹が起こっても速やかに切除と穿孔部閉鎖ができ,腹腔内圧が上昇しなければ基本的には後述する腹腔穿刺は必要ないが,処置に時間がかかる場合では腹部コンパートメント症候群(abdominal compartment syndrome:ACS)に注意が必要である.通常の腹腔内圧はおよそ5~7mmHgだが,20mmHg以上が遷延し,かつ新規に臓器障害や臓器不全が発生した状態がACSと定義されている.ACSに陥ると静脈還流が障害され,頭蓋内圧の上昇,心拍出量の減少,腸管浮腫,消化管粘膜障害,肝障害,腎障害,深部静脈血栓症などを引き起こす.また胸腔内圧も圧迫上昇することにより無気肺や換気量の低下も引き起こされる.穿孔を来したのちには,頻回に患者の腹部を触診し,緊満感が強い場合やバイタルサインに変動がある場合には速やかに腹腔穿刺 2)を行って脱気する必要がある.
<腹腔穿刺>
穿刺は腹壁血管を避け腹直筋の外側で行うのが望ましい 2).本手技の体位(ひだり半側臥位)ではみぎ腹直筋より外側でMcBurney点から頭側の領域が穿刺しやすい(Figure 6-a).穿刺部位を決めたら皮膚消毒を行い,23Gの注射針で試験穿刺を行う.試験穿刺で腸液や血液などが引けないことを確認し,同部位から14~18Gの末梢静脈留置針(サーフローやハッピーキャスなど)で本穿刺を行う.外筒に点滴延長チューブと三方活栓をつなげて50mlのシリンジで用手的に脱気する(Figure 6-b).腹部の触診で緊満感がなくなるまで適宜吸引をつづけ脱気を行う.穿孔部のクリップ閉鎖がきちんと行われるまでは脱気針は留置しておき,ガスが引けなくなったことを確認できたら抜針する.

a:みぎ腹直筋より外側でMcBurney点から頭側の領域が穿刺しやすい.
b:用手的に脱気する.
10.経口的腫瘍回収:切除完了後,内視鏡鉗子口より挿入した組織回収ネットを用いて腫瘍を経口的に摘出する.腫瘍径によっては生理的狭窄部通過時に抵抗があるが,標本へのダメージを抑えるためにゆっくりと丁寧に内視鏡/オーバーチューブごと抜いてくる(Figure 7-a).
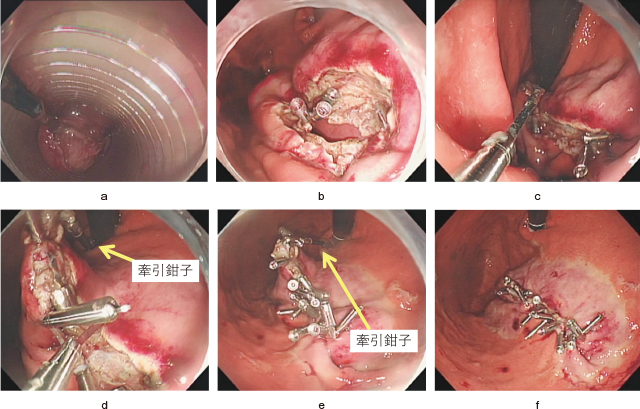
a:内視鏡鉗子口より挿入した組織回収ネットを用いて腫瘍を経口的に摘出する.
b:胃壁欠損部.
c:口側からクリップしていく.
d,e:牽引鉗子によって欠損部を直線化してクリップする.
f:胃壁欠損部クリップ閉鎖後,送気で胃内が十分に拡張することを確認.
11.胃壁欠損部の閉鎖:穿孔部から胃内溶液が腹腔内へ漏れないように胃内の吸引を十分に行う(穿孔後,この吸引操作は常に行う必要がある).欠損部のクリップ閉鎖を確実に行うためには,欠損部を直線化することが大切である.口側および肛門側から順にクリッピングを行っていくことで円形だった欠損部が徐々に直線化していく(Figure 7-b,c).大きな円形の欠損部でそのままではクリップがかかりにくい場合には,腫瘍牽引に用いたデタッチャブルフードと把持鉗子を用いて欠損部の口側端を把持(筋層把持が理想である)し,口側へ牽引することにより欠損部を直線化することができる(Figure 7-d,e).使用するクリップはつかみ直しが可能で,アームの把持力が強いQuickClip Proやシュアクリップを多用している.
12.止血確認,トロンビン液散布:クリップによる粘膜縫縮が終了したのちに止血を確認する.また,送気にて胃内が十分に拡張することを確認し(Figure 7-f),腹腔穿刺針を留置している場合はgas leakageがないことも確認する.トロンビン1万単位を胃内創部へ散布する.
13.オーバーチューブおよびスコープ抜去:すべての処置終了後,オーバーチューブによる食道粘膜損傷のないことを確認しながら,オーバーチューブとともに内視鏡を抜去する.
手術前日の夕食より禁食管理とする.術直前にセフェム系抗菌薬の予防的投与を行う.穿孔の大きさや腹部所見,炎症所見より数日間の抗菌薬投与が必要な場合がある.穿孔部の閉鎖状況によっては経鼻胃管を留置する.穿孔部の閉鎖が問題なく行えた症例では術後2~3日目から経口摂取を開始している.禁食中はプロトンポンプ阻害薬(proton pump inhibitor:PPI)点滴投与を行い,経口摂取開始後から退院後2カ月まではPPI内服を継続して行っている.術後経過中に発熱や腹痛などの腹部症状が出現した場合は,腹部CT検査やガストログラフィンによる胃造影検査を行い,慎重に治療方針を検討する.
EFTRにおける最大の問題点は,全層切除後の胃内脱気と気腹,胃壁欠損部の完全閉鎖可否である.前者では,腹腔穿刺・脱気で処置続行な場合がほとんどと考えられるが,患者の循環状態が悪化した場合には速やかに腹腔鏡下手術へ移行した方が良い.また,不完全な閉鎖は術後に胃液リークによる腹膜炎への進展が危惧されるので,「完全に閉鎖できた」との確信がない場合には,腹腔鏡下手術へ移行するか,胃潰瘍穿孔に対する保存的治療(経鼻胃管留置・持続吸引や抗菌薬投与など)に準じた慎重な術後管理が必要である.
EFTRはSMTに対する低侵襲で有用な内視鏡手技である.しかし,術中の経過によっては外科医による腹腔鏡手術の追加が必要となる場合があり,内視鏡医と外科医の情報共有,速やかに柔軟な対応ができる体制を構築しておくことが極めて重要である.
本論文内容に関連する著者の利益相反:なし
補足資料
電子動画 1 内視鏡にアングルをかけることにより先端アタッチメントの溝から鉗子を通したアウターシース(=牽引鉗子)がリリースされる.
電子動画 2 牽引鉗子操作によって腫瘍を牽引したり押すことが可能となる.