2012 年 29 巻 3 号 p. 215-219
2012 年 29 巻 3 号 p. 215-219
膵神経内分泌腫瘍(pancreatic neuroendocrine tumors,PNET)は稀な腫瘍であるため,治療方針の標準化が遅れていた。最近になり欧米のコンセンサスガイドラインやプラクティスガイドラインが公表された。日本でもPNETに対する新しい薬物治療が使用可能となり,臨床家の注目が高まりつつある。特に外科治療においては,発見された腫瘍に対する評価に応じて,切除の適応,術式の選択,リンパ節郭清の範囲などを決めなければならない。また遠隔転移がある場合には別途検討が必要である。いずれの場合にも切除による根治の道をまず追求することが重要である。一方,手術のみで治療が完了しない場合には,エベロリムスなどの薬物療法を含む集学的な治療戦略が必要になる。
膵神経内分泌腫瘍(pancreatic neuroendocrine tumors,PNET)は稀な腫瘍であるため,個々の症例に対する治療方針については手探りの状態が長く続いた。最近になり欧米ではコンセンサスガイドラインやプラクティスガイドラインが公表されつつある。また日本でもPNETに対して使用可能な新しい薬物治療の登場によって臨床家の注目が高まりつつある[1,2]。本稿ではPNET治療の進歩について,外科治療を中心に解説する。
2010年以降,PNETは2010年WHO分類によって記載されるようになった。このことは治療を考える上でも重要である。国内ではこれまでPNETの記載について,膵癌取扱い規約[3]を利用して行われることが多かった。内分泌腫瘍について2000年WHO分類が示されてからは,病理組織学的所見を踏まえてWHO分類が併記されるようになった。
2000年のWHO分類はPNETの悪性度をKi-67/MIB-1 index,病理組織学的分化度,血管浸潤といった主に切除標本から得られる病理学的情報で規定する一方,腫瘍径を重要な因子として位置付けていた(表1)。術前に判明する情報としては腫瘍径のみであるため,臨床的な治療選択においては腫瘍径に大きな意味があったのである。一方,2010年のWHO分類[4]は,腫瘍の悪性度の評価として細胞分裂の状態,すなわちmitotic indexとKi-67/MIB-1 indexによってNeuroendocrine tumor(NET,G1),Neuroendocrine tumor(NET,G2),Neuroendocrine carcinoma(NEC/G3)に分類している(表2)。したがって腫瘍径は悪性度の因子として加味されておらず,PNETの悪性度が専ら腫瘍の分裂能についての情報で規定されることになっている。

膵内分泌腫瘍のWHO分類(2000年)

膵神経内分泌腫瘍のWHO分類(2010年)
手術切除を中心としたPNETの治療を考えるとき,経過観察が可能な腫瘍が明らかになれば情報として有用である[5~7]。しかしmitotic indexやKi-67/MIB-1 indexは治療前の生検標本で正確に評価することが困難であるため,実質的には悪性度に関する情報は腫瘍を切除しなければ得られないことになる。また腫瘍径は悪性度を規定する因子になっていないのであるから,PNETと診断がつけば腫瘍切除で臨むのが基本的な姿勢ということになる。
機能性PNETは症状の発現をきっかけに画像検索が行われて発見される場合が多い。最近では,わずかな血中ホルモン値異常と画像診断でPNETが発見される場合も増加しているが,無症候性の場合は非機能性PNETとして考えたほうがよい。表3に機能性PNETの種類と臨床的に評価した悪性頻度を示した。機能性PNETは,患者年齢やホルモン症状の程度にもよるが切除手術を第一選択とすべきである。

機能性PNETの分類と悪性頻度
図1に機能性PNETの例としてグルカゴノーマの治療アルゴリズムを示した。グルカゴノーマの疑いがある場合には,グルカゴン値測定,CTとMRIなどの画像検査,可能であればソマトスタチン受容体シンチグラム,カルシウムによるSASI テストを行う。MEN 1の有無は十分に調査すべきである。
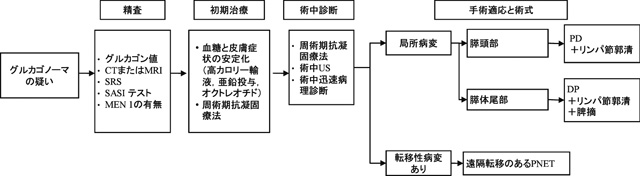
グルカゴノーマの治療
SRS:somatostatin receptor scintigraphy(ソマトスタチン受容体シンチグラフィー)
US:ultrasonography(超音波検査)
症候性腫瘍であるからまず臨床症状の安定化を図らなければならない。グルカゴノーマの場合には,高カロリー輸液,亜鉛投与,オクトレオチドなどによる血糖と皮膚症状の安定化を図り,周術期抗凝固療法を行う。術中には抗凝固療法を行うとともに,術中US,術中迅速病理診断によって正確な進展度評価を行う。転移性病変がない場合は手術切除する。腫瘍の部位に応じた膵切除術を選択する。先述のごとく腫瘍径は悪性度と相関しないので,いずれの術式の場合にも領域リンパ節郭清を実施することが必要である。
非機能性PNETは無症候性であり,腫瘍径が小さいものは画像診断によって偶発的に見つかることが多く,腫瘍径が大きいものは腫瘍による圧迫症状や消化管の通過障害などで発見される。国際的には1cm以下の非機能性NETは肝転移率が低く,経過観察が可能であるとの意見もあった。しかし,2012年のNCCNにおいては散発性の非機能性PNETは全て切除術が推奨されており,本邦においても膵切除術が安全に施行できる施設においては早期の切除術が推奨される。今回の新分類でも悪性度は腫瘍径に関係ないわけであるから,診断がついた場合にはまず切除手術を第一に考えるべきであろう。
図2に非機能性PNETの治療のアルゴリズムを示した。非機能性PNETの疑いがあるときはまずCTやMRIによる画像検査を行う。可能であればソマトスタチン受容体シンチグラムを追加する。血中クロモグラニンA測定やpancreatic polypeptide測定はPNETの診断補助となる。非機能性PNETは浸潤性膵管癌や他の膵腫瘍との鑑別がつきにくい場合があるため,研究者によってはEUS/FNABによる治療前の確定診断を推奨している。

非機能性PNETの治療
SRS:somatostatin receptor scintigraphy(ソマトスタチン受容体シンチグラフィー)
PP:pancreatic polypeptide
EUS:endoscopic ultrasonography(超音波内視鏡検査)
FNAB:fine needle aspiration biopsy
局所病変である場合は切除手術を選択する。腫瘍の大きさによって核出術を行うか,膵頭十二指腸切除術や膵体尾部切除術などの膵切除術を選択するが,いずれの場合も領域リンパ節の郭清を行う必要がある。
PNET以外の消化器癌では遠隔転移がある場合は全身化学療法が主体であり,消化管の通過障害がない限り外科的な治療介入が行われることは少ない。一方,PNETの場合は,肝転移が存在する場合でも原発病巣切除に加えて肝転移巣の切除を同時性に行うことがある。あるいは,膵腫瘍切除後に肝転移をきたした場合にも切除が治療選択にあがる。これは腫瘍学的に体内癌細胞を完全に除去しないまでも肝切除によって腫瘍総量を減少させ,さらにRFA,TACE,薬物療法など集学的治療を加えることでQOLの良い延命を図ることが可能だからである。図3にENETSのコンセンサスガイドライン[8]に示されたPNETの肝転移に対する治療方針を示した。

ENETSコンセンサスガイドラインに示された肝転移のみが存在するPNETの治療方針
LMs = liver metastasis
RFA = radiofrequency ablation
RPVE = right portal vein embolization
RPVL = right portal vein ligation
LITT = laser-induced thermotherapy
TACE = transcatheter arterial chemoembolization
TAE = transcatheter arterial embolization
肝転移に対しては肝切除術の適応を検討すべきである。治癒的な肝切除が可能であれば肝切除術を,またRFAとの組み合わせで肝転移病巣の消失を図る。根治的な切除ができない場合でも腫瘍の相当量を切除可能であれば切除手術とRFAを組み合わせて腫瘍の減量を行う。それ以外の場合はTACE/TAEなどの肝局所治療に加えて,全身薬物療法を実施する。肺転移に対しては全身薬物療法を行いつつ,肺切除術を考慮する。
NET G1およびG2は数年以上の経過において腫瘍増大が見られない症例が含まれているため,抗腫瘍効果をめざした全身薬物治療は,腫瘍増大が明らかな例や,腫瘍が広範に存在し腫瘍増大がおこると臓器機能や生命に関わる恐れのある例が適応となる。ランダム化比較試験では最近,エベロリムス,スニチニブ(保険未承認)がそれぞれプラセボと比較して有意な無増悪生存期間の延長を示している。ストレプトゾシン+ドキソルビシン(保険未承認)も他の治療レジメンに比べて有意な生存期間延長を示しているが,1990年代初頭の研究であり,臨床試験のクオリティに関する懸念も指摘されている。その他の抗癌剤(ダカルバジン,テモゾロミド±カペシタビン),インターフェロン,ソマトスタチンアナログなども一定の抗腫瘍効果が報告されている(いずれも保険未承認)が,PNETを対象としたランダム化比較試験の報告はない,したがって,G2/G3のPNETに対する全身薬物療法としてはエベロリムスを選択することになる。
一方,NEC/G3に対しては病理学的・臨床的に類似である小細胞肺癌でのエビデンスに準じ,白金製剤をベースとした併用療法(エトポシド+シスプラチン,イリノテカン+シスプラチン[いずれも保険未承認])が用いられ高い奏効割合が報告されているが,ランダム化比較試験は実施されていない。
また骨転移には,ビスフォスフォネートを使用し,また放射線療法の適応を検討するのがよい。
PNET治療の最近の進歩について特に外科治療を中心に解説した。腫瘍学的な検討からPNETは腫瘍径に関係なく悪性である可能性があり手術切除を基本とすべきであるという点で,治療方針の選択が明確になりつつある。また術式選択については,小さい機能性PNETのように明らかな被膜を有する場合は腫瘍核出術も選択肢となりえるが,それ以外の場合は膵切除と領域リンパ節郭清を行うべきである。また転移性病変を伴っているPNETに対しても積極的な外科手術介入が選択肢になりえる。
これまで科学的に整理されていなかったPNETの治療については,最新のPNET分類や欧米のガイドラインが入手可能になったことにより徐々に体系的になりつつある。今後は日本における疾患頻度や医療制度をふまえた独自のガイドライン作成が望まれる。