2013 年 30 巻 4 号 p. 310-313
2013 年 30 巻 4 号 p. 310-313
症例は28歳女性。21歳のときに腺腫様甲状腺腫にて右葉切除と左葉腫瘍核出術を受けた。24歳時より,左葉が腫大し,28歳時の第2子妊娠の6カ月より急速に増大してきたために出産後,内科で検査を受けた。超音波検査で左葉に4.5cm大の主腫瘍と0.5~1.0cm大の腫瘍数個を指摘された。主腫瘍は,針生検の結果,鑑別困難な濾胞性腫瘍であったので,当科に紹介された。左葉切除+Ⅰ,Ⅱ,左Ⅲ・Ⅳリンパ節郭清術を施行した。術後の病理検査で低分化癌と診断されたので,甲状腺床に30mCiの131Iのアブレーションを施行した。術後10カ月目に3cm大の再発腫瘤と甲状腺床部の腫大と肺転移をきたした。再発腫瘤と甲状腺床部を切除し,外側区域郭清術を施行した。再発腫瘤と甲状腺床部には癌を認めたが,リンパ節転移はなかった。術後,放射性ヨード内用療法を施行したが,肺転移巣には取り込みはみられなかった。現在T4製剤と5FU製剤を投与して経過観察中である。
甲状腺低分化癌は高分化型乳頭癌ないし高分化型濾胞癌と未分化癌との中間的な形態像および生物学的態度を示す濾胞上皮由来の悪性腫瘍と定義される[1]。今回,腺腫様甲状腺腫の術後に,対側葉に発生した低分化癌症例を経験したので報告する。
患 者:28歳,女性。
主 訴:頸部腫瘤。
家族歴:母親が腺種様甲状腺腫,姉が甲状腺濾胞癌。
既往歴および現病歴:17歳時に甲状腺腫大と機能低下を指摘され,T4製剤50μgの投与を受けた。2004年8月(21歳)に当院耳鼻科にて腺腫様甲状腺腫の診断のもとに右葉切除と左葉腫瘍核出術を受けた。その後,T4製剤100μgの投与を受け,経過を観察されていた。2007年1月(24歳)より,左葉が腫大してきた。2011年11月(28歳)に第2子(男児)を出産したが,妊娠6カ月頃より,左葉が急速に増大してきたために,出産後,当院内科を受診した。4.5cm大の腫瘤を指摘され,穿刺吸引細胞診と針生検を受けた。細胞診でクラスⅢ,針生検で鑑別困難な濾胞性腫瘍と診断されたために,2011年12月に当科に紹介された。
現 症:身長158cm,体重68kg。頸部に甲状腺右葉切除と左葉腫瘍核出術を受けた際の12cmの横切開の手術瘢痕を認めた。甲状腺左葉に4.5×4.5cmの弾性硬,表面平滑,可動性やや不良な腫瘤を触知した。頸部リンパ節は触知しなかった。
血液検査:T4製剤100μgの投与下で,TSH0.010μIU/ml,FT4 1.27ng/dl,FT3 3.56pg/ml,サイログリブリン242.0ng/ml,抗サイログロブリン抗体14.6IU/ml,抗ペルオキシターゼ抗体9.3IU/mlであった。
画像診断:超音波検査で残存の甲状腺左葉に4.5×4.5cmの大腫瘍と峡部寄りに0.5~1.0cm大の小腫瘍を数個認め,腺腫様甲状腺腫と診断した(図1)。99mTc甲状腺シンチグラムでは大腫瘍は集積欠損を示し,201Tl甲状腺シンチグラムのdelayed像で集積の残存を認めたため,悪性の可能性があると診断した。CTにて腫瘍は気管を右側に圧迫して,気管食道溝を埋めるように存在した(図2)。

超音波像
左葉外側に辺縁平滑,内部均一な腫瘍像を認める。内側には数個の小結節を認める。
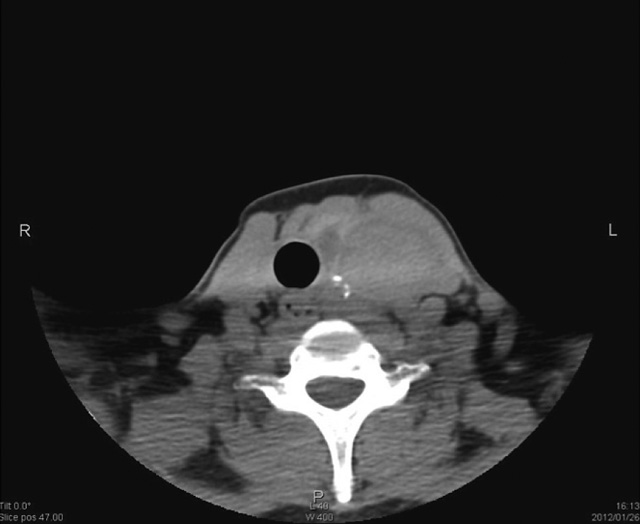
頸部CT像(当科初回手術時)
甲状腺左葉に気管を右側に圧迫する充実性腫瘍を認める。
手 術:以上より,濾胞癌も否定できないと診断し,2012年2月に残存の甲状腺左葉切除とⅠ,Ⅱ,左Ⅲ・Ⅳ群リンパ節郭清術を施行した。大腫瘍は甲状腺左葉ほぼ全体を占め,小腫瘍が狭部寄りに数個存在した(図3)。大腫瘍は周囲へ強く癒着していた。左上副甲状腺は細切して胸鎖乳突筋内に移植した。左下副甲状腺は血流を温存するように残したが,左反回神経は確認できなかった。

摘出肉眼所見
主腫瘍は左葉全体を占めている。数個の小腫瘍を峡部寄りに認める。
病理組織所見:明るい細胞質を有する立方細胞が細胞極性を保ち,腺管構造を形成する部位と明るい細胞質を有する細胞が厚い索状ないし充実性に増生する部位を認め,明細胞型濾胞癌が低分化癌に悪性転化したと診断された(図4)。被膜浸潤や静脈浸潤を認め,低分化部のKi-67陽性率は30~40%であった。リンパ節転移は認めなかった。

病理組織所見(HE染色,×200)
明るい細胞質を有する細胞が厚い索状ないし充実性に増生している。
術後経過:反回神経麻痺はきたさなかったが,低カルシウム血症をきたしたため,活性型ビタミンD,カルシウム剤の投与を必要としたが,術後2週間後にintact-PTH値が正常化したので中止した。5月にはサイログロブリンは2.2ng/mlまで低下した。低分化癌と診断されたため,甲状腺床へ131Iのアブレーションを早期に施行したかったが,授乳中で授乳終了後に希望されたため,7月に131Iの30mCiが投与された。頸部へは良好な取り込みがみられた。9月になると,サイログロブリンは13.5ng/mlに上昇し,10月には頸部手術創上方に3.3×2.3cmの皮下腫瘤が出現したので,穿刺吸引細胞診を施行すると,低分化癌の再発と診断された。甲状腺床部も4.0×3.2cmに腫大していた。CT検査では同腫瘤の他に,両肺野に0.3~1.0cmの転移巣を数個認めた(図5)。

再発時の頸部CT像(左)と胸部CT像(右)
胸骨舌骨筋内に再発腫瘤を認めると同時に甲状腺床部の腫大を認める。肺に小転移巣を数個認める。
再手術:11月に甲状腺床部と再発皮下腫瘤摘出術および左側のⅤ~Ⅶリンパ節郭清術を施行した。再発腫瘤は左胸骨舌骨筋内に存在した。左反回神経は甲状腺床部に巻き込まれていたので合併切除した。前回の手術で温存した左下副甲状腺は確認できなかった。術後の病理組織検査では再発腫瘤と甲状腺床部に低分化癌の増生を認めたが,リンパ節転移は認めなかった。術後サイログロブリンは6.5ng/mlまで低下した。
術後経過:左反回神経麻痺と低カルシウム血症をきたした。2013年1月に放射線ヨード内用療法を施行した。131-Iの頸部への集積は消失したが,肺転移巣への集積は認めなかった。5月にサイログロブリンが18.4ng/mlに上昇したので,PETを行ったところ甲状腺左葉摘出部と肺に集積を認め,CTにて頸部再発腫瘤および肺転移巣の増大を確認した。両部位ともに131Iの取り込みがみられず,放射性内用療法の適応はないと診断された。T4製剤100μg,活性型ビタミンD,カルシウム製剤,5FU製剤の投与を行ってきたが,今後は局所の再切除,外照射,ソラフェニブなどの分子標的治療薬の投与を考えている。
腺腫様甲状腺腫は腺腫や分化癌を合併することがあるといわれるが,腺腫や濾胞癌を合併した場合,腺腫様甲状腺腫の結節との鑑別は難しい。われわれの症例は結節の1つが,他の小結節を圧迫するほど増大してきたため,濾胞癌を疑い,手術を施行したが,すでに低分化癌の状態であった。腺腫様甲状腺腫の経過観察には注意が必要であると改めて感じた。
甲状腺低分化癌は予後良好な高分化癌(乳頭癌,濾胞癌)と非常に予後不良な未分化癌の中間的な形態および臨床経過を示す腫瘍として,1983年にSakamotoらにより提唱された[2]。現在,3つの定義がある。WHO分類は増殖様式として,索状,島状,充実性の3つをあげ,これらの低分化成分が大部分を占めるものを低分化癌と定義している[3]。日本の甲状腺癌取扱い規約では上記の増殖様式が一部にでも認められるものを低分化癌と定義している[1]。2007年のトリノで開催された会議では上記の所見の他に,乳頭癌の核所見を認めないこと,脳回状の核型または,核分裂像,核壊死像を認めることが追加された[4]。われわれの症例では索状,充実性の部分が腫瘍全体の大部分を占めて,低分化の部位に静脈浸潤や被膜浸潤を強く認めた。予後であるが,非腺腔成分(充実性,索状構造,硬化性浸潤)を少しでも認める症例を低分化癌としたSakamotoらの報告では10年生存率は高分化癌では86%に対して,低分化癌では34%であった[2]。WHO分類に基づく低分化癌で検討した伊藤らの報告では10年再発率が高分化癌(濾胞癌)18%に対して,低分化癌では57%であった[5]。
術前診断に関して,山下らは23例の低分化癌を検討して,初診時に反回神経麻痺を伴う症例や各種の画像診断で静脈塞栓を認める症例は高率に低分化癌であったと報告している[6]。また,前川らは穿刺吸引細胞診では,細胞所見よりも,索状集塊,島状集塊,疎結合集ぞくといった細胞配列に注目すべきであるとして,低分化成分が主体を占める症例では診断が可能であると述べている[7]。われわれは今回の経験から,急速に増大してくる充実性腫瘤は穿刺吸引細胞診を施行して悪性リンパ腫や未分化癌が否定された場合は低分化癌を疑う必要があると考えている。
手術術式に関して,伊藤らは術前に低分化癌と診断されたり,疑われた症例は,リンパ節転移や原発巣の被膜外進展が明らかでなくても,全摘および外側区域までの予防的郭清を行うことを勧めている[5]。その理由に低分化癌は浸潤性が高く,リンパ節転移が多いことをあげて,全摘を行っておけば,サイログロブリンが腫瘍マーカーとして使えることや,遠隔転移が生じた場合に放射性ヨード内用療法を行える利点をあげている[5]。術後に低分化癌と診断された場合,つまり,一般的には濾胞癌を疑って片葉切除を行い,術後の病理検査で低分化癌と診断された場合であるが,伊藤らは補完全摘を行うことを勧めている[5]。われわれは局所に再発腫瘤をきたした時点で,Ⅴ~Ⅶリンパ節郭清術を追加したが,転移は認めなかった。このことより旧規約の濾胞型低分化癌では,術前の画像診断で腫大したリンパ節がなければ外側区域の予防的郭清は省けるのではないかと考えている。
術後の再発転移部位やヨード治療に対する効果判定に,従来の放射性ヨードシンチグラフィに代わり,PETが汎用されるようになってきた[8]。われわれも2回目の手術後はPETにて経過観察を行うようになったが,再発部位や転移巣に取り込みを認め,有用であった。特に,サイログロブリン陰性の低分化癌にはPET検査は不可欠となっている[8]。
術後の補助療法として,放射性ヨード内用療法,外照射,化学療法が報告されている[5,6,9]。放射性ヨード内用療法は放射性ヨードが取り込む症例には意義はあるが,予後を延長させるかどうかは不明である。外照射は切除不能な局所再発や局所の根治性があやしい症例に行われる。化学療法についての報告は少ないが,Auerspergらは切除不能な低分化癌34例に対して化学療法あるいは化学放射線療法を行い,半数が切除可能になったと報告している[10]。われわれは古瀬らの報告にならい[9],エビデンスのないことを説明したうえで5FU製剤の投与を行ってきたが,最近,放射線ヨード療法抵抗性の分化癌,低分化癌,未分化癌や局所進行・転移性髄様癌に対してチロシンキナーゼ阻害剤を中心とする分子標的治療が注目されている[11]。現在,放射性ヨード抵抗性の分化癌を対象としたソラフェニブとヴァンデタニブの第Ⅲ相臨床試験も進んでいる[11]。また,熊谷らは未分化癌や低分化癌にイマニチブに放射線治療を併用して効果をあげている[12]。今後,われわれもこれらの分子標的治療薬の投与を考慮にいれて,治療を行っていきたいと考えている。
腺腫様甲状腺腫の経過観察中に,発生した低分化癌を経験したので報告した。