2016 年 33 巻 3 号 p. 161-165
2016 年 33 巻 3 号 p. 161-165
甲状腺未分化癌は,頻度が少なく,また極めて悪性度が高いため,これまでまとまった解析の報告は少なかった。2015,2016年に3つの次世代シークエンサーを用いた甲状腺未分化癌の網羅的ゲノム解析結果が報告されたので,本稿ではそれらをまとめて紹介する。甲状腺未分化癌では,分化癌で見られるドライバー変異のうち,BRAF,RAS変異の頻度が高く,それらの重複はなかった。RET/PTCなどの融合遺伝子は全く検出されなかった。未分化癌で頻度が上昇している遺伝子変異は,TP53とTERTプロモーター変異が約70%で最も多く,その他は,PI3K-AKTシグナル経路を活性化する変異,クロマチンリモデリングに関与する変異などであった。今後は,同定された変異の分子機能解析を進め,臨床応用可能な標的の同定を行っていく必要がある。多施設共同研究を進め,研究の進展を促進させることが望まれる。
甲状腺未分化癌の頻度は非常に少ないものの,その悪性度は極めて高く,平均生存期間はわずか数カ月~半年程度と言われている。外科手術に放射線療法や化学療法を組み合わせた集学的治療を行っても,その効果は非常に限られたものとなっており,新規治療法の開発が望まれている。
様々な種類の悪性腫瘍に対して,これまで遺伝子解析,分子生物学的解析により,腫瘍の発症,進展メカニズムが分子レベルで研究,解明されてきており,その成果としての分子標的治療が臨床現場にも導入されてきている。甲状腺癌の分野でも,難治性の分化癌,低分化癌に対する小分子キナーゼ阻害剤が注目を浴びている。さらに近年,シークエンス技術の飛躍的な進歩によって,一度に大量の塩基配列を決定できるようになり,癌の網羅的なゲノム解析,転写産物解析が行われるようになってきた。このような癌の分子レベルでの理解が,新たな治療法の開発に繫がるものと考えられる。しかしながら,甲状腺未分化癌に関しては,その頻度の少なさ,悪性度の高さもあり,まとまった解析例は少なかった。しかし2015年に1報,2016年に2報の次世代シークエンサーを用いた甲状腺未分化癌の網羅的ゲノム解析結果が報告された。そこで本稿ではこれら最新3論文のデータから何が明らかにされてきたかを解説したい。
まずはじめのスタディは,スウェーデンのKunstmanらによるものである[1]。22例の未分化癌を解析しており,うち19例は原発巣,3例が再発巣。8例に術前放射線療法が行われている。5例が24カ月以上生存しており,この点は気になるが,長期生存例に変異パターンの違いがあるかどうかは,症例数が少なく不明である。15例がホルマリン固定パラフィン包埋(FFPE)切片,7例が新鮮凍結組織からの解析である。筆者らは,ホルマリン固定した標本からの解析が組織像を確認でき,より確実な部位からの解析を可能にしたと記している。解析方法は全遺伝子のエクソンに対するシークエンスで,正常部分もペアとして解析し,germlineの変異や多型は除いてある。他に4つの細胞株も解析を行っている。
次に,韓国のJeonらのスタディ[2]。筆者らが述べているとおり,韓国は日本と同様乳頭癌におけるBRAF V600E変異の頻度が極めて高く(~80%),そういったバックグランドから発生してくる未分化癌である。症例は11例と少なく,全て原発巣の初回手術FFPE切片からの試料を用いている。生存期間は全ての症例で数カ月であり,悪性度は高い。シークエンスの標的領域は,505の癌関連遺伝子のエクソン領域と15遺伝子の一部のイントロン領域である。つまり,これ以外の領域は解析できていない。
最後がアメリカのLandaらのスタディである[3]。長年,甲状腺癌の分野で著明な業績を挙げているニューヨークMemorial Sloan Kettering Cancer CenterのFagin教授らのグループからのもので,信頼性は高いと思われる。この論文は,上記2つに比べ症例数が多く,さらに詳細な解析を行っており,データの量が豊富である。またこの報告は未分化癌だけではなく,低分化癌の解析結果も提示されており,低分化癌と未分化癌で同様の解析を行った違いを確認することができる。症例は33例で,13のFFPEと20の凍結試料の両方を使っている。3例が転移巣,2例が頸部再発巣,残り全ては原発巣である。このスタディでも標的領域をキャプチャーする方法を用いており,341の遺伝子の全エクソンと一部のイントロン部分を解析している。さらに既知の融合遺伝子も検出できるようになっている。この研究では,腫瘍のclonalityやheterogeneity,つまり不均一さにも注意を払っており,ディープシークエンスを行っている。というのは,特に未分化癌ではマクロファージの浸潤が顕著であるためとしている。ディープシークエンスとは,次世代シークエンサーで同じ領域を繰り返し読み(このスタディでは500~700回以上),アレル頻度の低い変異も検出できるようにする方法である。この方法は,組織中の腫瘍細胞の割合が少ない検体については有効で,全体的には変異の陽性率が上昇すると予想される。またその他にも,CGHアレイや遺伝子発現アレイを用い,ゲノムの構造異常や遺伝子発現の情報も得ている。
以上3つの報告で繰り返し検出された遺伝子変異を図1にまとめた。
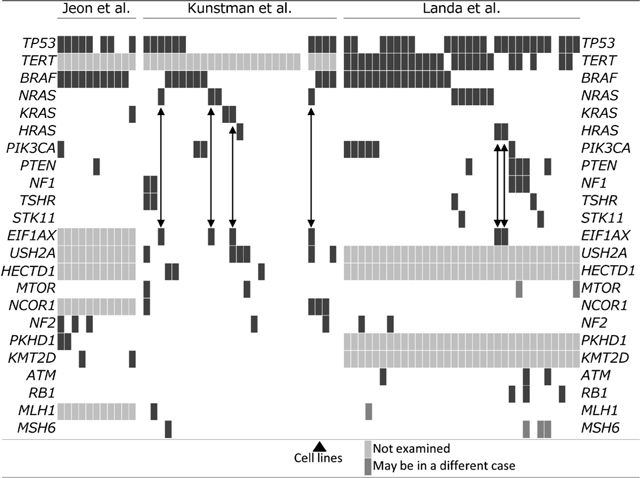
遺伝子変異のプロファイル
各々の研究で検出された遺伝子変異をプロットしたもの。列は各症例。変異を黒いボックスで示している。Not examined:解析対象となっていないもの。May be in a different case:トータルのその遺伝子に見られる変異の数は正しいが,どの症例かは論文からは不確かなもの。推測でプロットしてある。矢印は高率なRAS変異とEIF1AX変異の相関を示している。
分化癌で見られるドライバー変異([4]を参照)
乳頭癌でよく見られる遺伝子変異として最も頻度が高いものがBRAF V600Eである。上にも記したが,欧米では約半数,日本や韓国ではその頻度が高く,70~80%という報告が多い。著者の研究室でも同様のデータを得ている[5]。次にRET/PTCやETV6/NTRK3などの融合遺伝子が特徴的である。RET/PTCは,チェルノブイリ原発事故後の放射線誘発小児甲状腺癌に非常に頻度が高い。RAS変異も稀に見られるが,RAS変異はどちらかと言うと濾胞癌に多い。これらは,MAPKという細胞内シグナル伝達経路を活性化し,この経路が乳頭癌の発症に重要だとされている。これに対し,濾胞癌で重要だと考えられているのがPI3K-AKT-mTOR経路である。前述の変異RASも,甲状腺濾胞細胞ではMAPKよりもPI3K-AKT-mTOR経路を優先的に活性化している可能性が高い。他に,PIK3CA,AKT,PTEN変異などがこの経路を活性化する。(PTEN変異は機能喪失型の変異なので,厳密にはドライバー変異とは言えないが,同じシグナル伝達経路を活性化するのでここに含める。)甲状腺濾胞細胞ではMAPKの活性化が脱分化を誘導するため,乳頭癌の方が濾胞癌よりも分化度が低いと考えられる。
未分化癌におけるこれらドライバー変異の頻度を見てみる。これまでの報告では,おおよそBRAF V600Eが20~30%,RET/PTCが0,RASが20~40%となっていた。まずJeonらの報告であるが,なんと90.9%がBRAF V600E陽性であった。前述したように,韓国での乳頭癌におけるBRAF変異率は高いが,それにしてもこれは驚くべき高頻度である。これは濾胞癌由来の未分化癌が少ないという可能性も示唆するが,症例数が少ないので確実ではない。RAS変異は,KRASが1例(9.1%)のみで,BRAFとRAS変異に重複はなかった。PIK3CA変異も1例,PTEN変異も1例に陽性であった。全てのサンプルで上記ドライバー変異が陽性であった。日本と韓国では色々と共通点が多く,日本でも同じようなプロファイルになる可能性がある。次にKunstmanらの報告では,BRAFが27.3%,RASが同じく27.3%でやはり重複はない。PIK3CAが9.1%,mTORが4.5%であった。これらの変異のない症例が40.9%,ただしこのうち2例(9.1%)にTSHRの変異が見つかっている。以上の数字は,細胞株での結果は除いてある。同様にLandaらの報告では,BRAFが45.5%,RASが24.2%(やはり重複なし),PIK3CAが18.2%,PTENが12.1%,mTORが6.1%であった。これらの変異がないものが15.2%,TSHRの変異は2例(6.1%)に見られ,1例は上記の変異なしに,もう1例はNRAS変異を持つ症例に見られた。
新しい知見としては,まずBRAFの変異の頻度はこれまでの報告より高い可能性がある。韓国では特に高く,日本でも同様の可能性があり,我が国でも症例を集積して調査する必要がある。次世代シークエンスのデータなので,従来のサンガー法より正確である可能性が高い。またこれまで,RAS変異が未分化転化とともに蓄積してくるという報告があったが,決してBRAF変異と重複してくるわけではない。いわゆるmutually exclusiveであり,BRAF変異とRAS変異は同様の機能を果たしている(おそらくMAPK経路の活性化)と予想できる。これに対し,PIK3CAやPTENの変異はBRAFやRAS変異との重複が見られ,癌の悪性化に重要な役割を果たしている可能性がある(これについては後述する)。ただし,重複が見られない症例も多くある。
これに関しては,上述したように低分化癌と未分化癌で同様の解析を行ったLandaらの研究が非常に参考になり,この結果を中心に述べる(表1)。まず,これまでに報告されたもので,未分化癌で増加するとされてきたものでは,TP53,TERTプロモーター,CTNNB1があった。
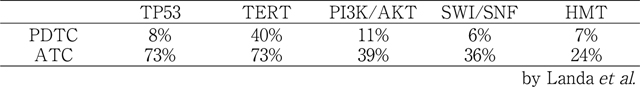
PDTCと比較し,変異の頻度が増加した分子・シグナル伝達経路
まずTP53の変異だが,Landaらのデータでは低分化癌で8%だが,未分化癌では73%であった。これまでの報告と比べ,やや低分化癌での頻度が低い気もするが,やはり未分化癌での増加率は圧倒的である。P53は,ゲノムの守護神としてDNA損傷修復経路,チェックポイント,アポトーシスなど広範な細胞機能に関わっており,この機能が失われることで細胞増殖のブレーキが効かなくなり,このことが未分化癌の悪性度とも強く関連していると思われる。Jeonらの症例でも72.7%にTP53の変異が見られた。しかしながら,Kunstmanらの症例では27.3%しか見られず,大きな違いがある。この研究だけ全エクソンに対するシークエンスを行っているため,シークエンスリードのdepthが浅く(同じ場所をシークエンスしている回数が少ないということ),正常細胞の混入が多かった場合にコールされていない可能性もある。また最初に述べたように長期生存例が多いので,その点も注意が必要か。いずれにしても,TP53変異が未分化転化に最も重要な遺伝子変異であると言える。
次にTERTプロモーター変異である。TERT遺伝子のプロモーター領域にこの変異が生じることにより,転写因子ETSファミリーの結合配列が作られ,TERT遺伝子の転写を亢進させるものと考えられる。近年,TERTは本来のテロメアを伸長させ,細胞の不死化を引き起こすという機能以外にも,NF-κBやβ-カテニン経路の活性化にも関与しており,これらの機能によって癌の悪性度を高めているという報告もある[6]。この変異は,Landaらのデータでは低分化癌で40%,未分化癌では73%と増加している。分化癌での頻度は10%強なので,悪性度が上がるに従って頻度も次第に上昇してくることが分かる。JeonらとKunstmanらのスタディでは,エクソンではないこの領域は残念ながら調べられていないと思われる。TP53と比較すると,より悪性度が低い段階より変異の頻度が上昇する印象である。
CTNNB1に関しては,これまで未分化癌で変異が上昇するとする報告があったが[7],今回の3論文では,変異が検出されたのはKunstmanらの論文での1例のみ,しかもこの症例はミスマッチ修復遺伝子に変異を持つ,いわゆるhypermutator phenotypeであり,その意義は疑問である。どうしてこのような結果となったかは説明できない。今後のさらなる症例の蓄積が待たれる。
Landaらはさらに,いくつかの同じ機能を持った遺伝子グループで,変異の頻度が上昇するものも報告している。まずは既に述べたPI3K-AKT-mTOR経路に関与する遺伝子だが,PIK3CA,PTEN,mTOR以外にも,PIK3C2G,PIK3CG,PIK3R2,TSC2などにも頻度は少ないが変異が見られ,これらを合わせると低分化癌では11%だが未分化癌では39%になると言う。また,クロマチンリモデリング複合体SWI/SNFを構成する遺伝子群(低分化癌6% vs 未分化癌36%)や,ヒストンメチル基転移酵素(HMT)グループ(低分化癌7% vs 未分化癌24%)の変異頻度も有意に上昇していた。後者2つのグループは,遺伝子の転写を調節するエピジェネティックな変化をもたらすものと考えられる。
以上をまとめると,未分化転化で増えるゲノム異常として主なものは,PI3K-AKT経路上の変異,特に既にMAPKを活性化するBRAFなどの変異と重複したもの,TP53変異,クロマチンリモデリング因子の変異となる。
今回のスタディを通して見られた変異の組み合わせに,RASとEIF1AXがある。KunstmanとLandaらのスタディを合わせ,6つのEIF1AX変異が確認されているが,その全ての症例がRAS変異も併せ持っていた。分化癌ではEIF1AXの変異頻度は極めて低く(1%程度),さらにRAS変異との重複はほとんどない。EIF1Aは,遺伝子発現に際し転写開始や開始コドンの認識に関わっているとされるが,未分化癌やRASとの生物学的な関連は全く不明である。検出された変異は,機能喪失を起こすものと推測される。上にも述べたが,RASはBRAFと違い甲状腺細胞の分化度を保つ傾向があるが,この変異がBRAFとの重複がないことより,甲状腺細胞の脱分化に何らかの関連があるのかもしれない。
上述したEIF1AXに加え,ある程度の頻度が見られたのがUSH2A,HECTD1である。これらはKunstmanらによって報告されたものだが,他のスタディでは解析対象には含まれていなかった様である。USH2Aはusherinというタンパク質をコードしており,基底膜と細胞外基質との結合に関与している。癌の浸潤や転移に関係しているとされ,様々なタイプの癌で高い頻度で変異が見つかっている。(そのため,JeonらとLandaらが用いた標的遺伝子中に含まれていなかったのは不思議ではある。)HECTD1はE3ユビキチンリガーゼをコードしているが,この遺伝子変異の癌における機能はあまり明らかになっていない様である。これらの遺伝子に対しても,今後の解析が待たれる。
甲状腺腫瘍では,RET/PTC,ETV6/NTRK3,PPARγ/PAX8などの融合遺伝子が数多く報告され,その誘因,機能に関しての研究が進んでいる。融合遺伝子は,DNAのエクソン部分だけの解析では検出することが困難で,特定のイントロン部分を含めたり,mRNAを使った解析を行わなくてはならない。今回紹介したスタディでは,Landaらのものだけがこれらの解析を行っている。結果を述べると,未分化癌では少なくとも既知の融合遺伝子は全く検出されなかった。従来から未分化癌ではRET/PTCは検出されないとされてきたが,これとも一致するデータである。通常,融合遺伝子の頻度は小児,若年者で多いとされ,逆にBRAFやTERTプロモーター変異は年齢が上がると頻度が上昇する。未分化癌が高齢者で多いから単に融合遺伝子が検出されないのか,それとも何か生物学的な意味があるのかは不明である。しかし,低分化癌では数%は存在するので,融合遺伝子を持った癌は未分化転化を起こさない可能性はある。いずれにしても症例の蓄積が必要と思われる。
コピー数異常,いわゆるDNAの欠失や増幅についても簡単に触れる。低分化癌では,ドライバー変異を持たないものは,このコピー数異常が多く見られる。つまり変異でなく,欠失や増幅を使ってドライバー変異と同じ機能を果たしている可能性がある。これは以前,著者らが乳頭癌でも同じ結果を報告した[8]。しかし未分化癌ではこの傾向は見られず,コピー数異常の頻度は一様に高い。低分化癌と比べ頻度が上昇しているのは,8p loss,17p loss,20q gainである。また,13q lossと20q gainがある症例は,ない症例と比較すると,生存期間が短いと報告された。今後は遺伝子レベルでの解析が必要であろう。
最後に遺伝子発現プロファイルについて述べる。上で述べた様に,乳頭癌ではBRAF変異を持つ腫瘍とRAS変異を持つ腫瘍では,遺伝子発現プロファイルが大きく異なっており,BRAF変異を持つものがMAPKシグナル伝達経路が強く活性化され,分化度が低い[9]。低分化癌ではこの違いが分化癌同様に見られたが,未分化癌では(その名の通り)たとえRAS変異を持った腫瘍でも遺伝子発現プロファイルはBRAF変異を持ったものと類似していた。このことは,通常なら甲状腺細胞でRAS変異がMAPK経路の方にはあまりシグナルを伝えないとされるが,その伝達経路に何らかの変化が起き,MAPK経路も強く活性化しているものと考えられる。このようにシグナルのスイッチが切り替わるメカニズムに関してさらに研究を進めていく必要がある。
現時点での最新の次世代ゲノム解析を使った研究結果について述べた。ようやく未分化癌における癌ゲノムの全体像が明らかになりつつある。臨床応用に向け,現時点で未分化癌特有のターゲットは明らかになってはないが,依然ドライバー変異は重要であると考えられる。今後はこれらのゲノム解析で発見された異常について,実際の腫瘍での分子機能解析を進め,新たな治療ターゲットを同定していく必要がある。未分化癌の頻度の少なさ,悪性度の高さが検体のまとまった解析を困難にしており,今後は多施設での共同研究を推進すべきであろう。