2018 年 35 巻 3 号 p. 179-191
2018 年 35 巻 3 号 p. 179-191
放射性ヨウ素(RAI)はUICC stageⅢ,Ⅳの甲状腺分化癌患者の予後を改善し,stageⅡの患者の一部でも予後を改善する。2015年のATAのガイドライン改訂に伴って,RAIの適応は臨床病理所見に基づくリスク評価によって判断される事になったが,診断量のI-131を投与して撮影したSPECT/CTがリスク評価に有用とする考えも受け入れられつつある。遠隔転移の治療において,欧米では個々の患者について骨髄の最大耐用線量を算出し,初回RAIの投与量を大幅に増やす潮流がある。しかし,日本では最大耐用線量法の実施は一部の大学病院以外では困難と考えられる。分子標的治療薬開始の大前提となる“RAI抵抗性”の判定方法は海外でも議論があるが,日本の実情に即した基準が提唱されている。転移巣におけるI-131の集積性を判断するための全身シンチグラフィとSPECT/CTにおいてはTSH刺激とヨウ素制限が適切に行われている事が必須であるが,厳格なヨウ素制限の実施は容易ではない。
日本におけるRAIの根本的な問題として,放射線治療施設・病室の恒常的不足,排水や換気設備などへの初期投資と維持費が莫大な一方で著しく低い診療報酬,病室からの退出基準などに関する厳しすぎる法的規制,などが未解決のままで,将来の課題は多い。
1941年4月1日にニューヨークの病院でDr. Samuel M. Seidlinらが,骨転移を有する甲状腺癌の患者にI-131を用いた放射性ヨウ素(radioactive iodine:RAI)による治療を初めて行ってから77年が経過した。悪性腫瘍の治療において同じ方法が70年間継続して実施されているのは驚異的である。しかしながら,視点を変えると,他に遠隔転移に対する治療が存在しなかっためにその有効性に関する検証が十分でないまま70年間以上RAIが施行されてきた,ともいえる。しかし,近年の分子標的治療薬(tyrosine kinase inhibitor:TKI)の登場により,RAIは分化癌の遠隔転移に対する唯一の治療法ではなくなった。また,2015年に改訂されたATAの新ガイドラインでは2009年版と比較してRecommendationに関する大きな追加・修正・変更が認められ[1,2],これまでのほぼ画一的な“全摘+中央区域リンパ節郭清→RAI”から臨床病理組織所見に基づいて患者のリスクを評価してRAIの適応を判定する事になった(図1),(表1)。RAIは“selective use”となり,ほぼ全ての低リスクの患者と一部の中リスクの患者ではルーチンに行う必要がなくなった。術後のリスク評価においてもI-131シンチグラフィに加えて血清Tgの測定と頸部超音波検査が重要されるようになった。この改定の結果,北米ではRAIの適応となる患者が従来よりも70%前後減少すると推測されている。術後甲状腺癌の診療における“脱RAI”の影響で北米ではRAIの治療量が再検討されている。特に遠隔転移に対する治療において,ATAガイドライン中の記載は“100~200mCiのempiric therapyあるいはdosimetry”であるが(図1),I-131を取り込む腫瘍に十分な線量を与えるためにdosimetryを行って骨髄最大耐用線量を算出して(図2-3),初回治療時に従来よりも遥かに大量のI-131を投与する方法(maximum tolerable activity method:MTAM)へのシフトがみられ,遠隔転移に対して200mCi以上が投与される事がほとんど無い日本の現状とかけ離れてきている(表2)。
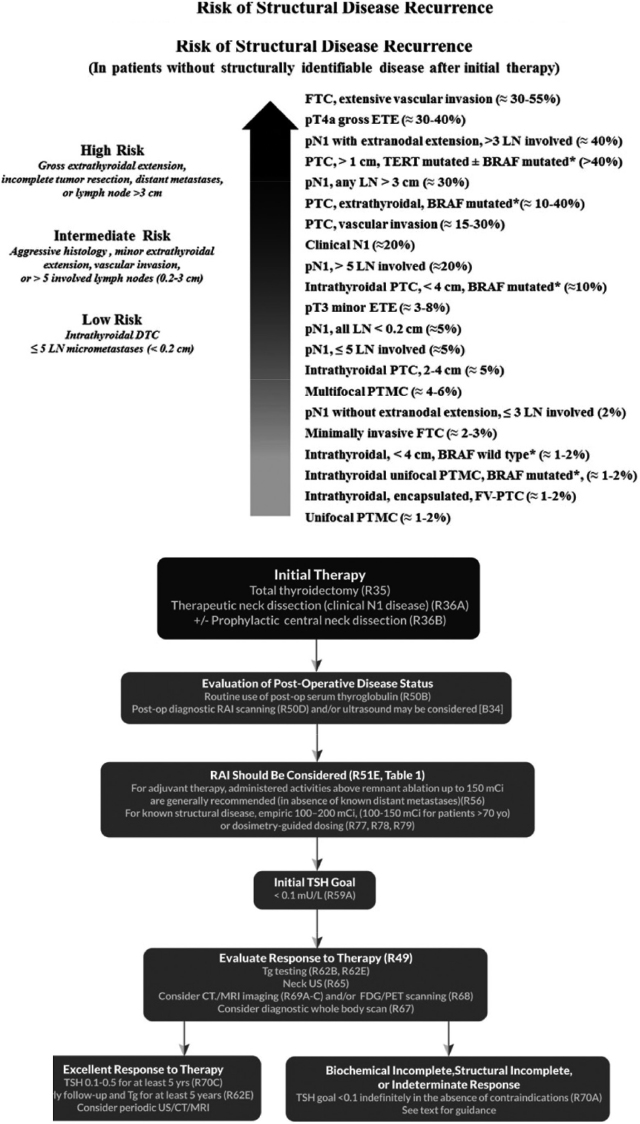
上:初回治療後に画像診断などで確認できる病変(structural disease)がない患者におけるstructural disease再発のリスク。
従来のTNMに 血管浸潤,リンパ節転移の数や大きさ,BRAF mutationなどの項目が追加されている。
下:上段の分類で高リスクの患者の甲状腺全摘術後の方針決定と治療に関する推奨。
いずれも文献1.より引用
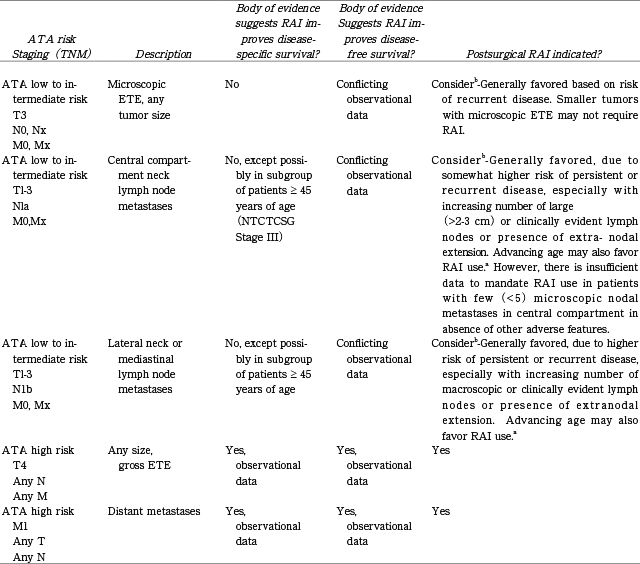
ATAリスク分類およびTNM病期分類によるリスク評価に基づいた,術後にRAIの実施が必要,もしくは好ましいとされる患者群の一覧。
pT3・pT1-3pN1a・pT1-3pN1bはadjuvant RAIが好ましいとされ,pT4はadjuvant,M1はtherapy (of metastatic disease) の適応とされる。
(文献1.より引用。一部改変)。
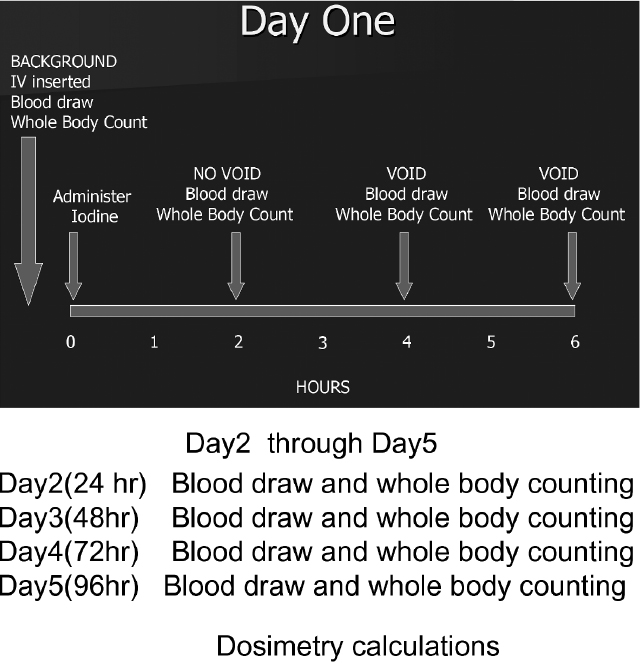
最大耐用線量法のDosimetryにおける体外計測のプロトコルの一例 体外計測にはdual headのガンマカメラが用いられる。
(ボストン大学メデイカルセンター Christopher Martel先生のご好意による。一部改変)
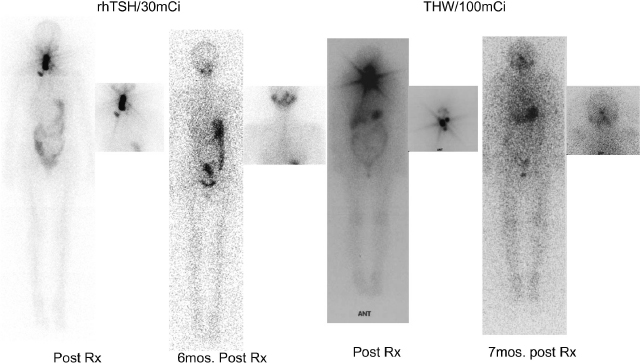
アブレーションとアジュバント
左;20歳代女性。StageⅠ(pT4apN1aM0),rhTSH2日間筋注とI-131 30mCi投与によるアブレーション。
右:60歳代女性stageⅢ(pT3pN9mo)。甲状腺ホルモン休薬と100mCi投与によるアジュバント
いずれの患者も治療後の全身シンチグラフィ(post Rx)では頸部に複数のI-131集積を認め,6カ月後,7カ月後のfollow upの全身シンチグラフィでは集積は完全に消失,TSH 刺激下Tg値も1.0(ng/mL)未満となった。
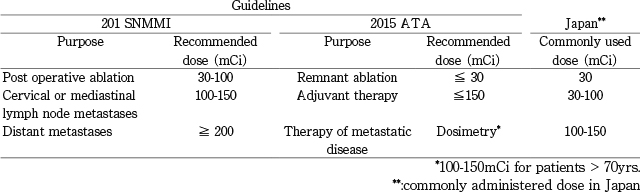
RAIの目的とI-131の推奨投与量。
2012年のSNMMIガイドライン,2015年ATAガイドライン,および日本で一般的に用いられている投与量の比較。(遠隔)転移の治療におけるI-131投与量が日本では少ない。
Theranosticsは“Therapy”と“Diagnosis”を組み合わせた“腫瘍の生物学的特徴を反映して治療方針や治療効果と直結する画像診断”を意味する造語で,ここ数年,核医学や分子イメージングの領域で頻繁に用いられている。甲状腺癌の診療における“Radioiodine Theranostics”は,I-131を投与して撮影した全身シンチグラフィやSPECT/CTが“腫瘍のNa/Iシンポーターの発現やI-131を取り込む腫瘍の分布と局在を画像化し集積程度を評価して治療効果の予測も行う”,という事を意味する。今年の米国核医学分子イメージング学会(SNMMI:6/23~6/26,ペンシルバニア州フイラデルフイア)でも,学会期間中に“Radioiodine theranostics”に関する教育セッションが3コマ開催され,立ち見が出るほどの盛況であった。本稿の中ではこの教育セッションの内容の一部も紹介させて頂く。
米国では甲状腺癌の予後の改善におけるRAIの意義を検討した大規模な研究の結果が報告されている。National Thyroid Cancer Treatment Cooperative Study Group(NTCTCS)のレジストリに1987~2001年の間に多施設から登録された2,936名の患者を対象とした最長14年間(中間値3年)に及ぶ追跡調査では,RAIによってDisease free survival(DFS)に関してはStageⅢ,Ⅳの患者で,Overall survival(OS)に関してはstageⅡ,Ⅲ,Ⅳの患者で有意に改善した[3](表3)。
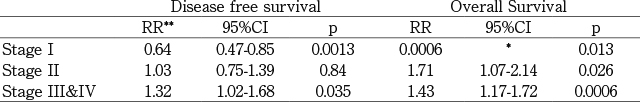
米国National thyroid cancer treatment cooperative groupによる他施設共同研究におけるRAIの生存率への効果
(文献3.より引用。 一部改変)
*:95%信頼区間の下限がゼロ
**:risk ratio “RAIなし”の患者と“RAIあり”の患者のハザードの比(non-RAI/RAI)
RRの値が1より大きい場合にはRAIによって生存率が改善したと判定する。
同様にNTCTCSに登録された4,941名の患者を対象とした最長観察期間25年(中間値6年)のコホート研究で,RAIはStageⅢ,ⅣのOSとStageⅡのDFSを有意に改善させた。甲状腺全摘術ないし準全摘術のRAIは高リスクの患者に対して有用であり,一方,低リスクの患者に対する利益はない,と結論された[4]。
National cancer data base(NCDB)に登録された21,870名のintermediate risk(pT3pN0MxないしpT1-3pN1Mx)の乳頭癌患者における最長14.9年(中間値6.6年)の追跡調査において,アジュバントRAIは全てのステージのOS,45歳未満の患者のOS,65歳以上の患者のOSを改善し,全患者で29%(HR0.71,CI0.62~0.81),45歳未満の患者で36%(HR 0.64,CI0.62~0.81)死亡率を減少させた[5]。
既知の転移巣の治療に関しては,NCDBに登録された11,832名のstageⅣの分化癌患者の後ろ向き解析の結果,転移巣に対して外照射が施行されたか,放射線治療を行わなかったRAI非実施群 vs. RAI実施群の5年間/10年間の総死亡率は乳頭癌では22.7% vs. 11.0%/25.5 vs. 14.0%。濾胞癌では45.5% vs. 29.2%/51% vs 36.8%であった。乳頭癌,濾胞癌いずれもRAI実施群の死亡率は非実施群よりも低値であり,RAIによってstageⅣの患者の生存率が改善する事が示された[6]。
治療効果を得るために病巣に付与される線量は甲状腺の残存組織では300Gy,リンパ節転移は85Gy,骨転移は350~650Gyと考えられ,腫瘍への線量が35Gy未満では,RAIの効果は得られない,とされている[7~9]。
従来は転移部位に応じたI-131の推奨投与量が定められていた[7]が,今回の改訂 ATAガイドラインでは,RAIそのものが目的に応じて三つに分類された(表2)。
a)アブレーション(Ablation)術後に残存する正常甲状腺組織を破壊するもので,癌の治療を目的とするものではない(図3)。以前はアブレーションとアジュバントの区別はなく,現在もしばしば混同されている。アブレーションよって,血清Tg値が腫瘍マーカーとして利用できるようになり,放射性ヨウ素を用いたシンチグラフィによる全身検索が可能になる。アブレーションの生存率への影響はない。低リスク及び一部の中リスクの患者が対象となり,I-131の投与量は30mCiで,TSH刺激方法は甲状腺ホルモン休薬でもrhTSH筋注でも良い。甲状腺の切除が準全摘未満に留まり残存組織量が多い場合には投与量を増やす。
421名のpT1-pT3の患者を対象としてablationの効果を投与量が30mCiと100mCiで比較した研究では,ablationの成功率は30mCiで85.0%,100mCiで88.9%,TSH刺激をrhTSHで行った群と甲状腺ホルモン休薬で行った群における成功率は各々87.1%と86.7%で,投与量やTSH刺激法による成功率の差は認められなかった。30mCi/rhTSH群vs. 100mCi/甲状腺ホルモン休薬vs. 100mCi/rhTSH群の成功率は84.3% vs. 87.6% vs. 90.2%で,やはり有意差を認めなかった[10]。74 名の患者を対象としてrhTSH群と甲状腺ホルモン休薬群におけるablationの成功率とQOLの変化を検討した研究ではTSH刺激下の Tg<0.8ng/mLの達成率は,rhTSH群vs.甲状腺ホルモン休薬群で91.7% vs, 97.1%で有意差はなく,QOLはrhTSH群でより良好に保たれていた[11]。また,rhTSHの使用は甲状腺ホルモン休薬と比較して全身の被曝線量を減少させる効果も認められた[12]。
b)アジュバント(Adjuvant therapy):術後の病理組織所見によって顕微鏡的な癌の残存が疑われ,明らかな遠隔転移は認めない患者の治療で,頸部やその他の部位に存在する微小な癌組織を除去する事によってDFSやOSの改善を目指す(図3)。中~高リスクの患者が対象となる。
TSH刺激法はrhTSH筋注でも甲状腺ホルモン休薬でも良い。
術後のStimulated Tgが高値で,手術所見でリンパ節転移がpN1bかつM0の161名の患者を対象として全摘後にadjuvant RAIを行い,I-131投与量の中間値が100mCi,150mCi,200mCiの3群に分けて“全摘+RAI”の治療効果を比較した研究では,45歳未満の患者(stageⅠ)では,adjuvantの投与量を150mCi以上に増加しても100mCiの群と比較して治療効果の改善を認めなかったが,45歳以上の患者(stageⅣa)では,投与量の中間値100mCi,150mCiと200mCiの群において,治療後も画像などで確認できる腫瘍が残存した症例の割合は各々46%,23%,17%で,I-131高投与量の群において100mCiの群よりも低下した。“全摘+RAI”後にNEDとなった患者は全体の39%で,biochemical incomplete response(TSH刺激下のTg>10ng/mL)は15%に,structural incomplete diseaseは30%に認められた[13]。
61名のpT1~pT4bpN1bM0(リンパ節転移の平均6個)の乳頭癌患者を対象として30~244mCi(中間値150mCi)のI-131を投与して治療効果を検討した研究では,RAI後の検察期間(中間値20カ月)中に再発ないし頸部の転移巣の残存を認め,RAIの追加や再手術を必要とした患者は13%および5%,新たに遠隔転移が発現したのは5%で,1名に未分化転化がみられた。初回治療後に68%の患者でbiochemical response(TSH抑制下のTg<1.0 ng/mL)が認められた[14]。
c)転移巣の治療(Therapy of Metastatic Disease):画像診断などで存在が確認されていて,I-131を取り込む局所ないし遠隔転移を治療して治癒や寛解の達成,あるいは腫瘍の残存や再発のリスクを減少させてOSの改善を図る。I-131の投与量は200mCi以上が推奨され,最大投与量の上限はない。北米では 診断量のI-131を投与した後経時的に測定して線量を算定し,RAIの副作用決定臓器である赤色骨髄の吸収線量が200cGy(=200rad)を超えない範囲で投与できる最大の放射能量を初回治療時に用いる最大骨髄耐用線量法(MTAT)が行われるようになってきた。MTATで算出される投与量は,しばしば300~400mCiを越える(図4)。積算投与量は1Ciまでは安全とされている。従来の治療量で反応しなかった腫瘍が縮小したりTgが陰性化した症例が示されている(図5)が,この方法の中長期的な予後への影響,あるいは,二次性発がん,生殖腺や唾液腺障害などの副作用に関しては今のところ不明である。腎機能の低下している患者,小児,70歳以上の高齢者はMTATの適応にならない。注意点として肺転移のある症例ではI-131投与後48時間後の肺の貯留量が80mCiを超えないように,肺転移のない症例では全身の貯留量が120mCiを超えないようにする。転移巣の治療の場合はTSH刺激は甲状腺ホルモン休薬を行う。Dosimetryを行う場合は,これに一週間を要するので,実際の休薬期間は3週間となる。rhTSHの使用は甲状腺機能低下症によって重篤化する恐れのある合併症を有している場合や甲状腺ホルモン休薬ではTSHが十分上昇しない場合に考慮される。このように北米では転移巣の治療におけるI-131の投与量は“部位毎に固定した量”から,“リスクを考慮して個別化された量”へと変化している。

I-131を取り込む頸部リンパ節転移,骨転移(前頭骨,胸椎,左大腿骨),多発肺転移を有する症例のpre ablation SPECT/CT同定(ミシガン大学放射線科Anca Avram先生のご厚意による)
原発腫瘍は長径1.8cmのfollicular variantの濾胞癌で切除断端陽性。リンパ節転移はcentral node15/27,lateral node 6/16 のN1bであった。Pre ablation SPECT/CT施行時のTSH118(μg/mL),Tg862(ng/mL)であった。左:全身シンチグラム正面像と,中上:頭部,中下:胸部肺条件(冠状断),右上:頸部,右下:胸部骨条件(Th11),のSPECT/CT融合画像。Dosimetryの結果,投与量1mCiあたりの吸収線量は全身0.56cGy(=0.56rad),血液が0.62cGy(=0.62rad)で,最大耐用線量法に基づくI-131の投与量は320mCiとなった。
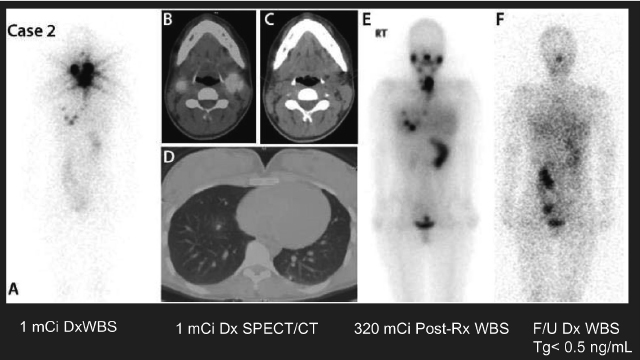
最大耐用線量法によるRAIの遠隔転移への効果(ミシガン大学放射線科Anca Avram先生のご厚意による)
患者は20歳代女性,甲状腺内に多発する乳頭癌で病理所見はpT3(m)pN1aM0
リンパ節転移の数は3個で臨床病理学的にはlow riskであった。
左:1mCiのI-131投与後48時間後の全身シンチグラム(WBS)と頸部,胸部のSPECT/CT。両側上内深頸リンパ節と両肺の小結節にI-131集積を認め,肺転移が判明した。
中:最大耐用線量法に基づき算出された320mCiのI-131投与後のWBS
右:治療効果判定目的のWBSではI-131集積は消失し,TSH刺激下Tg値も0.5(ng/mL)未満となった。前胸部の淡い集積は乳腺へのものである。
日本で通常,アブレーションでは30mCi,アジュバントでは100mCiが投与されるが,アブレーションにアジュバントの効果を期待して実施されている場合が多い。また,転移に対する治療の投与量は100~150mCiの間が一般的で,200mCiを超えて投与される事は極めて少ない。最近の北米での考え方に従えば,日本での一般的な投与量では腫瘍の縮小効果を期待するのに必要な線量は与えられない事になる。しかし,日本では治療病室における1日最大使用量,年間最大使用量,貯蔵室の能力,などの枠があり,一部の大学病院を除けばTMAT法をルーチン化する事は実質的に困難な状況である。また,I-131はカプセルで供給されるので,図3-4に示されるように320mCiのI-131を投与する場合には50mCiのカプセルを6個と5mCiのカプセル4個を服用する事になり,治療を受ける患者の多大なdistressを伴う可能性がある。転移の治療に関しては欧米と日本の間の隔たりが広がりつつあり,日本で頻用される投与量の妥当性に関する検証が必要となるかもしれない。
従来,甲状腺全摘後,RAIの実施前に診断量(1~5mCi)のI-131を与して撮影するシンチグラフィ(pre ablation scanあるいはdiagnostic scan)は必須でないという考えが支配的で,その理由として,a)治療量投与後のシンチグラフィ(post therapy scan)と比べて病巣検出の感度が低い。b)stunningが生じる可能性がある,などが指摘されており,pre ablation scanは症例を選んで実施される傾向があった。
一方でpreablation scanが手術後のリスク評価に有用である,とする意見も浸透しつつあり,今年のSNMMIのセッションでも講演があった。1mCiのI-131を投与して24~48時間後に撮影したpre ablation SPECT/CTとpost therapy scanの結果は303例中280例(92%)で一致し,post therapy scanがupstageを示したのは4例(1.4%)のみであった[15]。更に320名の患者を対象とした前向き研究で,pre ablation scan は手術所見と比較して35%の患者で局所転移を,8%の患者で遠隔転移を新たに検出した。45歳未満患者の4%,45歳以上の患者の25%でステージが変更になり,最終的に320名中99名(31%)で治療方針が変更になった[16]。Pre ablation SPECT/CTの利点として,a)臨床病理学的所見 (pTpNM)を補完できる。b)患者がRAIにより利益をうけるかどうかを判断できる。c)RAIのターゲットを同定できる,が考察され,hybrid装置や画像再構成法の進歩が感度の向上につながった,としている。骨髄最大耐用投与量を算出する際のdosimetryにpre ablation scanは必須の検査となる。また,後述するRAI抵抗性の判定においても診断量のI-131投与によるSPECT/CTはRAIの実施可能な施設が限られ,しかもRAIまでの待機時間が長く,MTAMの実施が困難な日本の実情に適した方法と考えられる。
最も重要な事はI-131を取り込まない病巣の局在と数を明らかにする事である。
TSH刺激下のTg値が10ng/mL以上を示す場合はFDG-PET/CTを撮影する。FDG集積陽性の病変は,RAIに反応するとは考え難く,病理組織学的にも低分化で将来増大するリスクが高いと考えられるので(図6)[17],病変の部位と数に応じて外科的切除,外照射,TKIなど他の治療法を選択する。FDG集積が陰性の場合は北米では再度,adjuvantに準じてRAIを行う傾向があるが,長期間病勢が安定したままの症例も存在するので,慎重に経過観察を行う。FDG-PET/CTはstructural disease 再発のリスクが中等度以上でTgAbが陽性でTgが腫瘍マーカーとして利用できない患者の評価にも有用であり(図7),RAI抵抗性の判断の際にも参考になる。
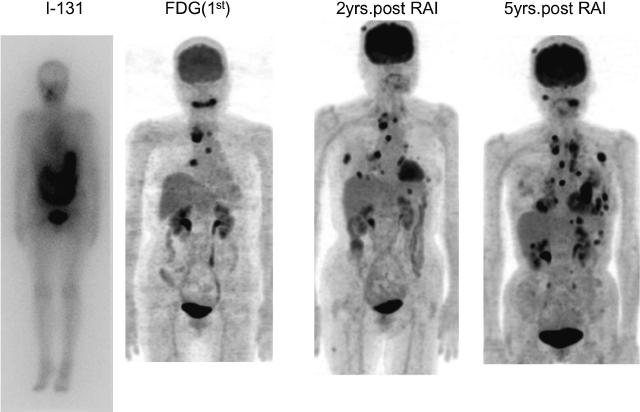
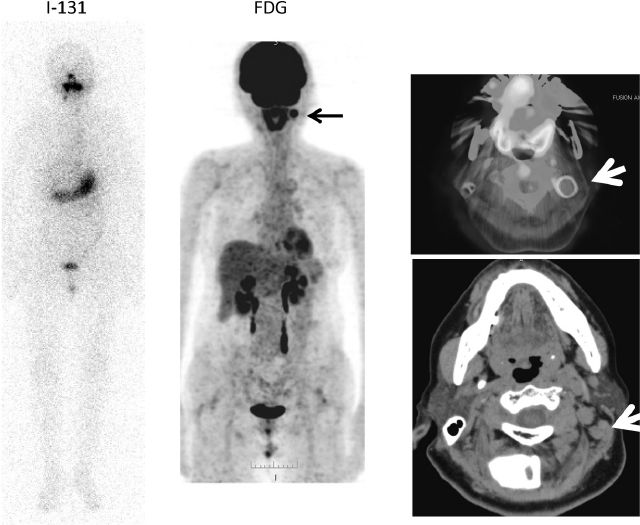
I-131 集積が陰性,FDG集積が陽性の濾胞癌
50歳代,女性,I-131 100mCi投与後のWBSでは胃,腸管,膀胱への生理的集積のみを認める。RAI時に撮影したFDG-PET/CTのMIP像では,頸部,縦隔,右肺門部のリンパ節転移へのFDG集積を認める。TSH抑制と放射線照射が行われたが,2年後,5年後のfollow upでは頭部皮下,肺,肋骨,腹部リンパ節に新病変の出現が見られる。サイログロブリン倍加時間は0.64年と短縮していた。現在であればTKIの適応となったと考えられる。
橋本病を合併した乳頭癌の甲状腺全摘術後の頸部リンパ節再発。手術所見はpT3(m)pN1b。リンパ節転移の数は6個。術後にアブレーションを施行されている。(2015年ATAガイドラインではintermediate riskに相当し,アジュバントの適応となる。)TgAbは陽性で,Tg値は一貫して検出感度未満であった。
左;アブレーション12カ月後のdiagnostic dose scan では異常集積を認めない
中および右;FDG-PET/CT全身MIP像とPET/CT融合画像では左上内深頸リンパ節(Vb)転移へのFDG集積を認める(←)。このリンパ節はUSでは同定できなかった。
Sorafenibの第三相試験DECISION[18]におけるRAI抵抗性甲状腺分化癌の定義は
(1)I-131集積を示さない病巣が1箇所以上存在する場合。
(2)I-131の集積を示すが
(a)一度ないし複数回のRAIが施行されていて,最終の治療から13カ月以内に病勢の進行が認められる場合,もしくは
(b)I-131の積算投与量が600 mCi以上に達している場合 とされている。
また,lenvatinib の第三相試験SELECT[19]では,
(a)I-131の集積がなく,長径の測定可能な病巣(=CTで1cm以上:RECIST 1.1における標的病変)が1箇所以上存在する,
(b)I-131の集積を認めるが治療後12カ月以内にRECIST 1.1に基づく評価で“進行”と判断される病巣が1箇所以上存在する,もしくは
(c)I-131の積算投与量が600mCiを超え,過去13カ月以内に放射線学的に病勢の進行が認められる,と定義されている。
また,PaciniとSchlumbergerは“RAI抵抗性示す患者”を6つのカテゴリーに分類している[20]。
①初回のRAIでI-131を取り込まない転移巣を有する患者;このカテゴリーにおいてはRAIは何の利益もない。
②以前の治療ではI-131が集積したが,その後にI-131を取り込む能力を喪失した腫瘍を有する患者:これはRAIでI-131を取り込む能力のある高分化の細胞だけが破壊され,I-131を取り込まない低分化の細胞が残存した為である。
③多発する転移の一部にI-131の集積を認めるが,I-131集積を認めない腫瘍も存在する患者;これはI-131全身シンチグラフィ(WBS)とFDG-PET/CTないしCTを比較した時にしばしば認められ,I-131の集積を示さなかった腫瘍が増大する可能性が高い(特にFDG集積が陽性の場合)。
④明瞭なI-131集積を認めるにもかかわらず,腫瘍の増大が認められる患者:
それまでのRAIが適切に行われていたのであれば,その後にRAIを反復しても無効である。
⑤全ての転移巣へのI-131集積が保持され続けているにもかかわらず,複数回のRAIによって治癒せず,かつ,RECIST 1.1に基づく評価で進行も認めない患者;
このような患者はRAIによって治癒が得られる可能性は低く,一方,二次的発癌や白血病などの副作用のリスクは高まる。このような患者に対して更にRAIを継続するかどうかは,過去のWBSにおけるI-131の集積程度,FDG集積の低い病変の存在(=将来増大する可能性は低い),それまでに発現した副作用の有無を考慮して判断する。
⑥進行した腫瘍が存在するが甲状腺全摘術が困難な患者:
このような患者はRAI抵抗性として対応するか,甲状腺を破壊する目的でRAIを行う。
日本における“放射性ヨウ素治療抵抗性の局所進行性,再発・転移性分化型甲状腺癌に対する分子標的薬治療の適応患者選択の指針”[21]において,RAI抵抗性は“甲状腺全摘後の患者で,1~2週間の厳密なヨウ素制限を行いTSH値が十分に上昇した状態で放射性ヨウ素I-131が投与され,(1)全身シンチグラムで放射性ヨウ素の集積取り込みが全く認められないか,極めて淡い集積しか示さない病変が存在する。(2)I-131の集積が良好であるにも関わらず,3~4回のRAIの放射性ヨウ素治療後増大あるいは増加を示す病変が存在する,場合にRAI抵抗性と判断する”とされている。また,“全身シンチの撮影の際には可能な限りSPECT/CTを追加撮影する”。“甲状腺が全摘されていない患者において“二期的な残存甲状腺の切除を安全に施行しえる場合には,残存する甲状腺を切除する。二期的な切除の代わりに,50~100mCiのI-131を投与して甲状腺組織を除去する事も可能である。この場合に頸部腫脹や喉頭浮腫をきたし生命に関わる事があるので,RAI実施担当医師との十分な相談の上で決定すべきである。その後にI-131を投与して全身シンチとSPECT/CTを撮影し,病巣へのI-131の集積がみられない場合はRAI抵抗性と判断する。”と記載され,海外の記述と比べても詳細で優れた内容である。
今後は,I-131の集積程度や放射線学的な病勢の推移に加えてRAIと甲状腺機能低下症に起因する重篤な副作用を合併する場合や,腫瘍に起因する症状でRAIで改善しない疼痛などの存在,といった要素も加味すると更に完成度が高まると思われる。
海外でも国内でもシンチグラフィを撮影する際のI-131の投与量に関する記載はない。MTAMへの急速なシフトの影響からか,今回のSNMMIの教育セッションでもmodulatorは“I-131の投与量が75~100mCiの場合には治療後のシンチグラフィでI-131集積を示さない病変が存在しても,I-131集積陰性と判定するべきではない!”と,強調していた。理想的には,RAI抵抗性は,少なくとも一度RAIを施行し,post therapy scanの所見で評価されるべきである。しかし,治療病室の恒常的な不足からRAIまでの待機期間が長い日本では,前述のdiagnostic scanを活用するのも現実的な方法と考えられる。個人的にはFDG-PET/CTを組み合わせる事で,中長期的に腫瘍が進行し予後不良となる可能性の高い患者とそうでない患者を識別できるのではないかと考える。
信頼性の高いI-131シンチグラフィの情報が得られるために重要なポイントは
①SPECT/CT融合画像を作成する。CTは低線量でなく診断条件で撮影する。
②画像は放射線科医と担当医が協力して読影する。
③前処置が適切に行われている[22]。TSH刺激法は diagnostic scan においてはrhTSH筋注でも甲状腺ホルモン休薬法でも良く,転移巣の治療においては甲状腺ホルモン休薬法が好ましい。I-131投与時のTSH値は原則30(μU/mL)を超えていなければならない(図8)が,濾胞癌の多発性転移などで転移巣の機能が著しく亢進している場合にはTSHが上昇しない事もある。
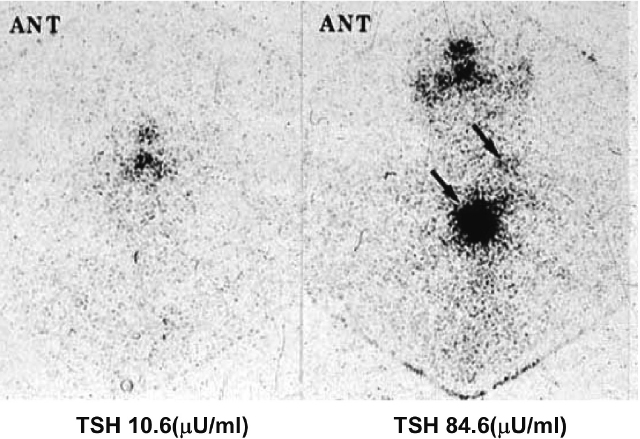
TSH値がI-131集積に及ぼす影響
60歳代,男性,濾胞癌の全摘後にアジュバント(100mCi)を施行
左:甲状腺ホルモン休薬が適切に実行されない状態でI-131が投与されたため,頸部シンチグラムでは鼻腔と口腔にのみ淡い集積がみられる。
右;再検時にはTSHが十分上昇しており,左頸部と上縦隔に明瞭なI-131の集積が認められる(矢印)(文献22より引用)。
ヨウ素制限も重要な前処置で,SNMMIの教育セッションでも強調されていた。ヨウ素制限が不適切であるとI-131の集積性が低下する(図9)。日本人は日常の食生活におけるヨウ素摂取量が非常に多い。海藻類,特に昆布はわずか1gでも厚労省の定めた極量に相当する約2,000μg前後のヨウ素が含まれており,だし汁の中にはヨウ素が溶出する。昆布だしは,めんつゆ,みそ,醤油,酢,ドレッシング,レトルト食品などのさまざまな調料,加工食品中に含まれているので,患者にはヨウ素制限期間中に食材の吟味と合わせて利用する調味料や加工食品,市販のスナック類や清涼飲料品は必ず,原材料名のラベルを確認する習慣を身につけてもらい,ヨウ素制限期間中の外食,市販の弁当や惣菜などの使用を極力控えてもらう。ヨウ素制限に関する資料を患者に渡すだけよりも,栄養士による栄養指導を実施すると患者はヨウ素制限について具体的な理解が深まる様である[23]。しかし,ヨウ素制限の栄養指導は生活習慣病などstrategyとして確立している分野と比べて煩雑で労力を要するにも関わらず,保険収載されていない。随時尿中のクレアチニン補正した尿中ヨウ素濃度(UIC)はヨウ素摂取量のバイオマーカーとなり,RAI当日のUICが100(μg/gCRE)未満であれば,ヨウ素制限は適切に施行されたとみなされる[24]が,この目的でのUIC測定は保険適応となっていない。なお,チラーヂンS50μg一錠中には32μgのヨウ素が含まれている。また,イソジンやルゴール以外の処方医薬品の中にも赤色3号(1mg中のヨウ素量が565.7μgと極めて多い)が添加物として使用され,休薬ないし他の製剤に変更しなければならないものがある(表4)。先発品と後発品で主成分以外の添加物が異なる医薬品もあるので,注意が必要である。
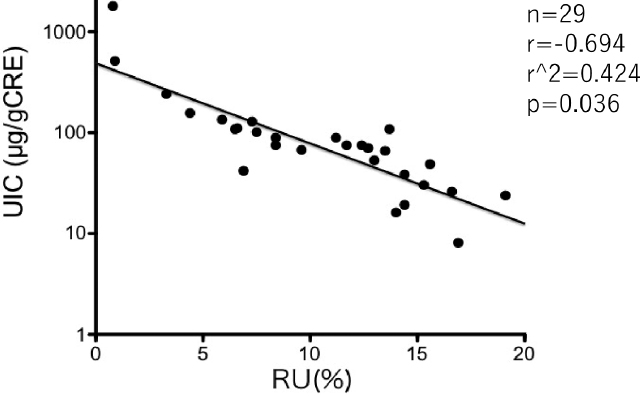
rhTSH刺激下でアブレーションを行った患者における治療当日の尿中ヨウ素濃度(UIC)とガンマカメラ法で算出した投与3日後の前頸部I-131摂取率(RU)との関係。
UICとRUには負の相関が認められ,ヨウ素制限が不適切であるとRUが低下する。(文献23より引用。)

赤色3号を添加物として含む医薬品と同じ効能で交換可能な他の製剤の例
冒頭でも触れたように,海外と比べて日本では法律に定められた濃度基準を満たすために排水設備や排気設備に多大な投資が必要でRAIを実施するためのハードルが高く,しかもRAIを行う施設が収益を上げるのは不可能な診療報酬体系になっており,当面打開する見込みがない。平成22年度診療報酬改定で放射線治療放射線治療病室管理加算が従来の500点から2,500点/日に増額されたが,日本核医学会の試算では放射線治療病室管理加算として17,267点/日が必要で,大きな開きがある。RAI抵抗性示す甲状腺癌がいったん進行し始めると予後は不良なので,多くの患者がRAIとTKIの恩恵を受け,RAI抵抗性が最適のタイミングで判定され,患者の予後の改善につながるよう,学会の枠を超えた取り組みが必要である。