2021 年 70 巻 2 号 p. 243-251
2021 年 70 巻 2 号 p. 243-251
我々はGOD固定化酵素膜電極法を原理とした,血漿/全血測定に対応した2機種のグルコース分析装置の性能比較を実施した。正確性確認では両装置とも良好な正確性を示し,併行精度・室内再現精度においても良好な精密性が確認された。相関性については,血漿/全血どちらで測定した場合も現行装置や他測定法に対して相関性が確認された。全血測定では高ヘマトクリット検体ほどグルコース値の変動を認め,ヘマトクリットが全血測定に大きく影響することが確認された。しかし,日常検査を遠心操作が不要である全血測定へ変更することは,検査業務の効率化やTAT短縮など臨床貢献へ繋げられる可能性があると思われる。グルコース検査に用いられる検体は動脈血,静脈血,血漿,血清,全血など様々であり,測定法も複数存在するが,それぞれの特徴を理解し使い分けることで,検査精度の担保が可能になると考えられる。
We compared the performance of two glucose analyzers on the basis of the glucose oxidase immobilized enzyme membrane electrode method for both plasma and whole blood measurements. Regarding their accuracy, both analyzers showed good accuracy, and within-run and between-day reproducibilities were also confirmed to have good precision. A high correlation was confirmed for plasma and whole blood samples analyzed with the current equipment and other measurement methods. In whole blood measurement, samples with a high hematocrit showed greater fluctuations of glucose levels, and it was confirmed that the hematocrit greatly affected the whole blood measurement. However, changing the routine work to whole blood measurement eliminates the need for centrifugation, which can lead to more efficient measurement operations and a shorter TAT. As a result, it is conceivable that efficiency could lead to clinical contribution. There are various samples used for blood glucose examination, such as arterial blood, venous blood, plasma, serum, whole blood, and there are multiple methods, and we considered that the measurement accuracy could be ensured by understanding and using the characteristics of samples and methods.
日常検査におけるグルコース測定法はHK法やGOD電極法など多様であるが1),病院検査室においては同一検体によるHbA1c連続測定を考慮し,GOD電極法に基づく自動分析装置が採用されるケースが多い。
当院においても血漿を用いGOD電極法でグルコース測定を日常的に行っている。今回グルコース自動分析装置更新にあたり,血漿から全血測定への変更も視野に入れ,血漿測定/全血測定に対応したグルコース分析装置の性能比較を実施したので報告する。
検討装置はアダムスグルコースGA-1172(GOD固定化酵素膜と過酸化水素電極によるアンペロメトリー法:アークレイ株式会社,以下GA-1172)およびGA09II(GOD固定化酵素膜電極法:株式会社エーアンドティー),比較対象装置はGA08II(GOD固定化酵素膜電極法:株式会社エーアンドティー)とし,各装置専用の標準液,緩衝液,洗浄液を使用した。また他測定法として生化学自動分析装置:JCA-BM6070(日本電子株式会社)と測定試薬(クイックオートネオGLU-HK,HK-G-6-PDH法:株式会社シノテスト)を比較対象とした。
2) 試料市販管理試料としてQAPトロール1X・2X Lot.119・229(シスメックス株式会社)を使用した。患者検体は当院受診患者でグルコース測定を目的として提出された残余血糖測定用検体(n = 98)を用い,血漿検体にする場合は2,070 × g・5分間の遠心操作を行った。プール血漿を作製する場合は,冷蔵下で必要とする量まで検体を蓄え,その後300 μLずつに小分けし−80℃で凍結した。プール血漿濃度は90 mg/dL~100 mg/dL,200 mg/dL~300 mg/dLとなるように調整した。また当院職員より公募した健常人ボランティア(n = 8)採血検体もプール血漿として使用した。
3) 採取採血管にはフッ化Na-3 mg・EDTA2Na-6 mgが含有された血糖検査用バキュティナ採血管およびEDTA2K-3.6 mgが含有された血球計数検査用バキュティナ採血管(日本ベクトン・ディッキンソン株式会社)を使用した。
4) 倫理本研究はJA愛知厚生連安城更生病院倫理審査委員会にて承認されている(承認番号:R18-018)。またアークレイマーケティング株式会社・株式会社エーアンドティーとの共同研究契約を締結し実施した。
5) 統計解析日本臨床化学会・定量測定法のバリデーション算出用プログラム(Validation-Support Ver. 3.5)およびStat Flex Ver. 6.0を使用した。
2. 方法 1) 正確性GA-1172はグルコース用内部標準液,GA09IIはグルコース標準液を試料とし,血漿測定モードで連続10回測定した。
2) 併行精度QAPトロール(1X・2X),患者残余血糖測定用検体より作成したプール血漿(血漿測定モード),健常人ボランティア(n = 1)採血検体(全血測定モード)を各23回連続測定した。全血測定はヘマトクリット(以下Ht)値を一定に保つため,測定直前に転倒混和を行った。
3) 室内再現精度QAPトロール(1X・2X),プール血漿を1日2回14日間連続測定した。測定試料は凍結状態で保管されたものを常温に戻し測定した。
4) 希釈直線性高濃度グルコース水溶液(1,000 mg/dLおよび5,000 mg/dL)を生理食塩液(大塚製薬株式会社)で10段階希釈したものを試料とし,血漿測定モード(ノーマル測定モード・ハイレンジ測定モード)で連続3回測定した。
5) 日内安定性健常人ボランティア(n = 4)より血糖検査用採血管を2本採血し,採血後速やかに転倒混和し血漿および全血測定用とした(グルコース濃度:95 mg/dL)。血漿測定用は遠心操作を行い試料とした。採血直後の測定を0分とし,室温静置30分~180分の30分毎のグルコース値を測定した。4名の測定値より経過時間の平均値および採血直後0分値からの変化率を求めた。
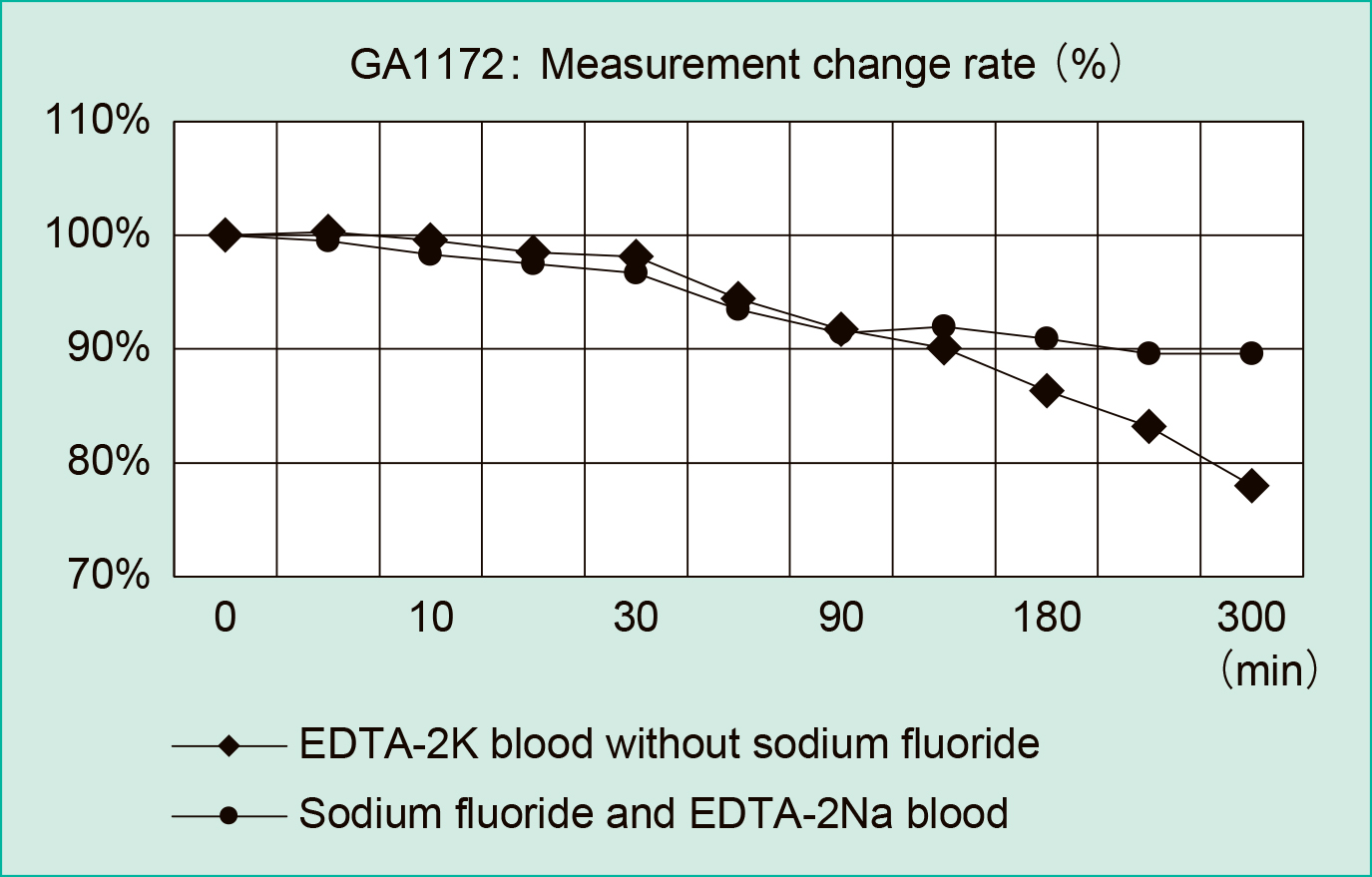
6) 日内安定性(フッ化Na含有と非含有検体比較)血球計数検査用採血管を用いてグルコース検査が実施可能か検証した。健常人ボランティア(n = 2)より血球計数検査用検体および血糖検査用検体を各3本採血し,採血後速やかに転倒混和した。そして採血直後の測定を0分として,室温静置5分~300分の全血グルコース値を測定した。経過時間毎の平均値および採血直後0分値からの変化率を求めた。測定はGA-1172のみで実施した。
7) 相関性患者残余血糖測定用検体(n = 66)を用い,GA-1172(血漿および全血),GA09II(血漿および全血),GA08II(血漿),HK法(血漿)の6パターンで同一検体を測定し相関性を確認した。全血検体は当日採取したものを使用し,血漿検体は全血検体を測定直後に遠心操作し測定した。
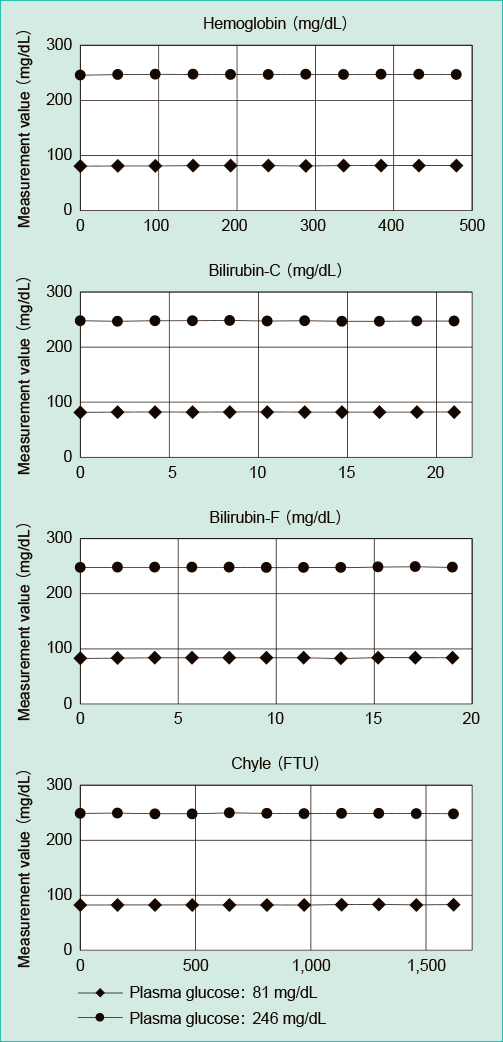
8) 共存物質の影響2濃度のプール血漿を試料とし,干渉チェックAプラス(シスメックス株式会社)を用い溶血ヘモグロビン・ビリルビンC・ビリルビンF・乳びの共存が測定値へ及ぼす影響について確認した。試料に干渉物質を添加後,11段階の希釈系列(溶血ヘモグロビン:0 mg/dL~480 mg/dL,ビリルビンC:0 mg/dL~21 mg/dL,ビリルビンF:0 mg/dL~19 mg/dL,乳び:0 FTU~1,620 FTU)を調整し連続3回測定した。未添加試料を基準とし相対的な変化率を算出した。
9) キャリーオーバーの影響患者残余検体を用い血漿/全血でのサンプルプローブからのキャリーオーバーを評価した。低濃度検体(L),高濃度検体(H)の各検体をH→H→L→Lの順に並べ,これを1バッチとして5バッチ連続測定した。低濃度→高濃度のPercentage carry over: P1および高濃度→低濃度のPercentage carry over: P2からキャリーオーバー率を算出した。
10) Htの影響健常人ボランティア(n = 1)より血糖検査用採血管を採血し,血球と血漿成分に分離後,人為的に混合比率を変えてHt値0%~65%の5段階試料を調整した。高濃度試料はグルコース水溶液を添加し濃度調整した。各試料を全血モードで3重測定し平均値を求め,血漿グルコース(Ht: 0%)測定値を100%とした時の相対的変化率を求め評価した。Ht値測定には多項目自動血球分析装置XE-5000(シスメックス株式会社)を用いた。
11) 再検査率の変化全血測定モードの測定上限はGA-1172/GA09II:500 mg/dL,血漿測定モード(ノーマル測定モード)はGA-1172:1,000 mg/dL,GA09II:900 mg/dLである。全血測定モード上限を500 mg/dL,血漿測定用モード上限を900 mg/dLと仮定し,2017年度の当院グルコース検査測定データを用い,①全診療科データ,②内分泌糖尿病内科データのみの2種類についてヒストグラムを作成し,血漿測定を全血測定へ変更した場合の再検査率の変化を算出した。
12) 血漿検体/全血検体測定の業務効率化の比較当院では血漿測定に5分間の遠心操作を行っているが,全血測定へ変更した場合これらの作業が不要となり測定作業の迅速化・効率化が期待できる。今回グルコース検体1日当たりの遠心操作回数をカウントし,遠心操作が不要になった際の効率化について試算した。
正確性の検証結果をTable 1に示す。Δm(平均値と認証値の絶対値差)はGA-1172:0.20 mg/dL,GA09II:0.50 mg/dLであった。
| GA-1172 Inside for glucose standard solution STD-Hi |
GA09II Glucose standard solution |
|
|---|---|---|
| Certified value | 150.00 | 200.00 |
| Mean (mg/dL) | 150.20 | 199.50 |
| SD (mg/dL) | 0.63 | 0.85 |
| CV (%) | 0.42 | 0.43 |
| Δm | 0.20 | 0.50 |
Δm: Absolute value difference between average and certified value
併行精度の検証結果をTable 2に示す。CV(%)はGA-1172で0.30%~1.72%,GA09IIで0.36%~1.27%とすべて2.0%未満であった。
| QAP Trol IX | QAP Trol IIX | Pool Plasma (Low) | Pool Plasma (High) | Whole blood | ||
|---|---|---|---|---|---|---|
| GA-1172 | Mean (mg/dL) | 91.91 | 239.30 | 87.57 | 217.35 | 149.17 |
| SD (mg/dL) | 0.95 | 2.01 | 0.59 | 0.65 | 2.57 | |
| CV (%) | 1.03 | 0.84 | 0.67 | 0.30 | 1.72 | |
| GA09II | Mean (mg/dL) | 90.74 | 234.91 | 83.43 | 212.17 | 159.83 |
| SD (mg/dL) | 0.75 | 0.85 | 0.95 | 1.83 | 2.04 | |
| CV (%) | 0.83 | 0.36 | 1.13 | 0.86 | 1.27 | |
室内再現精度の検証結果をTable 3に示す。日内/日間を含んだ総合CV(%)はGA-1172で0.50%~0.92%,GA09IIで0.79%~1.52%であった。
| QAP Trol IX | QAP Trol IIX | Pool Plasma (Low) | Pool Plasma (High) | ||
|---|---|---|---|---|---|
| GA-1172 | Mean (mg/dL) | 92.12 | 241.95 | 87.24 | 217.24 |
| Intraday CV (%) | 0.63 | 0.57 | 0.69 | 0.36 | |
| Days CV (%) | 0.38 | 0.56 | 0.61 | 0.35 | |
| Overall CV (%) | 0.73 | 0.79 | 0.92 | 0.50 | |
| GA09II | Mean (mg/dL) | 90.12 | 240.29 | 84.64 | 215.38 |
| Intraday CV (%) | 0.95 | 0.79 | 0.87 | 0.80 | |
| Days CV (%) | 0.76 | 0.00 | 1.24 | 0.39 | |
| Overall CV (%) | 1.22 | 0.79 | 1.52 | 0.89 | |
1,000 mg/dLグルコース水溶液は1,000 mg/dLまで,5,000 mg/dLグルコース水溶液は5,000 mg/dLまで,両装置とも直線性が確認された(Figure 1)。

採血直後を100%とした時の180分後のグルコース値平均変化率はGA-1172:血漿検体;−1.3%,全血検体;−12.4%,GA09II:血漿検体;−0.3%,全血検体;−10.1%であった(Figure 2)。

採血直後を100%とした時の血球計数検査用全血検体の平均変化率は30分後:−1.9%,60分後:−5.6%,90分後:−8.3%,120分後:−9.9%,300分後:−22.0%であった。血糖検査用全血検体の平均変化率は30分後:−3.3%,60分後:−6.5%,90分後:−8.6%,120分後:−8.0%,300分後:−10.4%であった(Figure 3)。
GA08IIとGA-1172・GA09II(血漿/全血)との相関は,相関係数r = 0.999~1.000,回帰式Y = aX + bはa = 0.976~0.993,b = −0.055~1.981であった。
2) 同一装置による血漿検体と全血検体の比較GA-1172は相関係数r = 1.000,回帰式Y = 0.986X + 2.036,GA09IIは相関係数r = 0.999,回帰式Y = 1.010X + 1.075であった。
3) GOD電極法での血漿検体と全血検体の装置比較GA09II(X)/GA-1172(Y)とした時,血漿検体は相関係数r = 1.000,回帰式Y = 1.007X − 0.870,全血検体は相関係数r = 0.999,回帰式Y = 0.983X + 0.121であった。
4) 他測定法との比較JCA-BM6070にて測定したヘキソキナーゼ(HK)法血漿値(X)とGA-1172,GA09IIの血漿および全血測定値(Y)との相関は,相関係数r = 0.999~1.000,回帰式Y = aX + bはa = 0.972~0.989,b = 0.396~2.426であった(Figure 4)。

1) Comparison with current equipment.
A: GA08II (Plasma) vs. GA-1172 (Plasma), B: GA08II (Plasma) vs. GA-1172 (Whole blood), C: GA08II (Plasma) vs. GA09II (Plasma), D: GA08II (Plasma) vs. GA09II (Whole blood).
2) Comparison in same equipment.
E: GA-1172 (Plasma) vs. GA-1172 (Whole blood)., F: GA09II (Plasma) vs. GA09II (Whole blood).
3) Comparison between GOD electrode method.
G: GA09II (Plasma) vs. GA-1172 (Plasma), H: GA09II (Whole blood) vs. GA-1172 (Whole blood).
4) Comparison with other method.
I: JCA-BM6070; HK method (Plasma) vs. GA-1172 (Plasma), J: JCA-BM6070; HK method (Plasma) vs. GA-1172 (Whole blood), K: JCA-BM6070; HK method (Plasma) vs. GA09II (Plasma), L: JCA-BM6070; HK method (Plasma) vs. GA09II (Whole blood).
溶血ヘモグロビン:480 mg/dL,ビリルビンC:21.0 mg/dL,ビリルビンF :19.0 mg/dL,乳糜:1,620 FTUまで,未添加試料測定値に対しGA-1172は ±1.5%以内,GA09IIは ±1.0%以内の変動であった(Figure 5, 6)。
低濃度検体による高濃度検体へのキャリーオーバー率は,GA-1172で血漿:1.80%,全血:−1.33%,GA09IIでは血漿:−0.67%,全血:−0.40%であった。また高濃度検体による低濃度検体へのキャリーオーバー率は,GA-1172で血漿:−0.65%,全血:0.53%,GA09IIでは血漿:−0.18%,全血:−1.39%であった。
10. Htの影響Ht(%)が調節された全血試料測定時の最大変化率はGA-1172:−8.1%,GA09II:+4.5%であった。GA09IIはHt値56%以上で「Ht補正失敗」のエラーが発生した(Figure 7)。

GA-1172 showed a tendency for glucose level to decrease with increasing hematocrit. GA09II occurred an error of correction failure at hematocrit 56% or more.
測定上限を900 mg/dLから500 mg/dLへ変更した場合の再検査率は,全診療科データ(n = 112,973)では +0.12%(+133件),内分泌糖尿病内科データのみ(n = 14,621)を用いた場合は +0.31%(+46件)であった(Figure 8)。

The increase in the retest rate by measuring whole blood glucose was slight (+0.12% in all medical departments and +0.31% in only diabetes and endocrinology department).
平日3日間のグルコース検体の遠心操作は80回/日であった(遠心機2台併用,担当者1名)。遠心操作前後での作業時間を2分とすると,全血測定で遠心操作が無くなった場合160分/日の作業時間削減が可能であった。
正確性確認では両装置とも認証値に対し高い一致率(99.8%以上)を示し,CV(%)は偏りの指標である正確さの許容誤差限界(BA: Analytical Bias)2.3%以内と良好な正確性を示していた2),3)。併行精度は全試料においてばらつきの少ない結果であったが,全血検体は管理試料/プール血漿よりもやや高いCV(%)を示していた。両装置の全血測定は詳細な測定原理は異なるものの,全血測定値よりHt値を推測し適切なHt補正をかけることで血漿グルコース値へ換算している。そのためHt補正時のばらつきも最終的な測定結果へ影響を与えるため,今回のように全血検体では管理試料やプール血漿よりもCV(%)が高かったと推測される。併行精度・室内再現精度ではグルコースのCVA(%)< 2.9%を満たしており,良好な精密性を有すると評価できた2),3)。
今回,フッ化Na非含有の血球計数検査用全血検体でグルコース検査が実施可能か検証したところ,血糖測定用検体との測定値差は採血後90分までは ±2.0%以内であった。そのため採血直後という限定的状況であれば,血球計数検査用検体での測定値は参考値として臨床報告可能な範囲であると考えられた。しかし解糖阻止剤が含有されていない場合,採血直後に血清および血漿成分に分離し,冷蔵保存した場合ではグルコース値は安定しているとの既報があるが4),全血検体は時間経過に比例し解糖が大きく進行するため5),6),診断や治療に関わるグルコース検査には,解糖阻止剤が含有された検体を用いることが前提と考えられる。
相関性については,装置・試料・測定原理の違いによる測定値乖離は認められず,GA-1172とGA09IIは血漿および全血測定のどちらを選択しても,現在報告しているグルコース値と極めて高い相関を持つ結果報告が可能であった。
共存物質の影響の確認では,未添加試料測定値に対し5%以上の変動で影響ありとしたが,±1.5%以内の変動であり影響を認めなかった。またサンプルプローブによるキャリーオーバーの影響は両装置ともBA:2.3%以内であり,低濃度と高濃度検体を連続測定した際も,臨床上問題とならない結果が得られることが確認された。
全血測定時のHtによる影響を確認したところ,GA09IIはHt値56%以上で「Ht補正失敗」のエラーが発生し,測定値は報告されたが正確な結果が得られなかった。GA-1172は既報の検討データ7)と同様に,今回の検討でもHtの増加に伴い低値傾向を示したが,GA09IIは高値傾向を示した。各装置のHt補正の正確度は,Ht 60%以下の全血検体の血漿換算値と血漿値の乖離幅として,100 mg/dL未満ではGA09II:±7 mg/dL以内,GA-1172:±8 mg/dL以内,100~500 mg/dL以下ではGA09II:±7%以内,GA-1172:±8%以内となっている。今回はHt 60%以下の検体だけでなく,Ht 60%を超える検体においても概ね仕様を満たす結果となった。
両装置ともHt補正機能を有しているが,高Ht検体は全血測定時に影響を受ける場合もあるため注意が必要である。これらの影響は現在の技術水準においても完全に回避することが困難なため,高Htである場合が多い新生児や小児検体では,血漿あるいは血清測定での対応が望ましい。また血球計数検査や血液ガス分析検査など,他法でHtが測定されている場合はその情報を共有し,血漿や血清検体での測定が必要と考える。さらに臨床検査情報システム(laboratory information system; LIS)を活用し,高Ht検体であった場合,グルコース検査結果にエラーやコメントを付加するなど,オペレーターが異常に気付き,対応できる仕組み作りが望ましい。
グルコース検査の測定範囲は装置や測定原理で異なっており,全血の測定上限は血漿より低く設定されていることが多い。測定検体を血漿から全血へ変更した場合は再検率増加が想定されるが,当院検査データを用いた集計では再検査率は+0.31%と微増に留まっていた。日常検査内容の変更に当たっては,臨床医の全血測定への理解,再検査率増加に伴うコスト・作業時間増加などが懸念される。しかし今回の集計ではそれらの影響は極めて小さく,全血測定への変更で不要となる遠心操作作業やturnaround time(TAT)短縮など,検査実施におけるメリットの方が上回ると考えられた8)。
また全血測定への変更は担当者1名の160分/日の遠心操作作業削減が可能であった。これらは時間短縮だけでなく業務負担や遠心機設置台数など,様々な削減に繋げることができる。グルコース検査は緊急検査項目とされていることが多く,24時間体制で実施することが多い。仮に医療機関稼働日を250日/年とすると,断片的ではあるが160分/日 × 250日=666.7時間/年もの時間を生み出すことができる。この時間をどのようにして使うかは施設次第であるが,業務拡大,スタッフへの還元(休日取得の増加),臨床支援の充実など,様々な用途に活用できると考えられる。
今回我々は2機種のグルコース分析装置の性能比較を実施したが,血漿検体および全血検体での測定精度は両装置とも良好であり,どちらを選択しても日常検査に問題がないと評価できた。しかしながら全血測定を行う場合は高Ht検体や時間経過検体など,血漿検体以上に測定値へ影響を及ぼす要素について充分な理解が必要である。グルコース検査は様々な検体で測定可能であり,汎用自動分析装置,GOD電極法自動分析装置など,測定方法も様々であるが,検査を専門領域とする臨床検査技師が各検体や装置の特徴を理解し使い分けることで,グルコース検査精度の担保が可能になると考えられる。
本論文趣旨は第68回日本医学検査学会(2019,山口)にて発表した。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。