2022 年 71 巻 1 号 p. 1-9
2022 年 71 巻 1 号 p. 1-9
テトロドトキシン(TTX)が原因の食中毒は近年においても見られるが,TTXの測定を目的とした臨床検査は実施されていない。そこで,我々はTTXの検出と定量に有用な酵素結合免疫吸着法(ELISA)の構築を試みた。まず,TTXに対する抗体を用いて構築したELISAにより,TTXの希釈系列を測定し,検量線を作成した。その結果から,ELISA構築における測定性に優れた2種類の抗体の組み合わせを決定した。次に各種溶媒で100 μg/mLに調製したTTX試料14本を同時測定した。クエン酸緩衝液で希釈したTTX試料の測定結果はばらつきが少なく,概ね正確な測定が可能であった。一方,尿試料で平均37.36 μg/mLと調製濃度よりも低く,血清試料で平均249.86 μg/mLと高いTTX濃度が算出された。この結果は試料中の共存物質が影響していると思われたため,尿や血清で調製したTTX希釈系列を測定,その結果から検量線を作成し,補正を試みた。その後,TTX試料14本の同時測定の結果は,尿試料では調製TTX濃度に近づいたが,血清試料では平均162.92 μg/mLであり,調製濃度との乖離が見られた。そこで,TTX調製血清を除タンパク処理した試料の測定を試みた結果,平均111.29 μg/mLと改善が認められた。検体の前処理法や測定工程には課題が残るが,本ELISAは生体試料中TTXの測定にある程度有用と思われた。
Even in these days, food poisoning due to tetrodotoxin (TTX) still occurs, but there are no clinical trials of methods to measure TTX concentration. In this study, we attempted to establish a new enzyme-linked immunosorbent assay (ELISA) system for assessing TTX concentration. First, we established six patterns of noncompetitive ELISA to generate calibration curves, and we determined the best two antibodies for measuring TTX concentration. Next, the novel assay system was used for fourteen simultaneous measurements of equivalent TTX concentrations (100 μg/mL) within different matrices (citrate buffer, urine, or serum). Using this ELISA system, we determined the concentration of TTX diluted in citrate buffer with high accuracy and precision. However, the TTX concentration in urine was low (37.36 μg/mL), whereas that in serum was high (249.86 μg/mL). To correct the effect of interfering components in each biological sample, we regenerated calibration curves using serial dilutions of the TTX standard prepared using urine or serum. Then, the TTX concentration in urine was increased (111.86 μg/mL), but that in serum remained high (162.92 μg/mL). Finally, deproteinization treatment increased the TTX concentration in serum (111.29 μg/mL) measured by this new ELISA system. Although this ELISA system still needs further improvement, for measuring the TTX concentration in biological samples, this method would be useful for laboratory medicine to some extent.
フグ科魚類の摂食が原因の食中毒は以前より度々発生が報告されている1)。特に,それらが有するテトロドトキシン(TTX)は強力な神経毒であり,致死性が高く,危険視されている2)。TTXは神経細胞膜のナトリウムチャネルを阻害し,活動電位の伝導を障害することで,中毒症状を引き起こす2),3)。主な症状は,生体各部位におけるしびれや麻痺であり,特に呼吸筋麻痺を生じさせることが生命の危機に繋がる3)。このように,TTXが原因の食中毒は致命的であるため,患者には早急な対応が望まれる。一方で,医療施設において,生体試料中TTXの測定は基本的に実施されていない。このことは,TTX中毒の診断や治療効果の判定を困難にしていると思われる。
検体中のTTXを測定する手法として,以前は高速液体クロマトグラフィー(HPLC)分析が有用とされていた4)。その後,HPLC分析に質量分析法を組み込んだLC/MS,あるいはLC/MS/MSが発達した5)~7)。しかし,現状,これら機器類は一般的な医療施設には導入されておらず,実施が困難と思われる。また,近年はTTXに対する抗体が開発され,それを基にした酵素結合免疫吸着法(ELISA)の製品や研究成果が見られるようになった8),9)。なお,現在報告されているTTXのELISAは,競合法を採用したものが目立つ。ELISAの競合法では,抗体をプレートに固相化し,試料と標識抗原をそこに反応させて,目的物質を検出・定量する10)。一方,我々はTTXを2種類の抗体で挟み込むことで目的物質を捕捉する,非競合法に注目した。競合法に用いる抗体は1種類であるため,2種類の抗体を用いる非競合法の方が特異性に優れ,正確な測定が可能と思われたためである。本研究において,我々はTTXに対する非競合ELISAを構築し,その性能を検証する。
抗体はMouse Anti-Tetrodotoxin monoclonal antibody, clone TTX(CABT-L3089)(フナコシ株式会社,東京),TTX antibody(orb101965)(コスモ・バイオ株式会社,東京),TTX(5E7)antibody(orb7079)(コスモ・バイオ株式会社,東京)を用いた(以降,それぞれAb①,Ab②,Ab③と記載する)。なお,Ab③のみポリクローナル抗体であり,その他はモノクローナル抗体である。実際の検体と同様に扱うため,TTXを溶解する溶媒は健常人の血清試料,Human Serum pool(serum)(コスモ・バイオ株式会社,東京),また,尿試料としてUrine, Single Male Donor, Human(urine)(コスモ・バイオ株式会社,東京)を用いた。抗体のペルオキシダーゼ(HRP)標識は,Peroxidase Labeling Kit-SH(株式会社同仁化学研究所,熊本),抗体希釈液にはBlocking One(ナカライテスク株式会社,京都)を用いた。反応プレートはELISAプレートHタイプ(住友ベークライト株式会社,東京),TTX試薬はテトロドトキシン(フグ由来細胞生物学用)そして各種一般試薬(富士フイルム和光純薬株式会社,東京)を用いた。
2. 方法 1) 抗体のHRP標識ELISAの二次抗体として使用するため,Ab①,Ab②,Ab③をPeroxidase Labeling Kit-SHの手順書に則りHRP標識し11),Ab①-HRP,Ab②-HRPおよびAb③-HRPを調製した。
2) 検体の調製TTX中毒の患者検体を入手することは困難であるため,3つの溶媒,①buffer試料(100 mMクエン酸緩衝液pH 3.0),②urine試料および③serum試料にTTX試薬を溶解したものを各測定試料とした。Figure 6の実験のみ,TTX試薬を溶解したserum試料に除タンパク処理を行ったもの(dp-serum)を測定試料とした。具体的には,serum試料にあらかじめTTXを溶解した試料に,これと等量の10%トリクロロ酢酸を加え,微量高速冷却遠心機KITMAN-T24(株式会社トミー精工,東京)で12,000 rpm,15分間遠心分離後,得られた上清をdp-serum試料とした。
3) ELISAの構築測定試料内に含まれるTTXを一次および二次抗体で挟み込む,非競合法を原理としたELISAの構築を試みた。まず,ELISAプレートの各ウェル(well)に対して,50 mM炭酸-重炭酸緩衝液(pH 9.4)にて2 μg/mLに希釈した一次抗体を100 μL/well入れ,4℃で一晩静置して抗体をプレートにコーティングした。150 mmol/L NaClおよび0.05% Tween 20を含む10 mmol/L PBS pH 7.4(10 mM PBS-T)に調整した洗浄液にて室温で3回洗浄後,10 mmol/L PBS pH 7.4にて10倍希釈したBlocking One(×1/10 Blocking One)を100 μL/well入れ,室温で1時間静置してブロッキングを行った。3回洗浄後,25 mM PBS-Tを100 μL/well入れ,buffer試料,urine試料,serum試料で調製したTTX試料を25 μL/well,それぞれの系列毎に入れて1時間静置し一次抗体に結合させた。その後,洗浄液で3回洗浄を行い,×1/10 Blocking Oneで2 μg/mLに希釈した二次抗体を100 μL/well入れ,1時間静置してTTXに結合させた。その後,洗浄液で3回洗浄し,1 mg/mL o-フェニレンジアミン溶液10 mLに30% H2O2を5 μL滴下した反応液を100 μL/well入れて発色させた。30分後,3 mol/L H2SO4を100 μL/well入れて発色反応を停止させ,490 nmにおける吸光度をiMarkマイクロプレートリーダー(Bio-Rad Laboratories, Inc., USA)で測定した。測定原理の概略はFigure 1で示した。
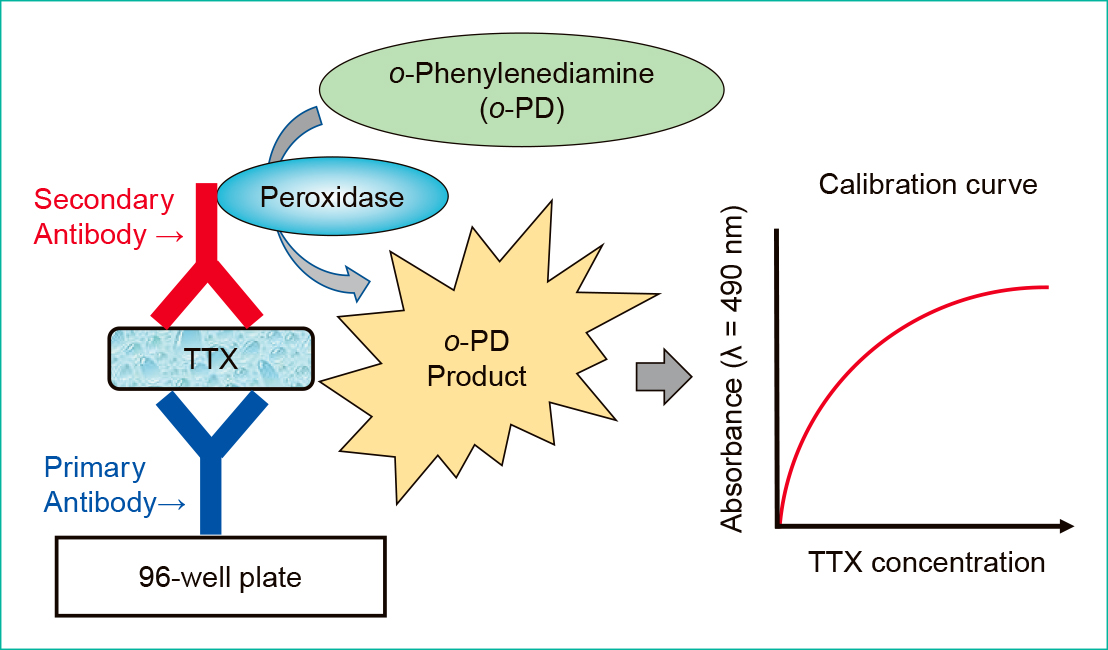
The left illustration shows ELISA design in this study. In this non-competitive ELISA, the relationship between TTX concentration and the absorbance basically indicates sigmoid curve, such as the right graph.
最初に,非競合ELISAの構築に最適な一次および二次抗体の組み合わせを検証した。本実験では,抗体の組み合わせを変え6パターンの非競合ELISAを構築し,buffer試料で調製した15段階のTTX希釈系列(0.061~1,000 μg/mL)を測定した。なお,各測定試料において吸光度の測定値がブランク(TTX濃度が0 μg/mLの試料)のそれを下回る場合は,吸光度0と判定した。さらに,各ELISAの検量線を作成し,吸光度とTTX濃度との相関性を検証した。次に,buffer試料,urine試料およびserum試料といった各種溶媒で100 μg/mLに調製したTTX試料14本を同時測定し,その平均値(Average),標準偏差(SD),変動係数(CV)の値から同時再現性,即ち測定の精密度(ばらつき)を評価した。
また,urine試料およびserum試料で調製したTTX測定試料は7段階の希釈系列(15.63~1,000 μg/mL)を調製した。さらに,dp-serum希釈系列を調製した。それらの測定結果から改めて検量線を作成し,吸光度とTTX濃度との相関性を検証した。これら検量線に基づき,各種溶媒で調整したTTX濃度の換算を行うことで,測定試料内の干渉物質がELISAの発色反応に与える影響の補正を試みた。そのうえで,urine試料およびserum試料で100 μg/mLに調製したTTX試料14本,並びにdp-serum試料14本を同時測定し,精密度を再評価した。
5) 統計解析同時再現性の検証を除く全ての実験は5重測定し,グラフ内ではそのAverage ± SDをプロットした。検量線の作成にあたり,その数式とスピアマンの順位相関係数(R-value)を,ソフトウェアKaleidaGraph(株式会社ヒューリンクス,東京)を用いて算出した。
抗体の組み合わせを変え6パターンのELISAを構築し,TTX希釈系列を測定した。この内,5パターンのELISAでは希釈系列に応じた発色反応を得ることが出来なかったが,一次および二次抗体にそれぞれAb②とAb③-HRPを用いたELISA(Ab②-③ ELISA)のみ,概ねTTX濃度に沿った発色が見られた(Figure 2)。また,Ab②-③ ELISAでは,TTX濃度が3.906 μg/mL以下において,ブランク相当の吸光度を示した。

ELISA assays were carried out using H-type plates, each coated with 2 μg/mL of the candidate primary antibody (Ab①, ② and ③). Per primary antibody type (e.g. Ab①), the remaining two antibody types labeling HRP (e.g. Ab②-HRP and Ab③-HRP) were added as candidate secondary antibodies, followed by HRP-dependent colorimetry. The combinations of primary and secondary antibodies respectively are displayed in each column (A–F). Within each column, lane 1 represents the first eight steps (rows I–VIII) and lane 2 represents the next seven steps (rows I–VII) of 15 two-fold serial dilutions of the TTX standard (0.061–1,000 μg/mL), using buffer as the diluent and blank (0 μg/mL TTX; lane 2, row VIII).
次に,各ELISAにおける検量線を作成した。他のELISA(Figure 3A, B, C, E, F)と比較して,Ab②-③ ELISAにおいて,TTX濃度と吸光度の相関性に優れた良好な検量線を得ることができた(Figure 3D)。

Blank-subtracted absorbance mean ± SD values were plotted against TTX concentration in order to construct calibration curves for each antibody pair (A–F). In each graph, the x-axis indicates TTX concentration and the y-axis indicates absorbance at 490 nm.
以降は全て,Ab②-③ ELISAの性能検証を実施した結果である。まず,buffer試料,urine試料およびserum試料を溶媒として100 μg/mLに希釈したTTX試料14本を同時測定した。結果,buffer調製試料の測定結果は平均92.93 μg/mLとやや低めに算出されたが,ばらつきは小さかった(Figure 4A, D, Table 1)。一方,urine調製試料では全体的に吸光度が低く,平均37.36 μg/mLとなった(Figure 4B, D, Table 1)。また,serum調製試料ではばらつきが大きく,全体的に吸光度も高いため平均濃度は249.86 μg/mLとなった(Figure 4C, D, Table 1)。

The novel assay was used for fourteen simultaneous measurements of equivalent TTX concentrations (100 μg/mL) within different biological matrices. Columns indicate detection of TTX in buffer (A), urine (B) and serum (C). Within each column, lanes 1 and 2 (rows I–VII) represent fourteen replicates (100 μg/mL TTX), while lanes 1 and 2 (row VIII) represent blanks (equal volumes of each solvent). Then, TTX values in each solvent were calculated (D). In the graph, the x-axis indicates biological matrix (buffer: circles, urine: squares and serum: diamonds) and the y-axis indicates measured TTX concentration (μg/mL).
| Solvents (n = 14 each) | |||
|---|---|---|---|
| buffer | urine | serum | |
| Average (μg/mL) | 92.93 | 37.36 | 249.86 |
| SD | 7.97 | 5.33 | 21.27 |
| CV (%) | 8.57 | 14.27 | 8.51 |
次に,urine試料やserum試料を用いて調製したTTX希釈系列の測定結果から,検量線を改めて作成した。結果,urine調製希釈系列では発色が抑制されるものの,相関性に優れた良好な検量線が得られた(Figure 5A, C)。一方,serum調製希釈系列では全体的に強い発色を認め,SDも大きかった(Figure 5B, D)。これら検量線に基づき,urine試料およびserum試料を用いて調製した100 μg/mL TTX試料14本の測定結果を濃度換算した結果,urine試料では平均111.86 μg/mLと実際の値に近づいたが,serum試料では平均162.92 μg/mLとやや高い値であった(Figure 5E, Table 2)。

To adjust for interfering substances present in urine and serum, new calibration curves were constructed for urine (A) and serum (B), based on seven serial two-fold dilutions of TTX (15.63–1,000 μg/mL; rows I–VII), using each biological matrix type as the diluent. Equal volumes of each diluent were used as blanks (row VIII). Resultant calibration curves for urine and serum are provided in panels C and D, respectively. Blank-subtracted absorbance mean ± SD values were plotted. In these graphs, the x-axis indicates TTX concentration and the y-axis indicates absorbance at 490 nm. Reproducibility of TTX quantification in urine and serum was re-evaluated using the new calibration curves, via fourteen simultaneous measurements of TTX concentration (100 μg/mL) within these biological matrices (E). In the graph, the x-axis indicates biological matrix (urine: squares, serum: diamonds) and the y-axis indicates TTX concentration (μg/mL).
| Solvents (n = 14 each) | ||
|---|---|---|
| Urine | Serum | |
| Average (μg/mL) | 111.86 | 162.92 |
| SD | 16.28 | 23.51 |
| CV (%) | 14.55 | 14.43 |
次に,dp-serum試料を用いて,検量線の作成と同時再現性の検証を試みた。結果,概ねTTX濃度に応じた吸光度が得られ,その値を基に検量線の作成が可能であった(Figure 6A, B)。この検量線に基づき,改めて同時再現性を検証したところ,依然ばらつきは認められたが,平均値は111.29 μg/mLと算出され,実際のTTX濃度に近似した値が得られた(Figure 6C, D, Table 3)。

To avoid the effect of proteins in serum, new calibration curve was constructed using dp-serum as samples. Panel A: Based on seven serial two-fold dilutions of TTX (15.63–1,000 μg/mL; rows I–VII). Equal volumes of dp-serum (not including TTX) was used as blanks (row VIII). Panel B: Resultant calibration curves using dp-serum samples are provided. Blank-subtracted absorbance mean ± SD values were plotted. In the graph, the x-axis indicates TTX concentration and the y-axis indicates absorbance at 490 nm. Panel C: Reproducibility of TTX quantification in dp-serum samples was evaluated using the new calibration curve, via fourteen simultaneous measurements of TTX concentration (100 μg/mL). Within each column, lanes 1 and 2 (rows I–VII) represent fourteen replicates (100 μg/mL TTX), while lanes 1 and 2 (row VIII) represent blanks (equal volumes of dp-serum). Panel D: the TTX values (μg/mL) in dp-serum were calculated.
| Solvents (n = 14 each) | |
|---|---|
| dp-serum | |
| Average (μg/mL) | 111.29 |
| SD | 9.96 |
| CV (%) | 8.95 |
本研究にて構築した6パターンの抗体の組み合わせによるELISAの内,実際に使用可能と考えられたものはAb②-③ ELISAのみに留まった(Figure 2, 3)。非競合ELISAでは,2種類の抗体が目的物質における別々の抗原決定基に結合する必要がある。TTXの場合,分子量が319と小さいため2),抗原決定基となりうる構造の候補が少ないことが予想される。そのために,既存のTTX測定用ELISAは,1種類の抗体の利用で済む競合法の採用が多いと推測できた8),9)。本研究では,それぞれ別の抗原決定基を認識している抗体はAb②およびAb③が考えられ,この2種類を用いたELISAのみ,TTX濃度に応じた検量線が得られたと考えられる。この場合,最初にモノクローナル抗体であるAb②が試料内のTTXと特異的に反応し,次にポリクローナル抗体であるAb③がTTXに対してより強い抗原抗体反応を示すため,この2種類が非常に有効な組み合わせとして結果に現れたと推測する。この検量線の作成にあたり,TTXをbuffer試料で倍々希釈した検体を測定したところ,濃度が3.906 μg/mL以下において,ブランク相当の吸光度を示した(Figure 2D)。そのため,TTXの最小検出濃度は,希釈系列におけるその1段階上の濃度,7.813 μg/mL程度と予想される。一方,既存のELISAでは,数十ng/mLのTTX濃度も測定可能とされており8),9),これらと比較してAb②-③ ELISAは感度が劣る結果となった。しかし,非競合法を原理とするAb②-③ ELISAではTTXの検出特異性が高いと思われ,この点は既存のELISAよりも優位と考えられた。
次に我々は,Ab②-③ ELISAにおいて,生体試料中TTXの測定を試みた。その際,urine試料で希釈したTTXの測定結果は,HRP反応による発色が抑制された(Figure 4B)。逆に,serum試料で希釈したTTXの測定結果では強い発色が確認された(Figure 4C)。即ち,これら結果を,buffer試料で希釈したTTXの測定結果に基づいて作成した検量線に当てはめると,実際のTTX濃度とは大きく乖離する結果となった。この結果は,urineやserum内の成分が抗原抗体反応を阻害,あるいは抗体に対して非特異的に結合する物質が影響している可能性が考えられた。特に,urineに含まれる尿素はタンパク質変性剤として作用する12)。そのため,urineを測定試料に用いた場合,尿素が抗体を変性させ全体的な吸光度の低下に繋がったと考えられる。また,serumではタンパク質が強く影響し,特に,免疫グロブリンがELISAプレートと疏水性に結合し,これにHRP標識二次抗体が結合することによる偽陽性反応が原因と予想された13)。
なお,これら実際のTTX濃度と測定値の乖離は,それぞれurine試料およびserum試料で調製したTTX希釈系列を用いて検量線を作成することで,ある程度は補正することが可能であった。特に,urine試料に関しては測定値のばらつきは見られるものの,TTX濃度に応じた吸光度が得られた(Figure 5A, C, E, Table 2)。ただし,この時,TTX濃度が15.63 μg/mLではブランク相当の吸光度となったため(Figure 5A, C),TTXの最小検出濃度は31.25 μg/mL程度と予想される。一方,serum試料で調製したTTX希釈系列を用いて補正した場合では,非特異的な発色が目立ち,測定結果のばらつきも大きいため(Figure 5B, D, E, Table 2),さらに工夫が必要と思われた。そこで,serum試料に除タンパク処理を施すことで,ばらつきを抑え,概ねTTX濃度を反映した測定結果を得ることができた(Figure 6, Table 3)。この時,TTX濃度が15.63 μg/mLではブランク相当の吸光度となったため,TTXの最小検出濃度は31.25 μg/mL程度と思われた。ただし,除タンパク処理では10%トリクロロ酢酸を試料に等量加え,遠心分離後の上清を測定試料としていることから,上清に含まれるTTXが実際は約1/2倍に希釈されている。そのため,除タンパク処理を実施するとTTXの検出感度は低下すると考えられた。
なお,非競合ELISAによるurineおよびserum内TTX測定の感度は,臨床検査法として採用するには心許ない数値と思われる。実際,TTXが原因の食中毒患者において,urineおよびserumに含まれるTTXは数十~数百ng/mL程度と報告されている5)~7),14)。そのため,非競合ELISAを用いてTTX中毒患者の生体試料を測定するためには,検体を濃縮する必要があると思われた。また,濃縮操作も含め,検体の前処理法や測定手法,抗体濃度,反応時間などを工夫することで,非競合ELISAの測定性能はさらに向上すると考えている。LC/MS,あるいはLC/MS/MSを利用した測定系では,検体を濃縮する必要なく数十~数百ng/mLのTTX濃度が検出可能であるため,現段階ではAb②-③ ELISAの性能が劣るといわざるを得ない。一方で,1プレートで多数の検体が同時に測定可能であること,極端に高額な装置を必要とせず操作も簡便であること,発色の程度でTTX濃度が分かるため結果の解釈が容易であること,などは非競合ELISAの長所と思われる。さらに,この非競合ELISAはフグ科魚類などの食材からの抽出液を試料とすることで,食品安全検査にも応用が可能と思われた。これまでTTXの測定手段が限られていた中で,本研究において非競合法を原理とするELISAを構築できたことは,今後のTTX検査の発展に有用な成果と考える。今後は,臨床検査法としての実用化に向け,TTX測定用ELISAの感度と特異性を向上させるための最適な測定条件を探求する予定である。まず,検体の前処理法も含めたTTX測定ELISAの手順書を確立したいと考えている。さらに,TTXに対するイムノクロマト法の構築にも着手し,より迅速かつ簡便なTTX測定法の開発を目指したい。
本研究において構築したAb②-③ ELISAは生体試料中TTXの測定が可能であるが,主として感度に課題が残る。現段階で非競合ELISAは,検査法としてある程度有用という評価に留まるが,検体の調製法や測定条件の改善を図ることで,将来的な実用化が期待される。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。
本研究は,厚生労働科学研究費補助金「食品の安全確保推進研究事業」21KA3007の助成を受け実施した。