2022 年 71 巻 4 号 p. 644-650
2022 年 71 巻 4 号 p. 644-650
近年,体液中でタンパク質や核酸を内包する小胞であるエクソソームが注目され,エクソソーム中のタンパク質,RNAから疾患診断のバイオマーカーが見いだされる期待が高まっている。それに伴い,血液中のエクソソームを抽出する試薬が開発されているが,その抽出効率について統一された結論は出ておらず,超遠心法が依然として信頼性高いという現状である。超遠心法は,設備の準備と技術の習得に高いハードルがあり,効率的なエクソソーム研究と臨床応用には不向きであり,市販の試薬での安定したエクソソームの抽出が期待される。本研究では,血液中のエクソソームからタンパク,mi-RNAで良好な抽出報告のあるExoRNeasy(QIAGEN社)と,新たに開発されたPlasma/Serum Exosome Purification Kit(NORGEN社)2種類の試薬について,血漿からエクソソーム中のmRNAの抽出効率の評価を行った。方法は健常人血漿を対象に,RNA定量と,エクソソームマーカーCD9によるRT-qPCR法を実施した。RNA定量値,CD9のRT-qPCR共通して,ExoRNeasyによる抽出したmRNAで良好な結果が確認され,本研究で市販の試薬を用いてエクソソーム中のmRNAの安定した抽出の確認がされた。この成果を基に,新たなバイオマーカーの確立の研究および,臨床応用につなげていきたいと考えている。
Exosomes, which are released by cells in body fluids such as serum and plasma, are nanovesicles containing RNAs and proteins. In recent years, RNAs or proteins within exosomes have attracted considerable attention because they serve as potential diagnostic biomarkers, especially in cancer. In addition, reagents for extracting exosomes from serum and/or plasma have been developed worldwide, but no definite conclusion on their extraction efficiency has been reached. At present, the conventional ultracentrifugation method still remains more reliable than methods using commercial extraction reagents. However, there are many problems associated with ultracentrifugation, such as the need to prepare the equipment and acquire operation skills, making it unsuitable for efficient exosome research and clinical applications. Thus, we are awaiting a reliable method for extracting exosomes using commercially available reagents. In this study, we compared two different commercial kits, ExoRNeasy (QIAGEN), which has been reported to have a high extraction efficiency in the analysis of proteins and mi-RNA, and the newly developed Plasma/Serum Exosome Purification Kit (NORGEN), which has not yet been analyzed elsewhere. An evaluation assay using healthy human plasma was performed by RNA determination and RT-qPCR analysis of the exosome marker CD9. For both RNA quantification and RT-qPCR analysis of CD9, we obtained reliable mRNA extraction results using ExoRNeasy. Thus, we confirmed the reliable extraction of mRNA in exosomes using commercially available reagents. On the basis of these results, we consider that we should proceed with our research on the establishment of novel biomarkers and clinical applications of these kits.
近年,医学研究においてタンパク質や核酸などを内包する膜小胞であるエクソソームが,それを産生する細胞の分子情報が含まれている1),2)ことから,疾患組織由来の血液中のエクソソーム中に存在するRNAあるいはタンパク質を解析するリキッドバイオプシーが注目され,新たな疾患診断方法,治療方法の開発につながることが期待されている3)。
特にがん診断においては,非常に早期のがん細胞もがん細胞特有のエクソソームを分泌することから3),がんの早期診断に利用できる可能性が高く,早期診断可能なエクソソーム中のバイオマーカーの開発の研究が盛んに行われるようになった4),5)。
エクソソームが注目されるに伴い,エクソソームの抽出方法についても開発が進んでおり,国内外で,体液,血清/血漿,培養細胞上清よりエクソソームを抽出する原理の異なる試薬が多数開発されている。エクソソーム抽出方法の原理で分類すると,CD9などのマーカー抗体によるエクソソームの捕捉,ゲル濾過,ホスファチジルセリンに対するアフィニティ法,フィルター濾過によるスピンカラム,ポリマー沈殿法などである6),7)。しかしながら,それらの試薬の抽出効率について,まだ詳細に検討がされていないため,現状としては,従来からある最も古典的な方法である超遠心機を用いた方法が最も信頼性が高いと考えられている7)。しかし超遠心機自体が高価で,簡単に購入できるものではなく,また研究業界全体でみれば,超遠心機はかつてほど需要がなくなってきているため,超遠心機を保持している研究室は少なくなりつつある。また超遠心機を用いた方法は熟練した技術と,手間と時間が必要なことがあり,エクソソームの研究のハードルをあげていることが現状として問題となっている。
我々は,臨床検査分野の研究として,早期診断可能な腫瘍マーカーの発見を目指した研究を行っている。現在の解析技術では,RT-qPCRの普及により,微量なバイオマーカーをより初期の段階で検出するには,タンパクよりもRNAでの解析・検出のほうが,より感度が高いと考えられる。
このような観点から,現在市販されている血清/血漿からエクソソームを回収し,そのエクソソームからRNAを抽出する試薬について,特にmRNAを抽出するのに適している試薬の検討を行った。現在はエクソソーム調整試薬として製品化されている試薬は10種類以上,さらにその先のエクソソームからRNAを抽出する試薬についても数社の製品が販売されているため,組み合わせとしてかなりの数が考えられる。そのうちから海外の研究グループがタンパク,miRNAを指標に評価を行い,抽出効率が良いとされている,QIAGEN社のExoRNeasyと8),血漿からExoRNAまで,1社の製品で抽出することが可能な,NORGEN社のPlasma/Serum Exosome Purification Kitについてエクソソーム中のmRNA(ExoRNA)の比較・検討を行った。現在のところ,血漿からExoRNAの抽出について,エクソソームマーカーCD9のmRNAの解析を報告しているのは本研究が国内外でも初めての報告となる。
ExoRNeasy Serum/Plasma Midi kit(以下,ExoRNeasy)(Qiagen, Hilden, Germany)(n = 12),およびPlasma/Serum Exosome Purification Midi Kit(以下,PEP)(NORGEN, Canada)(n = 8)2種類の抽出試薬について,メーカーの添付書に沿って,健常人の血漿からエクソソームを抽出し,さらにエクソソームからRNAの抽出を行った。
2. RNA定量RNAの定量は,BioSpec-nano(島津製作所)にて行った。
3. エクソソームマーカーCD9によるRT-qPCR法 1) ポジティブコントロールのRNA作製CD9は血球中に高発現していることから,ポジティブコントロールとして,健常人血球由来のRNAを抽出した。Quick-RNA Whole Blood(ZYMO Research, Irvine, CA, USA)にて,メーカーの添付書に沿って,全血からRNAの抽出を行った。
2) プライマーの確認qPCRは,Primer BLASTでCD9のプライマーの検索を行い,(CD9-1 forward: 5'-ATG CCG GTC AAA GGA GGC A-3', CD9-1 reverse: 5'-AGC AGT TCA ACG CAT AFT GGA-3')のプライマーを使用した。CFSオプティカルモジュール搭載システムMiniOptionリアルタイムPCRシステム(Bio-Rad社)にて,qPCR反応を行い,CD9が高発現している血球より抽出したmRNAをポジティブコントロール,Nucleotide Free waterをネガティブコントロールとしてRT-qPCRを実施した。ポジティブコントロールで,予想されるPCR産物の457bpに相当する88℃付近でmelting peakの確認,ネガティブコントロールで,PCR反応がないことを確認した。
3) cDNA合成抽出したRNAからiScript Advanced cDNA Synthesis Kit for RT-qPCR(Bio-rad, Hercules, CA, USA)にて,cDNA合成を行った。
4) CD9によるRT-qPCRCD9によるRT-qPCRの実施には,SsoAdvanced Unversal SYBR Green Supermix(Bio-rad)を使用した。定量化には,プライマー検討の際,ポジティブコントロールで生成したPCR産物よりTA PCR Cloning kit(Bio Dynamics Laboratory)を使用してプラスミドを作製し,このプラスミドで検量線を作製した9)。
5) 統計学的解析統計学的解析はSPSSを用いて対応のないt検定をった。
2社の試薬で抽出したRNAの回収量について,ExoRNeasyは1回の抽出工程で血漿1 mLを使用,PEPは血漿4 mL使用するので,最終的に回収されたRNAを血漿1 mLあたりの回収量で比較を行った。ExoRNeasyは200.1 ± 78.1 ng/mL plasma(n = 12),PEPは57.9 ± 10.1 ng/mL plasma(n = 8)であった。t検定で統計処理を行い,ExoRNeasyが有意に高い回収率であることが確認された(p < 0.05; Figure 1)。
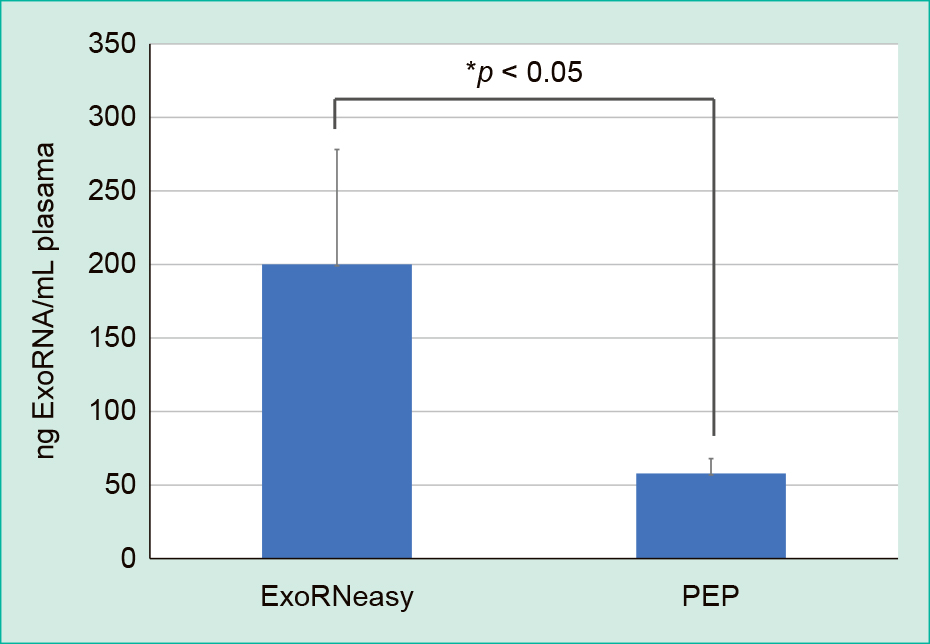
血漿1 mLあたりのExoRNAの回収量は,ExoRNeasyが有意に高い回収率であった。(ExoRNeasy; n = 12, PEP; n = 8)
OD260/280による純度の解析は,ExoRNeasyが1.75 ± 0.21,PEPが1.43 ± 0.32であった。純度においても,QIAGEN社の試薬がより良好な結果となった。
2. CD9によるRT-qPCRの結果CD9についてのRT-qPCRを行った結果,Melting PeakをFigure 2,Melting CurveをFigure 3に示す。ExoRNAeasyより抽出したRNAは,すべてのサンプルでスタンダードと同じ曲温度でMelting Peakを示した(n = 12)が,PEPにより抽出したRNAでは,Stdと一致したMelting Peakのサンプルは1例もなかった(n = 8)。

CD9のRT-pPCRを行った結果は,ポジティブコントロールで作製したプラスミドによるStandardのMelt PeakとExo RNeasyより抽出したRNAのMelt Peakが全て一致したことから,ExoRNeasyによって抽出したRNAからは,Exosome経由して抽出されたものであることが確認された(n = 12)。
PEPから抽出したRNAのMelt PeakはStandardのMelt Peakと一致したものは確認できなかった(n = 8)。

Melt Peakと同様に,Melt Curveの結果も,ポジティブコントロールで作製したプラスミドによるStandardのMelt CurveとExo RNeasyより抽出したRNAのMelt Curveが一致したことから,ExoRNeasyによって抽出したRNAからは,Exosome経由して抽出されたものであることが確認された(n = 12)。
PCR増幅曲線をFigure 4に示す。ExoRNeasyで測定したサンプルの,プラスミドの検量線より求められたExoRNA 1 μLあたりの平均コピー数は,5.473 × 106 copyであった(n = 12)。PEPは,melting peakが一致する増幅が得られなかったため,コピー数は確認できないと判断した。

Standardのプラスミドはcopy数674のStandardを1として,101,102,103,104,105,106倍の濃度のプラスミドを作製し検量線を作製した。cDNA作成に使用したRNA(20 ng)からRNA 1 μgあたりのコピー数を算出した結果,ExoRNAeasyより抽出したExoRNA 1 μgあたりの平均コピー数は,5.473 × 106copyであった(n = 12)。PEPから抽出したExoRNAは,Melt Peakの結果が一致していなかったことから,copy数は確認することができなかった。
我々は,血清・血漿から,早期診断可能な腫瘍マーカーを探索することを,研究目標にしている。本研究ではまずその第1段階として,最も効率よく血清/血漿からエクソソーム中のmRNAを抽出する試薬の検討を行った。
近年の医学研究においてエクソソームと病態との関連性に注目が集まっている。2007年にエクソソーム中に核酸が内包されていることが明らかになり2),エクソソームによる体液診断,治療法の開発を目指した研究が多く報告されるようになっている。それに伴い,エクソソームの回収・精製するための試薬の開発も目覚ましい。上述したように,市販の試薬の評価が充分にされていないことから,最も古典的な超遠心法が,学術的な信頼が最も高いとされているが,超遠心機を有していない研究室も多いこと,技術的に安定して分離するのに多くの手間がかかるなどの,臨床的にエクソソームの解析を一般に行うためには,信頼性の高いエクソソームを精製できる試薬の同定が期待される。
市販の試薬あるいは超遠心法によりエクソソームを分離し,最終的にmiRNAあるいはタンパクで定量し,抽出効率の比較を行う研究については,すでにいくつかの研究グループから報告されている。
Tangら8)は,超遠心法と5通りの試薬の組み合わせで比較を行っている。血清からエクソソームを抽出する第1段階は超遠心法と2種類の試薬ExoQuick(System Bioscience)およびTEI(Invitrogen, Life Technology, Carlsbad, CA, USA),第2段階のエクソソームからExoRNAの抽出には,5種類のエクソソームからRNAの抽出方法,TRIzol-LS(Ambion, Life Technology, Carlsbad, CA, USA),SeraMir(Sysrem BioSciences),TER(Invitrogen),HLR(Magen, Guanzhou, Cina),miRNeasy(Qiagen, Hilden, Germany),および1つの製品でエクソソームからRNAの抽出まで完結できるExoRNeasy(Qiagen)での比較が報告されている。
評価方法は,CD9などのエクソソームマーカーによるウェスタンブロット,透過型電子顕微鏡による観察とNonoSightによる微粒子量の測定(nanoparticle tracking analysis; NTA),RNA定量,Agilent2100によるRNA分解度評価,およびmiRNAの定量であった。結果を総合すると,ExoRNeasyによる方法が,最もRNA回収量が多く,特に120 nt程度の小さいサイズのRNAが多く回収されたことからmiRNAの解析に関しては最も適しているとのことであった8)。
Maciasら10)は,exoRNeasy,ExoQuick,Exo-spin,ME kit,ExoQuick,plus,Exo-Flowの6種類の試薬について,Nano sightによる微粒子量の測定,CD9などのエクソソームマーカーによるウェスタンブロット,タンパク定量などの評価法で解析をした。上記6種類の試薬中ExoQuick PlusとExoRNeasyで高い抽出効率を確認している。
以上の報告をまとめると,2つの研究グループで,数社の試薬と超遠心法で比較した結果,共通してExoRNeasyが高い抽出効率であることが確認されている。しかしながらどちらの研究グループも,エクソソームマーカーの確認はウェスタンブロットによるタンパク質を対象にした解析であり,Tangら8)のExoRNAを解析結果では,RNAのサイズが120 nt程度の小さなサイズのものが多く検出され,miRNAについての良好な定量結果は示されているが,サイズの大きいmRNAの定量結果については示されていない。
そこで我々は,過去の報告で評価の高かったExoRNeasyについて,腫瘍マーカーの同定につながるexoRNA中のmRNAの解析を行うこととした。また,ExoRNeasyは,血清から,ExoRNAを抽出する過程を単一のメーカーの試薬で完結するので,同様に試薬セットとして,エクソソームの分離からRNAの抽出が可能である,今まで比較解析の報告がされていなかった,PEP;Plasma/Serum Exosome Purification and RNA Isolation Midi Kit(NORGEN, Canada)を比較対象として解析することとした。
nanoによるRNAの定量の結果,血漿1 mLあたりのRNA量は,ExoRNeasyが200.1 ± 78.1 ng/mL plasma(n = 16),PEPは57.9 ± 10.1 ng/mL plasma(n = 8)で,ExoRNeasyが有意に高い回収率であった。OD260/280による純度の解析は,ExoRNeasyが1.75 ± 0.21,PEPが1.43 ± 0.32であった。以上の結果から,PEPと比較して,ExoRNeasyが,単位血漿あたりのRNA回収量,RNA純度共に良好な結果であった。
次に,RT-qPCRによるエクソソームマーカーCD9の定量の結果について考察する。PEPでは血球によるポジティブコントロールと一致するMelt peakと,Melt Curveが得られなかった。これはPEPで抽出したRNAからは,エクソソームマーカーCD9の検出ができなかったことを示し,PEPによって抽出したRNAは血漿中のエクソソームから抽出したRNAではなく,血漿内にフリーに存在するRNAのみを抽出したことが推測される。一方,ExoRNeasyから得られたRNAは,ポジティブコントロールと一致するMelt PeakとMelt Curveが得られ,平均値で5.473 × 106の定量値であった。先に述べたように,血漿1 mLあたりのRNA回収量が,ExRNeasyではPEPと比較して有意に高いことからも,PEPで回収されたRNAは主に血漿中にわずかに存在するRNAであり,エクソソームから回収されたRNAはほとんど存在しないことを裏付ける結果であることが考えられる。また,RNAの純度についても,ExoRNeasyが高い結果が得られていることから,RNAの抽出過程でも,ExoRNeasyは腫瘍マーカーの研究に十分応用可能である試薬であると考えられる。
両試薬のエクソソーム抽出原理は,どちらも各社独自のスピンカラムを用いて行う方法であるが,技術的な詳細な情報は非公開である。ただExoRNeasyでのエクソソーム抽出過程の最後に,QIAzolという独自のフェノールを含む試薬をカラムに入れる操作があり,その過程はPEPの操作にはないことから,QIAzolの投与に抽出効率の違いがある可能性が推測される。
一方ExoRNeasyの他の研究グループとの比較では,本研究での結果では200.1 ± 78.1 ng/mL plasma(n = 16)であり,Tangら8)の報告した589.20 ± 247.26 ng/mL serumに比較して少ない回収量であった。この違いは,試薬のロットによる違い,あるいは供血者による血清に含まれるエクソソームの違いを可能性が考えている。本研究では,同じ供血者の血液で2種類の試薬を比較検討して,複数の実験者によって操作を行い,再現性を確認している。その上で共通した傾向が確認できていることから,本研究における回収量の比較の結果は,妥当なものと判断した。
今回検討した2種類の試薬ではExoRNeasyの方が,はるかに高い効率でエクソソーム由来のRNAが抽出できるという結論に至った。
また,本研究では血漿から市販の試薬で抽出したExoRNAからRT-qPCRでエクソソームマーカーCD9の定量を報告しているが,今までエクソソーム中のmRNA定量の報告は,超遠心法によるものであり5),市販の試薬での抽出を経由して,安定してエクソソームマーカーのmRNA定量の報告は本研究が初めてとなる。超遠心法でのエクソソーム抽出は,臨床応用で行うには煩雑な過程など手間と時間がかかることが障害となっていることから,市販の比較的簡便に使用できる試薬での本研究成果は,今後のExoRNAの診断応用に関して,非常に意義のあることと考える。
今まで報告された研究成果と本研究の結果から,ExoRNeasyは血清からmRNAを目的とした,マーカーの探索研究に有効である可能性が確認された。今後さらにCD63,TSG101など他のエクソソームマーカーでの検証,および血清と血漿の比較や,保存状態の影響など,血液中からより効率よく抽出する条件などの検討を行い,血液中からExoRNAの臨床応用可能な抽出方法の検討を進めていきたい。
血漿からエクソソーム中のmRNAの抽出する方法で,CD9のリアルタイムPCR法にてExoRNeasyが,安定して抽出できることが確認された。今後さらに検証を行い,将来の臨床応用を目指していきたい。
本論文の要旨は,第69回医学検査学会において発表した。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。
本研究は,新潟医療福祉大学 研究奨励金 「基盤形成研究費」の研究助成を受けて実施している。
本研究の実験に協力してくれた,新潟医療福祉大学 医療技術学部 臨床技術学科 卒業生,山田倫生さん,伊藤七海さん,大橋歩実さん,土沼理沙さん,佐々木俊さん,竹部悠希さん,田中智宏さん,長谷川真璃さん,牧野巴菜さん,若林昌都さんに心より感謝します。