α-アマニチン(AMA)は主としてドクツルタケ(AV)等の毒キノコが有する自然毒成分である。我々はAMAの定性法であるMeixner試験の性能を検証した。過去の文献を参照したが,Meixner試験の詳細な手法に関する情報が乏しかった。そこで,我々は本試験の手順書を改めて独自に作製し,これを改良Meixner試験と名付けた。本研究の検体には,AMAを蒸留水(DW),ヒト尿,およびヒト血清にて調製した試料と,キノコの成分抽出試料を用いた。我々の手順書通りに改良Meixner試験を行った結果,DWで調製した200 μg/mLのAMA試料を検体として陽性反応を得ることができた。一方,本試験に使用する塩酸の濃度を下げると検出感度が低下した。DWに加え,尿および血清で調製した200 μg/mL AMA試料を検体としても,同様に陽性反応が得られた。なお,いずれの溶媒でも100 μg/mL未満のAMA濃度では陰性となった。各検体を加熱(100℃,30分)しても,試験結果に影響はなかった。ヘモグロビン成分を添加した血清および尿試料では感度が低下し,200 μg/mL未満のAMAで陰性となった。AVの成分抽出試料5検体のうち,陽性反応が得られたのは3検体であった。本研究において性能を検証した改良Meixner試験は,溶血試料や血尿試料を除き,≥ 100 μg/mL程度のAMA検出感度を発揮することが示された。
α-Amanitin (AMA) is primarily a natural toxin component of poisonous mushrooms such as Amanita virosa (AV). In this study, we examined the performance of the Meixner test to detect AMA in various solvents. Although we referred to previous publications, there was a lack of information about the method of the Meixner test, such as the amount and concentration of each reagent. Therefore, in this study, we developed our own procedure named the modified Meixner test. Samples with AMA were prepared in distilled water (DW), urine, and serum. In addition, mushroom component extraction samples were also obtained. As a result of the modified Meixner test performed according to our procedure, a positive reaction was observed in samples with 200 μg/mL AMA in DW. On the other hand, the detection sensitivity decreased when the concentration of hydrochloric acid used in this study was lowered. Positive reactions were also obtained in samples with 200 μg/mL AMA in urine and serum, whereas AMA at concentrations of less than 100 μg/mL was negative in all solvents. Boiling (100°C, 30 min) of each sample did not affect the test results. The sensitivity was decreased in samples prepared in serum and urine to which hemoglobin was added, and AMA at concentrations of less than 200 μg/mL indicated a negative reaction. Three out of five samples with AMA extracted from AV showed a positive reaction with this test. The modified Meixner test showed an AMA detection sensitivity of ≥100 μg/mL, except for hemolytic and hematuria samples.
α-アマニチン(AMA)とは,アマトキシン群の一種であり,テングタケ科の毒キノコが保有する自然毒成分である1)。中でもドクツルタケ(Amanita. virosa; AV)の摂食に伴うAMA食中毒の報告が多く,患者は消化器症状(腹痛,下痢)に加え,高度の肝および腎機能障害に苦しむことになる2),3)。そのため,AMA食中毒の患者には医療現場における早期の対応が望まれる。一方で,現状,生体試料(血清や尿)におけるAMA検出を目的とした検査法の構築に関する報告は乏しい。
Meixner試験は,古くからキノコの成分抽出液中AMAの検出に採用されている。本試験は,リグニンを含む試験紙(新聞紙や電話帳など)に液体試料を滴下し,そこに塩酸を反応させることで判定が可能である1)。試料内にAMAが存在する場合,それが塩酸と反応してインドール様物質が生じることで,滴下部分が青色に呈色する1),4)。一方で,Meixner試験の操作手順に関しては,過去の文献にも曖昧な記述が目立つ。例として,塩酸の濃度や滴下量,試料および塩酸を滴下してからの反応時間などの詳細は記述されていない1),4),5)。何よりMeixner試験に関する論文自体がほとんど存在せず,高速液体クロマトグラフィー(HPLC)分析や,それに質量分析法を組み込んだLC-MSによるAMA検出の報告が目立つ印象である6)~8)。我々も以前,HPLC分析を用いて生体試料にて調製したAMA試料の測定に挑戦した。結果,HPLC分析により,キノコの成分抽出液や血清試料に含まれるAMAの検出と定量が可能であった9)。また,我々は,AMAの検出に有用な酵素結合免疫吸着法(ELISA)を構築し,その性能を評価した。この時,キノコの成分抽出液や尿試料に含まれるAMAを検出および定量することができた10)。しかし,HPLC分析は結果が得られるまでに30分(min)以上を要し9),ELISAに至っては120 minを超えることから10),早期の対応が必要なAMA食中毒患者への適応性は低い。その点,Meixner試験は判定までの時間が15 min程度であり,迅速性において他の手法に勝る。使用する試薬の調製や各種準備も含めるとHPLCやELISAはさらに時間を要するが,Meixner試験はその労力や時間も抑えられている。一方で,従来のMeixner試験ではAMA検出感度が ≥ 200 μg/mLと報告されている1),4)。これまでに報告されたAMA中毒患者の,尿および血清中のAMA濃度は数百ng/mLである11),12)。これらを試料とした時に,従来のMeixner試験ではAMAの検出は不可と考えられる。Meixner試験の検出感度を考慮すると,キノコの成分抽出液中のAMAを正確に検出できるかも疑問である。それらの理由によるものか,Meixner試験の医療現場や食品安全検査における実用性を検証する試みは近年,ほとんど為されていない。以上の背景を基に,我々はMeixner試験の各操作から曖昧さを排除した,標準操作手順書(SOP)を作成することが重要と考えた。確立したSOPに基づくMeixner試験は検出感度の向上が期待され,臨床検査法や食品検査法としての応用にも繋がる。そこで,本研究では,以下3つの目標を設定する。
目標①「蒸留水(DW)にて調製したAMA試料に対してMeixner試験を実施し,その試行を通じて独自のSOPを作成する。」なお,本研究にて作成したSOPに基づく手法は“改良Meixner試験”と名付けた。
目標②「ヒト血清や尿にAMAを加えた試料に対して改良Meixner試験を実施し,得られた結果から臨床検査法としての適応可能性を探る。」
目標③「キノコの成分抽出液を試料として改良Meixner試験を実施し,得られた結果から食品検査法としての応用性を検証する。」
以上,これらの検証を通じて,改良Meixner試験の実用性を探究し,総合的な有用性を考察する。
AMA製剤(商品名:α-アマニチン 細胞生物学用),濃塩酸(12 mol/L HCl),および各種一般試薬(富士フイルム和光純薬株式会社:東京)を用いた。AMA製剤を溶解する溶媒として,市販の健常人血清(商品名:Human Serum pool;以降serumと記載)と健常人尿(商品名:Urine, Single Male Donor, Human;以降urineと記載)(両試料ともコスモ・バイオ株式会社:東京)を用いた。試料の色調変化が試験結果に与える影響を検討するために,干渉チェック・Aプラス(シスメックス株式会社:兵庫)を用いた。また,毒キノコ子実体(6種10サンプル)は,日本きのこセンター菌蕈研究所(鳥取)より採取・同定されたものを供した。当該研究所では,これら子実体の肉眼あるいは顕微鏡的特徴が精査され,原色日本菌類図鑑13)に記載の所見と照合し,種が同定された。内訳は,AVが5サンプル(AV1~5),ヘビキノコモドキ(Amanita. spissacea: OS1),フクロツルタケ(Amanita. volva: OS2),テングタケ(Amanita. pantherine: OS3),コタマゴテングタケ(Amanita. citrina: OS4),およびオオツルタケ(Amanita. cheelii: OS5)が各々1サンプルである。なお,これら毒キノコは,我々が以前に報告した論文内で使用した子実体と同じものであり,AV1~5はAMAを含有し,OS1~5はAMAを有しないことをELISAおよびHPLC分析で確認している9),10)。
2. 方法 1) 試料の調製目標①の検証用試料として,DWにAMA製剤を溶解した試料を作製した。目標②の検証用試料として,serum(pH 7.4)あるいはurine(pH 6.8)にAMA製剤を溶解した試料を患者検体に見立て,実験に供した。目標③の検証用試料として,キノコの成分抽出液を供した。各種キノコは,先行研究で最も毒成分の含有が多く認められた傘(Pileus)の部位を検体に用いた9),10)。具体的には,キノコの傘を約1 g計量後,それを細切れにし,15 mLチューブに入れ−80℃で凍結,それらを解凍後によく絞って遠心分離(12,000 rpm, 15 min)後に得られた上清を抽出液試料とした。
試料は室温(room temperature; RT)に戻してから改良Meixner試験を実施した。試料の加熱によるAMA検出性能の差異を検証する実験に際しては,煮沸させた熱湯に10,20,あるいは30 min,AMA溶解後の試料(チューブ入り)を浸ける操作(boil)を実施した。
また,目標②の精査のため,試料自体の色調による試験結果への影響を検証した。干渉チェック・Aプラス内のビリルビン・F(遊離型)試薬,乳び試薬,あるいは溶血ヘモグロビン試薬をserum試料に添加することで,それぞれ黄疸,乳び,あるいは溶血状態のserumを模した試料を作製した。さらに,同製品内の乳び試薬あるいは溶血ヘモグロビン試薬をurine試料に添加することで,乳び(混濁)尿あるいは血尿を模した試料を作製した。いずれの場合も,serum試料あるいはurine試料が9容に対して,試薬1容の添加量とした。試薬を添加し色調が変化した試料にAMA製剤を溶解し,実験に供した。
試料の種類と調製法を簡略的に図示したものがFigure 1である。

As prepared samples, AMA powder was dissolved in DW, urine, and serum with or without boil (100°C, 30 min). As mushroom samples, each pileus was cut up and frozen at −80°C in 15 mL tubes. After defrosting, they were centrifuged at 3,500 rpm for 10 min, and the extracts were used. In the modified Meixner test, a blue-colored result was judged as a positive reaction, while a colorless result as a negative reaction. AMA, α-amanitin; DW, distilled water; RT, room temperature.
Meixner試験に関する過去の文献を参照し1),4),試行を重ね,以下のSOPを独自に作成した。
1.新聞紙の切れ端(文字や写真が載っていない箇所を選ぶ)に直径2 cmほどの円を鉛筆で描き,その中心に被検試料10 μLを滴下する。
2.別の切れ端には陰性対照として,溶媒のみ(DW,urine,serumなど)を10 μL滴下する。
3.ドライヤーなどを使用し,試料滴下部を完全に乾燥させる。
4.乾燥させた試料滴下部に12N塩酸(原液)を10 μL滴下する。
5.塩酸滴下部の青色呈色変化を陰性対照と比較しながら慎重に観察する。
6.塩酸滴下15 min後に,白色のペーパータオルを背景として(あるいは輸血検査用ビュアー)結果を判定する。2名以上で判定し,一致した結果を採用する。
なお,本研究においては,同一実験を3回繰り返し,再現性を確認した。3回の実験でいずれも同一の反応が得られた場合,そのうち1回分の写真画像を結果として採用した。
DWで調製した200 μg/mLのAMA試料を検体とした場合,改良Meixner試験にて陽性を示す青色呈色が得られた(Figure 2A)。さらに,同濃度かつ10,20,30 min加熱したAMA試料でも陽性反応を認めた(Figure 2B)。また,AMA濃度を200 μg/mL に固定し,Meixner試験に使用する塩酸濃度を原液(12 mol/L)から下げて検証した結果,塩酸濃度が3.0 mol/L以下では陰性となった(Figure 2C)。

In panel A, upper and lower results indicate detection of 200 μg/mL AMA in DW and DW only by the modified Meixner test, respectively. In panel B, the upper three results show the modified Meixner test to 200 μg/mL AMA in DW, boiled for 10, 20, and 30 min, respectively. The bottom result shows the test to DW only as a sample. In panel C, the upper five results indicate the modified Meixner test to 200 μg/mL AMA in DW in case of using 12, 6.0, 3.0, 1.5, 0.75 mol/L hydrochloric acid, respectively. The bottom result shows the test to DW only as a sample. In all photos, positive reaction results are within the blue squares. AMA, α-amanitin; DW, distilled water; RT, room temperature.
DW,urine,およびserumにて調製したAMA試料に対する改良Meixner試験において,AMAの検出可能な濃度は ≥ 100 μg/mLであった(Figure 3A)。また,これら試料に加熱処理を施し,再度改良Mexiner試験を試みたところ,DW試料とurine試料にてAMA濃度が ≥ 100 μg/mLの場合に陽性となった(Figure 3B, left and center lanes)。なお,serum試料は加熱後にゲル化し液体成分がほとんど残らないため,試験不可であった(Figure 3B, right lanes)。

Panel A shows the modified Meixner test results to the samples of six different AMA concentrations (200, 100, 50, 25, 12.5, 0 μg/mL. In order from top to bottom of the photo) diluted in DW (left lane), urine (center lane), and serum (right lane) at RT. Panel B indicates the modified Meixner test results to the same samples in case of boiled state. In all photos, positive reaction results are within the blue squares. AMA, α-amanitin; DW, distilled water; RT, room temperature.
黄疸,乳び,あるいは溶血状態を模したserum試料を作製した(Figure 4A,II 材料および方法を参照)。黄疸および乳びserum試料に対する改良Meixner試験では,AMA濃度が ≥ 100 μg/mLの場合に陽性となった(Figure 4B, center two lanes)。一方,溶血serum試料では,AMA濃度が ≥ 200 μg/mLの場合に陽性となった(Figure 4B, right lanes)。次に,乳び(混濁)状態あるいは血尿を模したurine試料を作製した(Figure 4C,II 材料および方法を参照)。乳び(混濁)状態のurine試料に対する改良Meixner試験では,AMA濃度が ≥ 100 μg/mLの場合に陽性となった(Figure 4D, center lanes)。一方,血尿を模したurine試料では,≥ 200 μg/mLの場合に陽性となった(Figure 4D, right lanes)。

Panel A shows the visual appearance of each serum sample (in order from left to right: normal, jaundice, chyle, and hemolysis serum) used in the experiment. Panel B shows the modified Meixner test results of four different AMA concentrations (200, 100, 50, 0 μg/mL. In order from top to bottom of the photo) diluted in four different color serum shown in panel A. Panel C indicates the visual appearance of each urine sample (in order from left to right: normal, chyluria, hematuria) used in the experiment. Panel D shows the modified Meixner test results of four different AMA concentrations (200, 100, 50, 0 μg/mL. In order from top to bottom of the photo) diluted in three different color urine shown in panel C.
AV試料5サンプル(AV1~5)のうち,陽性と判断できるものは3サンプル(AV1, 3, 5)であり,加熱した試料でも同様の試験結果となった(Figure 5A)。また,AV以外の毒キノコ試料5サンプル(OS1~5)に対する試験は加熱の有無を問わず全て陰性であった(Figure 5B)。
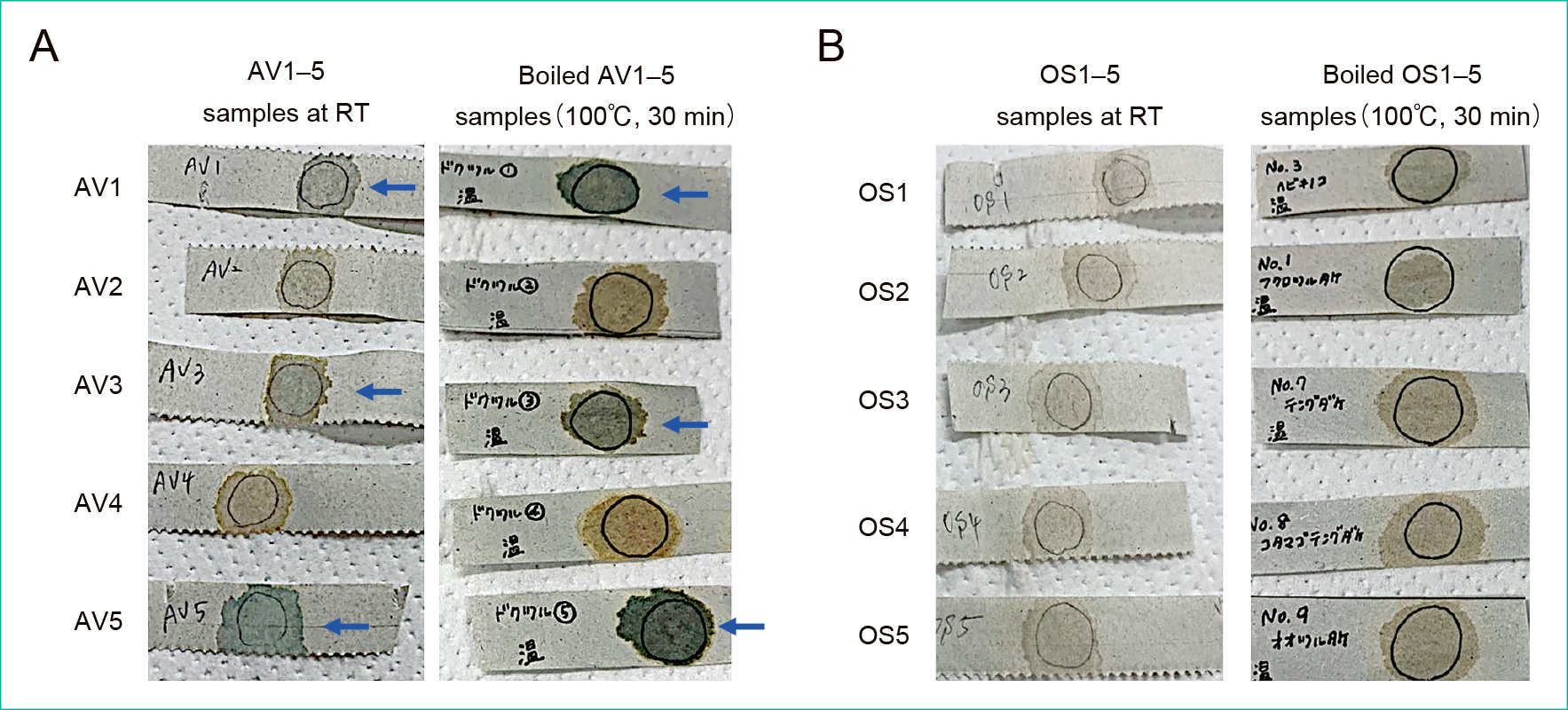
Panel A shows the modified Meixner test results to the AV1-5 samples at RT (left photo) and in case of boiled state (right photo). Panel B indicates those to OS1-5 samples at RT (left photo) and in case of boiled state (right photo). In all photos, positive reaction results are indicated by blue arrows. AV, Amanita virosa; OS, other species mushrooms; RT, room temperature.
毒キノコの摂食が原因の中毒は,本邦の自然毒性食中毒の年間発生件数1位を長期間記録しており,特に危険視されている14)。一方,毒キノコの食中毒は摂食した品種により症状が様々であり,緊急性が大きく分かれる15)。摂食したキノコの種類や毒成分の種類が早期に判明することは,医師による適切な診断と処置に繋がり,ひいては患者の救命に貢献する。そこで,キノコ本体あるいは食中毒患者の生体試料から毒成分を特異的かつ迅速に検出可能な手法が必要と考えた。中でも,AVに含まれるAMAは肝細胞に取り込まれ,そこでRNAポリメラーゼIIを抑制することで生命維持に重要なタンパク質の合成代謝を阻害する16),17)。AMA中毒で搬送される患者は肝性昏睡や多臓器不全から意識混濁に至る場合が多く,その場合,患者からの直接の問診により中毒の原因を推定することは困難と思われる。したがって,数あるキノコの毒成分の中でも,特にAMAを正確に検出する検査法を確立するべきである。特別な技術を必要とせず,医療現場で簡易かつ迅速に実施可能な手法が望ましい。その点に関して,Meixner試験は非常に優れたAMAの検出法と思われた。我々は本研究を通じて,曖昧であった従来のMeixner試験を独自のSOPに基づき刷新,改良Meixner試験として明確に定義した。すなわち,目標①「DWにて調製したAMA試料に対してMeixner試験を実施し,その試行を通じて独自のSOPを作成する。」は達成された。後はAMAの検出性能,即ち医療現場や食品安全検査での有用性が高いかどうかを検証する必要があった。それを実現した本研究は,改良Meixner試験の実用性に対して一定の結論を導き出したと考えている。以降は,改良Meixner試験におけるAMAの検出性能と,長所および短所について考察する。
2. 改良Meixner試験のAMA検出性能過去の文献によると,Meixner試験のAMA検出感度は200 μg/mL程度と記述されていた1),4)。そこで,改良Meixner試験ではまず,200 μg/mLのAMA濃度で陽性反応が得られるか検証した。DWにて調製した200 μg/mL AMA試料は確かに青色を呈した(Figure 2A, upper picture)。これは陰性対照(Figure 2A, lower picture)を試験することで,色調の違いがより明瞭に認識できた。試料の加熱が検出感度に影響を与えることはなかったが,塩酸は原液を使用するのが重要と考えられた(Figure 2B, C)。その他,改良Meixner試験への影響が考えられる要素として,新聞紙の種類の変更や,複数回に渡る試料の凍結融解を試みたが,検出感度には影響がなかった(data not shown)。
臨床現場への改良Meixner試験導入を検討するうえで重要な点は,目標②で挙げた生体試料中からの検出可否である。我々は更なる実験でそれを検証し,従来のMeixner試験とのAMA検出感度を比較した。まず,溶媒がDW,urine,serumいずれの場合でも,検出感度は ≥ 100 μg/mLであった(Figure 3A)。なお,従来の試験ではAMA検出感度が ≥ 200 μg/mLと報告されていたが1),4),改良Meixner試験では ≥ 100 μg/mLと成績が改善した。過去の報告では,血清中のセロトニンなどAMAと共通の分子構造を有する物質が存在する場合にMeixner試験で偽陽性が出る可能性が示されている4)。少なくとも我々の検証では,溶媒の種類による検出感度への影響はなかった。なお,試料の加熱を試みたが,ゲル化により測定できなかったserum試料を除き,検出感度は加熱前と変わらなかった(Figure 3B)。加熱後のurineにおいても判定結果が変わらないことは,AMAが熱や尿中物質の影響を受けにくく,非常に安定した毒成分であることを証明している。
以上の実験結果から,改良Meixner試験による生体試料中AMAの検出感度は,従来のMeixner試験に比べると向上したといえる。一方で,AMA食中毒患者の検査法として検討すると,改良Meixner試験の検出感度はまだまだ乏しい。我々が以前に報告したELISA法ではurine中のAMAを ≥ 15.63 μg/mL,HPLC法ではserum中のAMAを ≥ 22.60 μg/mLの検出感度でそれぞれ測定することができた9),10)。しかし,実際のAMA中毒患者のurineおよびserum中のAMA濃度はいずれも数百 ng/mLと報告されている11),12)。改良Meixner試験を含め,我々が検討したAMA検出法では現状,このAMA濃度の測定は困難である。目標②「ヒト血清や尿にAMAを加えた試料に対して改良Meixner試験を実施し,得られた結果から臨床検査法としての適応可能性を探る」は達成されたが,臨床検査法としては大きな課題を残した。
次に我々は,実際のAVから得られた抽出液中のAMAを,本試験で検出することができるのか精査した。結果,AV5サンプル中,陽性と判定されたのは3サンプルであった(Figure 5A)。AV2とAV4はAMA含有量が少ない個体であったため,改良Meixner試験では検出不可であったと予想する。一方で,AV以外の毒キノコ抽出液試料に対する改良Meixner試験の結果は全て陰性であったことから(Figure 5B),AMA以外の毒キノコ成分により交差反応が生じる可能性は低いと考えられた。目標③「キノコの成分抽出液を試料として改良Meixner試験を実施し,得られた結果から食品検査法としての応用性を検証する。」は達成されたが,やはり検出感度が課題である。高濃度AMAの含有が期待できるキノコ子実体やその調理済み食品,食べ残しからの抽出液試料はMeixner試験の適応対象になりうると思われた。また,胃洗浄後の排出洗浄液を試料とすれば,生体内に吸収される前のAMAを本試験で検出することができるかもしれないと考えた。
以上に述べたように,改良Meixner試験の検出感度は,臨床検査はおろか食品検査としても課題がある。対処法は2点が考えられる。1つはMeixner試験の手法を試行錯誤し,感度の向上を図ること。もう1つはAMAを含む試料を濃縮し,検出可能な濃度に引き上げることである。特に後者が成功すれば改良Meixner試験に関わらず,これまでの測定法にも適応可能であるため,優先的課題としてこれから取り組みたい。
3. 改良Meixner試験の長所と短所本研究を通じて,改良Meixner試験の長所と短所を洗い出すことができた。長所としては,①検査時間が短いこと,②操作が簡単であること,③検出特異性,の3点が挙げられる。試料以外に濃塩酸と新聞紙の切れ端があれば,どのような施設でも短時間で実施可能である。青色呈色が出た場合は試料中AMAの存在が確定的であるため,特異性にも優れるといえる。
短所としては,①検出感度の低さ,②判定結果の曖昧さ,③青色呈色の減衰が早いこと,④定量性能がないこと,の4点が挙げられる。検出感度に起因する問題は先に記述した通りであるため割愛する。本試験はイムノクロマト法のような明瞭なバンドが確認できるわけではなく,主観的な判定にならざるをえない点が短所である。青色呈色の程度は,特に100 μg/mL前後のAMA試料に対する試験では,やや不明瞭である。やはり,陰性対照を立て,結果を並べて見比べる操作は非常に重要と思われた。ヘモグロビンを含むserum試料およびurine試料では結果の判読が難化したことから(Figure 4B, D, right lanes),試料自体の色調も曖昧な結果に繋がる要因である。一方,黄疸や乳び等の色調変化では,結果に大きな影響は認められなかった(Figure 4B, D, lanes other than right ones)。生体試料の色調変化はこれ以外にも様々考えられ,程度の差もあり一概にはいえないが,考慮に入れる必要がある。そして,濃塩酸を滴下してから30 minも経過すると色調が薄れ,判定に苦労する。滴下後は15 minの段階で判定し,写真にも収めておくのが良いと思われた。さらに,本試験には定量性能がなく,AMA食中毒の厳密な重症度判定はできない。診断法としての導入を目指すためには,改良Meixner試験と他方との併用も視野に入れるべきである。例として,改良Meixner試験を用いて生体試料中AMAの存在を確認した後で,LC-MSやELISAなどの定量的分析法によりAMA濃度を測定し,患者の病態を把握するという診断法が考えられる。緊急時にこのような対応は難しいが,生命の危機を脱した患者では特に効果的であろうと予想する。Meixner試験にて生体試料中AMAが陰性化することが最初の治療目標となり,続いて定量的分析法にてAMAが検出されないことが完治の基準となる。このような治療方針のフロー策定に貢献すると思われた。以上,改良Meixner試験の様々な短所を挙げた。今後さらなる検証により,これらを克服することで,本試験は食品検査法だけでなく臨床検査法として応用できる可能性が示された。
本研究において性能を検証した改良Meixner試験は,溶血試料や血尿試料を除き,≥ 100 μg/mLのAMA検出感度を発揮する。本試験は,食品検査法や臨床検査法としての実用性は現状低いが,迅速性ならびに簡易性に優れる。今後,試料の前処理法や測定条件の改善を図ることで本試験をさらに発展させ,実用性を高める必要がある。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。
キノコの子実体を提供頂きました牛島修爾先生(日本きのこセンター菌蕈研究所:鳥取)に,心より感謝申し上げます。本研究は,厚生労働科学研究費補助金「食品の安全確保推進研究事業」21KA3007の助成を受け実施しました。