2023 年 72 巻 3 号 p. 407-412
2023 年 72 巻 3 号 p. 407-412
フローサイトメトリークロスマッチ(flow cytometry crossmatch; FCXM)は腎移植術前の組織適合性検査として広く行われている。しかしFCXMの操作手順・判定基準は標準化されていないため各施設において異なり,Quality Controlも充分とは言えない。今回,当院におけるFCXMの検査精度を検証し,施設間差を是正するため,当院と福岡赤十字病院にて施行した生体腎移植術前44症例のFCXMの判定結果を比較し,結果に乖離を認めた症例についてはその原因を検討した。福岡赤十字病院を基準とした当院のT-cell陽性および陰性一致率はともに100%(44/44)であった。B-cellでは陽性一致率100%(7/7)に対し,陰性一致率は86.5%(32/37)であった。判定に乖離を認めた5症例のうち2症例でドナー特異的抗体(donor specific antibody; DSA)を認めたが,2症例ではnon-DSAのみ,1症例は抗HLA抗体陰性であった。DSAが陰性であった症例では,pronase処理が未実施であったことが偽陽性につながったと考えられた。FCXMの両施設での一致率は比較的良好であったが,pronase処理を実施していないFCXMにおいて,B-cell弱陽性の結果が得られた場合は偽陽性の可能性も考慮し,抗HLA抗体同定検査の結果も併せて評価する必要がある。
Background: Flow Cytometric Crossmatch (FCXM) is widely used as a histocompatibility test before renal transplantation. However, because the procedure and criteria for FCXM are not standardized, the quality control of FCXM is insufficient. Patients and Methods: We compared the FCXM results of 44 preoperative renal transplantation cases performed at our hospital and the Fukuoka Red Cross Hospital to validate the accuracy of FCXM at our hospital and investigate the causes of discrepancies between the results of the two hospitals. Results: The T-cell positive and negative concordance rates were both 100% (44/44) at our institution, whereas the B-cell positive and negative concordance rates were 100% (7/7) and 86.5% (32/37), respectively, as determined on the basis of data from the Fukuoka Red Cross Hospital. Two of the five patients with discrepancies had donor-specific antibodies (DSAs), two had non-DSAs, and one had negative anti-human leukocyte antigen antibodies. In the DSA-negative 3 cases, the lack of pronase treatment may have led to a false-positive result. Conclusion: Even though the concordance rate between FCXMs at both centers was relatively good when a weakly positive B-cell result is obtained in an FCXM without pronase treatment, the possibility of false-positive results should be considered, and the results of anti-human leukocyte antigen antibody identification tests should also be evaluated.
リンパ球クロスマッチは,腎移植におけるレシピエントとドナーの適合性検査の一つとして実施される。ドナーリンパ球を用いたクロスマッチにはリンパ球細胞傷害試験(lymphocyte cytotoxicity-crossmatch test; LCT)や抗ヒトグロブリン(anti-human-immunoglobulin; AHG)を加えたAHG-LCT,フローサイトメーターを使用したフローサイトメトリークロスマッチ(flow cytometry crossmatch; FCXM)等がある。LCTは補体依存性抗体による細胞傷害活性を検出することより,補体依存性細胞傷害(complement dependent cytotoxicity; CDC)試験とも呼ばれている。T-cell LCTが陽性の場合は移植が禁忌となるため,腎移植では欠かせない臨床検査のひとつであるが,ドナーリンパ球のViabilityが細胞傷害活性に影響するため,陽性・陰性の判定に苦慮することもある。加えて,市販のキットが存在しないため,各施設で操作手順が異なる。
一方,FCXMはLCTと比較すると高感度であり,低力価のドナー特異的抗体(donor specific antibody; DSA)や非補体依存性抗体も検出可能であるが,LCT同様,市販のキットが存在しないため,各施設で操作手順が異なる。更にFCXMの施設間差は十分に検討されておらず,現時点では,陽性の判定や移植禁忌の標準的な判定基準は存在していない。
DSA陽性腎移植では抗体関連型拒絶反応を発症するリスクが高く1),術前の脱感作療法を行う必要がある2)。このような免疫学的ハイリスク腎移植を施行するにあたり,迅速に脱感作療法の効果判定を行う必要がある。2015年11月時点で三重大学医学部附属病院(以下,当院)では生体腎移植術前の組織適合性の評価としてHLA Typingのみを院内で実施し,FCXM,抗HLA抗体スクリーニング検査は外注にて施行していたが,FCXMを院内で実施する体制の整備を行うこととなった。2012年に日本移植学会(JST)が暫定案として組織適合性検査プロトコル(標準方法)3)を公開しているが,陽性基準やQuality Controlの方法は各施設に委ねられており,課題のひとつと言える。今回,施設間差の是正を目的とし,FCXMを院内で実施するとともに,外部からの検査依頼を受託している福岡赤十字病院と同時に検査することにより,両施設での検査方法・手順・判定結果を比較検討したので報告する。
2018年2月から2020年5月までに当院および福岡赤十字病院にて腎移植術前検査目的にFCXMを施行した44組のドナーおよびレシピエントを対象とした。レシピエントの年齢(平均 ± SD)は50.3 ± 12歳,男性23名,女性21名,ドナーの年齢(平均 ± SD)は61.7 ± 9歳,男性20名,女性24名であった。レシピエントとドナーの関係性は,夫婦間が23症例(52.3%)と最も多く,ABO血液型の組み合わせは,一致が17症例(38.6%)と最も多かった(Table 1)。
| レシピエント | n = 44 |
|---|---|
| 平均年齢(SD) | 50.3歳(12.2) |
| 性別 | 男性23 女性21 |
| 感作歴 | 件数(%) |
| 移植歴有 | 0(0) |
| 輸血歴有 | 7(15.9) |
| 妊娠歴有 | 14(66.7) |
| ドナー | n = 44 |
| 平均年齢(SD) | 61.7歳(9.3) |
| 性別 | 男性20 女性24 |
| ドナーとの関係性 | 件数(%) |
| 夫婦 | 23(52.3) |
| 親子 | 16(36.4) |
| 兄弟姉妹 | 2(4.5) |
| それ以外 | 3(6.8) |
| ABO血液型 組み合わせ | 件数(%) |
| 一致 | 17(38.6) |
| 不一致 | 23(52.3) |
| 不明 | 4(9.1) |
当院におけるFCXMを三重大法,福岡赤十字病院におけるFCXMを福岡法とした。
1)レシピエント血清,ドナー血清は,全血2 mLを遠心分離後,上清をマイクロチューブに移し替え,−80℃に30 min以上凍結した。使用時に解凍し,三重大法は10,000 g,10 min,福岡法は20,000 g,10 min超遠心後の上清を使用した。
2)ドナーリンパ球は,ACD加全血8.5 mL × 2本準備し,三重大法はSTEMCELL Technologies社のRosetteSepTM & SepMateTM,福岡法はSTEMCELL Technologies社のEasySepTM Direct Human total Lymphocyte isolationkitによりリンパ球を分離した。
3)福岡法のみ2)のリンパ球をpronase(type XIV; Sigma Aldrich St. Louis, Mo, United States)処理した。
4)5 mLのポリスチレンチューブ4本(AB型血清用,ドナー血清用,レシピエント血清用,positive control血清用)にドナーリンパ球を三重大法は約4.0 × 105個,福岡法は4.0~10.0 × 105個になるように添加した。
5)4)にAB型血清,ドナー血清,レシピエント血清,positive control血清を三重大法は各30 μL,福岡法は各30~50 μL,添加した。
6)各チューブを数秒攪拌し,遮光して室温30 min反応させた。
7)三重大法は各チューブを生理食塩液で3回洗浄した(594 g, 5 min)。福岡法は各チューブをBD社Lyse Wash Assitantを使用し,生理食塩液で3回洗浄した(500 g, 10 sec)。
8)各チューブにDAKO希釈液にて50倍に希釈したFITC-conjugated AffiniPure F (ab') 2 Fragment Goat Anti-Human IgG(Jackson Immuno Research社)を三重大法50 μL,福岡法10 μL,PerCP Anti-human CD3(BD Biosciences社)を三重大法10 μL,福岡法5 μL,PE Mouse Anti-Human CD19(BD Biosciences社)を三重大法10 μL,福岡法5 μLを添加した。
9)各チューブを数秒攪拌し,遮光して三重大法は4℃ 30 min,福岡法は4℃ 20 min反応させた。
10)三重大法は各チューブを生理食塩液で2回洗浄した(594 g, 5 min)。福岡法は各チューブをBD社Lyse Wash Assitantを使用し,生理食塩液で3回洗浄した(500 g, 10 sec)。
11)各チューブに生理食塩液を三重大法は300~500 μL,福岡法は350 μL添加し,フローサイトメーター(FACS Canto II:日本ベクトンデッキンソン社)にて測定・解析した(Table 2)。
| 三重大法 | 福岡法 | ||
|---|---|---|---|
| レシピエントおよび ドナー血清の処理 |
血清保存 | −80℃ 30 min以上 | |
| 解凍後処理(超遠心) | 10,000 g 10 min | 20,000 g 10 min | |
| ドナーリンパ球の処理 | リンパ球分離 | RosetteSepTM & SepMateTM | EasySepTM Direct Human Total Lymphocyte Isolation Kit |
| 酵素処理 | ― | pronase処理 | |
| 抗原抗体反応 | 血清量(μL) | 30 | 30~50 |
| 細胞数(個) | 約4.0 × 105 | 4.0~10.0 × 105 | |
| 反応 | 室温(遮光)30 min | ||
| 洗浄 | 594 g 5 min 3回 | 500 g 10 sec 3回 | |
| 標識抗体との反応 | CD3/CD19/IgG-FITC(μL) | 10/10/50(×50) | 5/5/10(×50) |
| 反応 | 4℃(遮光)30 min | 4℃(遮光)20 min | |
| 洗浄 | 594 g 5 min 2回 | 500 g 10 sec 3回 | |
| 測定・解析 | FACS Canto II | ||
FCXMにて陰性コントロール(negative control)血清およびレシピエント血清(sample)を反応させたリンパ球集団(T-cell·B-cell)をgatingし,縦軸count,横軸FITC標識IgGの蛍光強度で示したヒストグラムから中央値を求め,レシピエント血清と陰性コントロール血清の中央値の比とした(Figure 1)。
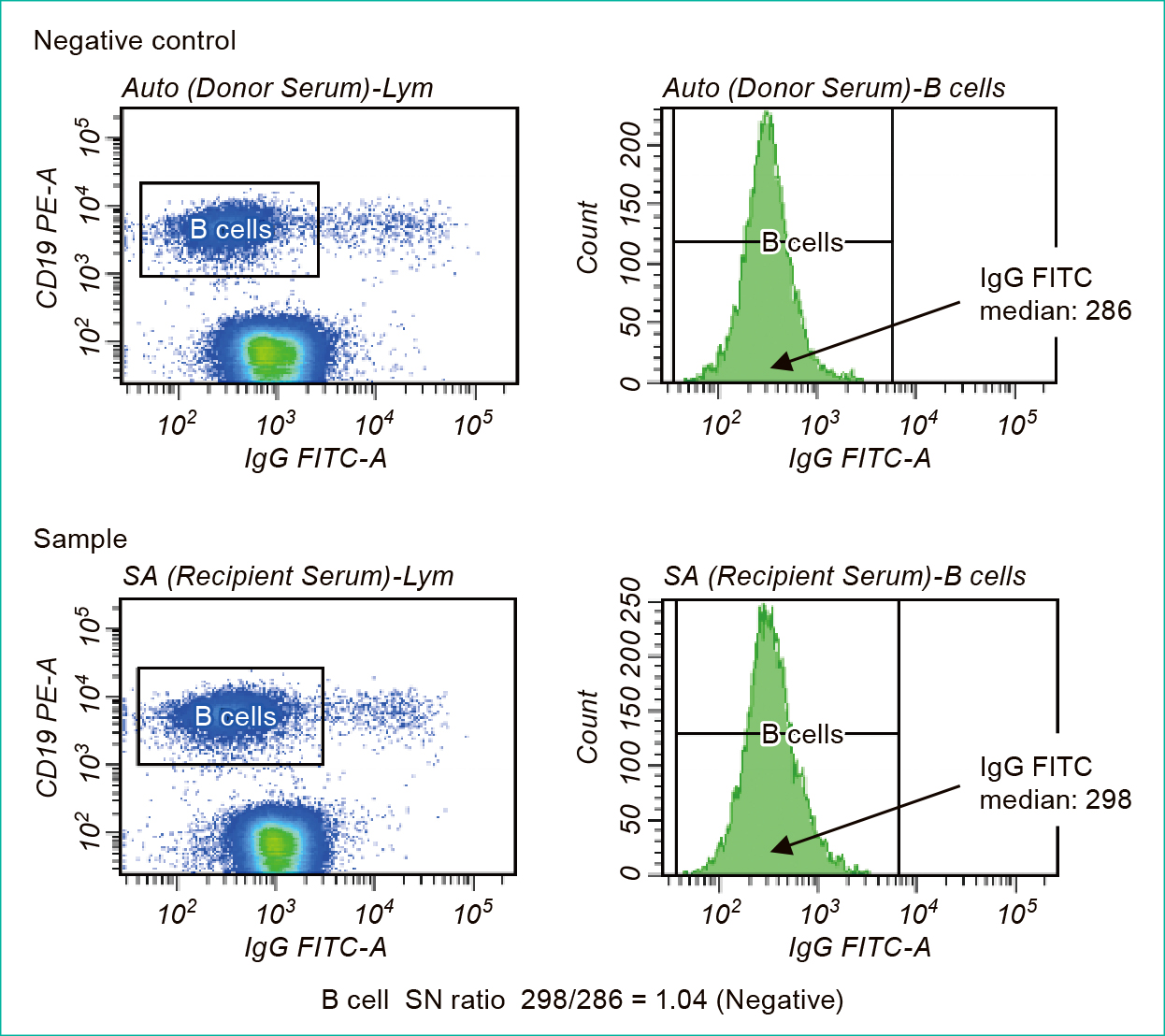
また,陰性コントロール血清はAB型血清(Sigma Aldrich)およびドナー血清を使用した。
4. 判定基準三重大法はSN ratioがT-cell・B-cell共に2.00以上を陽性と判定し,福岡法はSN ratioがT-cell 1.50以上,B-cell 2.00以上を陽性と判定した。
5. 検討方法福岡法を基準とした三重大法の判定結果の陰性一致率・陽性一致率・全体一致率を比較し,乖離症例の原因を検討した。検討に用いた項目は,レシピエント血清および陰性コントロール血清の蛍光強度の比(SN ratio),抗HLA抗体特異性同定検査(One Lambda LABScreen Single Antigen; LSSA)の判定結果とした。DSAが検出された場合,平均蛍光強度(normalized mean fluorescence intensity; nMFI)から原因を考察した。
本検討は世界医師会ヘルシンキ宣言「人を対象とする医学系研究に関する倫理指針」に準拠し,三重大学医学部倫理委員会の承認を得て実施した(承認番号H2022-008)。
福岡法を基準とした場合,T-cellにおける三重大法の陰性一致率・陽性一致率・全体一致率は,全て100%であった(Table 3)。
| 福岡法 | 合計 | ||
|---|---|---|---|
| 三重大法 | 陽性 | 陰性 | |
| 陽性 | 5 | 0 | 5 |
| 陰性 | 0 | 39 | 39 |
| 合計 | 5 | 39 | 44 |
B-cellにおける三重大法の陽性一致率100%(7/7)と高かったが,陰性一致率は86.5%(32/37),全体一致率は88.6%(39/44)であった(Table 4)。
| 福岡法 | 合計 | ||
|---|---|---|---|
| 三重大法 | 陽性 | 陰性 | |
| 陽性 | 7 | 5 | 12 |
| 陰性 | 0 | 32 | 32 |
| 合計 | 7 | 37 | 44 |
B-cellにおいて三重大法陽性・福岡法陰性が5症例あった。5症例における福岡法のSN ratioは0.86~1.95で陰性であったのに対し,三重大法のSN ratioは2.22~3.18と弱陽性であった(Table 5)。
| 症例 | レシピエント | ドナー | 三重大法 | 福岡法 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 年齢 | 性別 | 移植歴 | 輸血歴 | 妊娠歴 | 年齢 | 関係性 | 判定 | SN ratio | 判定 | SN ratio | |
| 1 | 61 | F | 無 | 無 | 有 | 61 | 夫 | + | 2.23 | − | 0.86 |
| 2 | 39 | F | 無 | 無 | 無 | 37 | 妹 | + | 2.68 | − | 1.16 |
| 3 | 60 | F | 無 | 無 | 有 | 63 | 夫 | + | 2.29 | − | 1.26 |
| 4 | 43 | M | 無 | 有 | 無 | 42 | 妻 | + | 3.18 | − | 1.02 |
| 5 | 58 | M | 無 | 無 | 無 | 83 | 母 | + | 2.22 | − | 1.95 |
症例1,2ではclass I・IIともにNDSA(non-DSA)を検出した。一方,症例3はclass IでNDSAを検出し,class IIでDSAを検出した。症例4はclass I・IIともに陰性であった。症例5はclass IでDSAを検出し,class IIは陰性であった。症例5のDSAはB52に対する抗体でnMFI 1,282であった。症例3のDSAはDR9に対する抗体でnMFI 3,755であったが,同時に自己のHLAであるDR14(nMFI: 3,129),DR15(nMFI: 3,459)に対する抗体も検出された(Table 6)。
| 症例 | LSSA | DSA(nMFI) | |
|---|---|---|---|
| Class I | Class II | ||
| 1 | NDSA | NDSA | |
| 2 | NDSA | NDSA | |
| 3* | NDSA | DSA | DR9(3,755) |
| 4 | − | − | |
| 5 | DSA | − | B52(1,282) |
LSSA:抗体特異性同定検査
*症例3では自己のHLAであるDR14とDR15に対する抗体も検出
血清中の免疫グロブリン塊や免疫複合体は,B細胞のFcレセプターに結合し,FCXMにおける非特異的染色の原因になる。血清の前処理として実施する超遠心は,免疫グロブリン塊や免疫複合体を沈殿させる目的があるため実施することが望ましい。遠心条件は,三重大法と福岡法で異なるが,両方法とも非特異染色は見られなかったことから,超遠心は有用であると考えられる。
細胞数と血清量の割合について,過剰な細胞数はFCXMに影響を及ぼし,偽陰性になる可能性がある4)ため,三重大法も福岡法も細胞数を調製している。血清中の抗体量は個体差があるため,細胞数を一定にすることが必要であると考えられる。
FCXMの洗浄操作が不十分な場合,反応が減弱したとする報告がある5)。三重大法は用手法で洗浄するため,福岡法の自動洗浄装置より洗浄不足や細胞をロスするリスクがあるため注意が必要である。
リンパ球分離は,免疫磁気ビーズ法や比重遠心法が一般的な方法として知られているが,三重大法はカラムや磁気ビーズを使用せずに全血から高純度なリンパ球を分離できるRosetteSepTM & SepMateTMを使用している。一方,福岡法は不要な細胞を標識し除去することで,目的とする細胞を分離できるEasySepTM Direct Human Total Lymphocyte Isolation Kitを使用している。両方法とも対象のドナー血液から4.0 × 105個以上の細胞数を確保できており,リンパ球分離の方法は有用である。
リンパ球処理について,pronase処理したリンパ球を用いてFCXMを行うと抗HLA抗体の特異性や検出感度が高くなることが報告されている6)。pronaseは,細胞膜に取り込まれた免疫グロブリン,リンパ球細胞膜のFcレセプター,CD20を除去する蛋白分解酵素であるため,特にB-cellにおいて偽陽性の軽減につながる7),8)。今回の検討では,B-cellで三重大法弱陽性,福岡法陰性を示した5症例におけるLSSAの結果は,陰性1例,NDSA 2例,DSA 2例となった。LSSAが陰性1例およびNDSA 2例の合計3例は,三重大法が偽陽性であり,pronase処理をした福岡法が抗体特異性の結果と乖離がなく,pronase処理の有用性が認められた。一方でpronase処理によってT-cellの偽陽性が増加するという報告もある9)。pronase処理にも標準法が存在しないため,濃度や反応時間などは各施設に委ねられている。そのため,当院でpronase処理を実施するには,追加の検討が必要である。
LSSAでDSAの存在した2症例は,三重大法のSN ratio 2.22,2.29と陽性判定基準(2.00以上)に近似した弱い反応であった。症例3は自己のHLAに対する抗体も検出されており,非特異的な反応とも考えられたが,DSA陽性症例として移植前脱感作療法を検討した。症例5はLSSAのMFI 1,282と低値であり,福岡法のSN ratio 1.95と陽性判定基準に近似した陰性判定のため,三重大法が弱い反応を捉えていたと考えられる。しかし,病歴上の感作歴は無く,DSAが産生された原因は不明である。
陽性判定基準は,Flow Cytometerの設定やコントロールの条件により施設毎に設定し,目安として陰性コントロールのMFIの2~3SD以上とされている10)。三重大法は,抗HLA抗体陽性検体の抗体特異性やMFIを参考にT-cell・B-cellのSN ratioを2.00以上としている。一方で福岡法は,免疫原が判明している抗HLA抗体のプール血清を用いて概ねMFI 1,500以上のDSAが検出可能なSN ratioをT-cell 1.50以上,B-cell 2.00以上としている。今回の検討より,低力価のDSAを捉えるには,SN ratioの設定に注意が必要である。また,MFI 1,500以下はFCXMでは検出できず陰性になる可能性も考慮し,抗体検査の結果も含め総合的な判断が必要である。
今回の検討では,両施設におけるT-cellの一致率が100%になったことから,FCXMの検査精度が保たれていたと言える。しかし,B-cellは一致率88.6%となり,乖離5症例における精査の結果,3例は三重大法の偽陽性が疑われたが,2例はLSSAにてDSAを検出できた。B-cellが弱陽性の解釈には,pronase処理によるFCXMの再検査や抗HLA抗体同定検査の結果を踏まえた総合的な判断が必要である。
今後は,専門学会におけるFCXM標準化の推進および移植禁忌の判定基準の設定が望まれる。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。
本検討においてご協力を賜りました輸血・細胞治療部,移植コーディネーターの皆様に深謝申し上げます。