2013 年 46 巻 3 号 p. 175-182
2013 年 46 巻 3 号 p. 175-182
症例は56歳の女性で,腹部膨満と貧血を主訴に来院された.腹部MRIで出血を伴う巨大卵巣囊腫と術前診断され,緊急開腹手術を施行したところ卵巣腫瘍ではなく巨大後腹膜腫瘍であり,穿破部からの腹腔内出血を認めた.出血性ショック状態であったため,腫瘍をサンプリングし,穿破部位を縫縮により止血し,手術を終了した.病理組織学的検査でgastrointestinal stromal tumorと診断された.腫瘍縮小後の切除を期待してメシル酸イマチニブ投与を開始した.内服開始後12日目に腫瘍が十二指腸腔内に穿通したため,腫瘍と十二指腸の一部を切除した.腫瘍は,十二指腸原発と病理組織学的検査で診断され,急速な腫瘍壊死が穿通の原因と考えられた.メシル酸イマチニブ投与に際しては,まれに消化管穿孔・穿通を経験するので,注意深い経過観察が必要である.
Gastrointestinal stromal tumor(以下,GISTと略記)の十二指腸発生はまれであり,全症例の4.5%に過ぎず1),後腹膜に発生,発育した巨大GISTは時に原発臓器の特定が困難である.後腹膜巨大GISTに対するメシル酸イマチニブ(imatinib mesylate;以下,IMと略記)投与中に十二指腸へ穿通した症例を経験したので,文献的考察を加えて報告する.
患者:56歳,女性
主訴:下腹部痛,悪寒
既往歴:小児喘息.22歳,胞状奇胎.50歳頃より高血圧症,脂質異常症.
家族歴:特記事項なし.
現病歴:2010年9月,次第に増強する腹部膨満感を主訴に当院受診した.外来精査中,突然の下腹部痛のため緊急入院となった.
入院時現症:身長156 cm,体重73.2 kg,血圧110/76 mmHg,脈101回/分と軽度の頻脈を認めた.結膜に貧血認めたが,黄疸は認めず.胸部異常なく,表在リンパ節も触知しなかった.腹部は膨隆,軽度の圧痛を認めるが腹膜刺激症状は認めなかった.
血液検査所見:WBC 8,800/mm3,Hb 9.5 g/dl,CRP 10.26 mg/dl,その他の血液・一般生化学検査は異常なし.
入院後経過:MRIにて骨盤内から上腹部に及ぶ25×22×14 cm大の腫瘤を認めた.内部は多発囊胞に加えてT1強調画像で高信号を示し出血が疑われた.腫瘤はbridging vascular sign陰性で,子宮原発病変ではなく卵巣病変が疑われた(Fig. 1).卵巣腫瘍内出血と診断し緊急開腹手術を施行した.
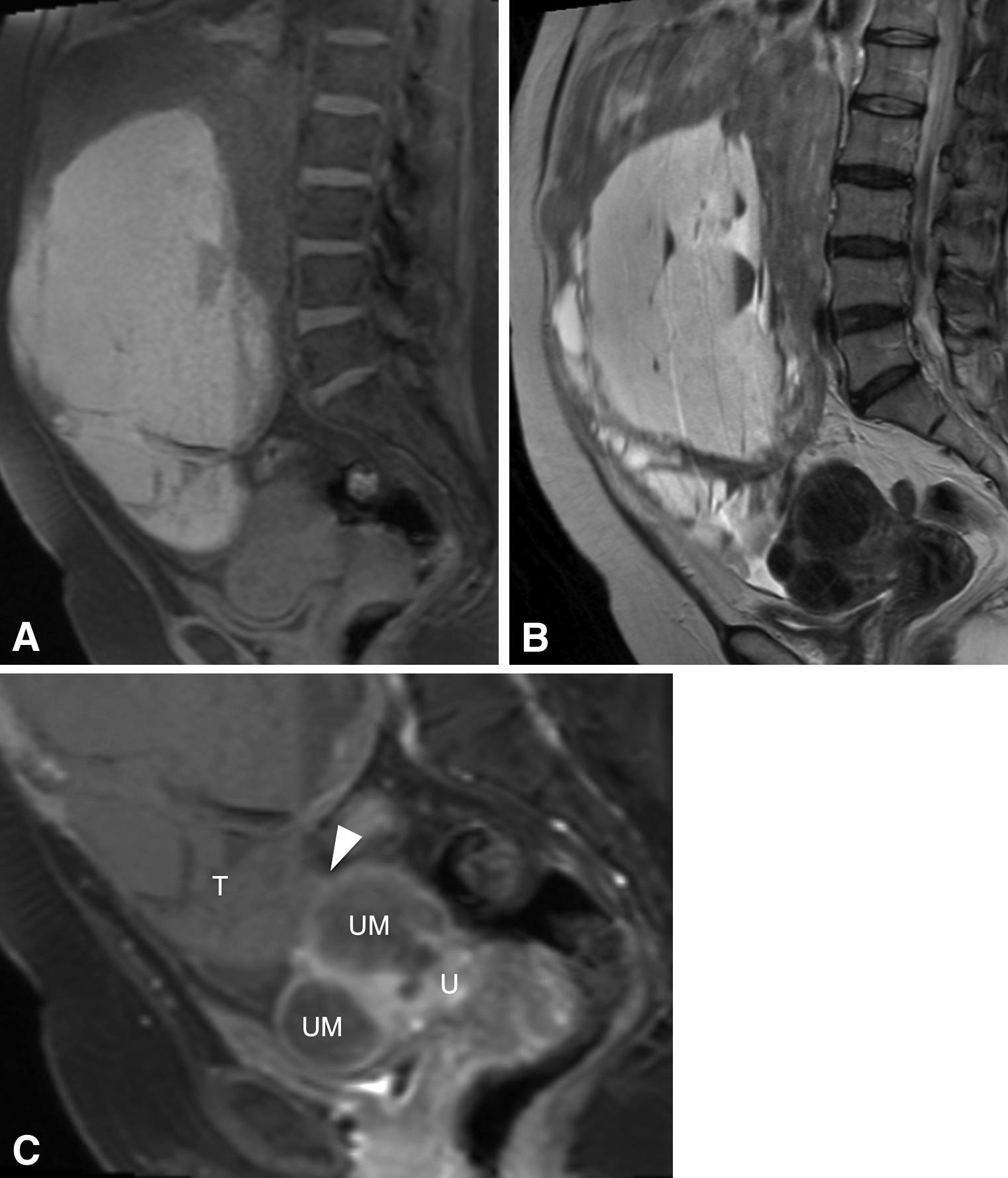
Abdominal MRI (sagittal view). Both T1 (A) and T2 (B) weighed image show a huge cystic mass with high intensity contents, suggesting hemorrhage in the tumor. (C) Enhanced T1-weight image is negative for bridging vascular signs (arrowhead). U: uterus, UM: uterine myoma, T: tumor.
手術所見:正中切開にて開腹した.腫瘤は卵巣腫瘍ではなく,可動性のない巨大後腹膜腫瘍であった.腹腔内には多量の血液を認め,骨盤内の腫瘍下端が穿破しており,出血量約2 lで,出血性ショック状態であった.腫瘍は小腸・結腸と広範囲に接しており,広範囲腸管合併切除を要することが懸念され,切除を断念した.穿破部位の腫瘍を生検し,縫合閉鎖・止血し手術を終了した.術前MRIでは血液により緊満状態であった腫瘍が開腹時には緊満が解除されており,腫瘍内出血が遊離腹腔内へ開腹までに穿破したと判断した.
病理組織学的検査所見(生検検体):腫瘍は出血を伴いクロマチンが濃染した紡錘形~類円形の細胞が充実性に増殖していた.免疫染色検査でCD34とc-kitが陽性でGISTと診断された.原発臓器が特定できていなかったが,核分裂像は6個/50視野・腫瘍径が25 cm・穿破ありのため,Fletcher分類2)・Miettinen分類3)・Hasegawaらの分類4)でいずれも高リスクGISTに該当した.
術後経過:術後食欲不振が見られたが徐々に回復した.病理組織診断と術中所見を考慮し,腫瘍縮小後の切除を目的に術後10日目よりIM 400 mg/日投与を開始し,術後18日目に退院となった.退院後4日目(内服開始後12日目)に急に腹痛を訴え,約40°Cの発熱を認めたため再入院となった.
再入院時現症:眼瞼結膜に貧血あり.腹部は膨隆し,軽度の自発痛・圧痛を認めた.
血液検査所見(入院後):Hb 7.9 g/dl,CRP 22.0 mg/dlと高度の貧血,炎症反応の上昇を認めた.その他の血液・一般生化学検査に異常なかった.
腹部造影CT所見:腫瘍は上腸間膜動脈と下腸間膜動脈それぞれの分枝に囲まれ,腫瘍内にガスとニボーを認めTorricelli-Bernoulli sign陽性であった(Fig. 2A).腫瘍は十二指腸水平部と接しており穿通が疑われた(Fig. 2B).下膵十二指腸動脈と第一空腸動脈が主要栄養血管と考えられ,その周囲が強く造影されていた(Fig. 2C).

Abdominal CT. (A) A huge cystic mass, positive for Torricelli-Bernoulli sign, is surrounded by branches of the SMA (white arrowheads) and IMA (black arrowheads). (B) The tumor is mainly adjacent to the 3rd portion of the duodenum. (C) The tumor is fed by branches (white arrowheads) of both the 1st jejunal artery and inferior pancreaticoduodenal artery (black arrowhead).
上部消化管内視鏡検査所見:十二指腸水平部に巨大瘻孔を認め,出血が見られた.十二指腸水平部原発GISTの腫瘍内出血が十二指腸水平部に穿破,穿通したものと推察された.
再入院後経過:入院後,血性の嘔吐と下痢を認めたので出血コントロール目的で緊急手術を施行した.
手術所見:正中切開にて開腹した.腫瘍は腹膜に覆われ,後腹膜に強固に固定されていた.最も炎症・癒着が少ない回盲部を脱転し,腫瘍前面に到達した.腫瘍は十二指腸水平部のみと連続し他臓器への浸潤は認めなかった.そのため十二指腸上行部下端から水平部までを合併切除し,上下の腸間膜動脈本幹とそれぞれの分枝を可及的に温存しつつ腫瘍を摘出した.十二指腸下行脚と空腸を端々吻合し,手術を終了した.
切除標本:腫瘍は25×18×5.5 cmで,中心部は壊死・空洞化し,十二指腸へ穿破していた(Fig. 3A).腫瘍の大部分は上記と同様の紡錘~類円形の異型細胞から成っていたが,腫瘍内面と十二指腸穿破部位では壊死に陥った部分が多く認められた(Fig. 3B, C).穿破部の近傍では腫瘍が壁外から十二指腸壁を貫いて内腔に露出していることが確認された(Fig. 3D).腫瘍は十二指腸以外の腸管とは連続していなかった点も踏まえて,十二指腸由来の腫瘍が壁外に発育する一方で十二指腸内腔にも浸潤露出したと考えられた.腫瘍内出血と壊死により内圧が上昇しIM治療により壊死を来し脆弱となった十二指腸付着部で穿通を来し消化管出血を引き起こしたと考えられた.遺伝子変異検査では,c-kitのエクソン9に変異を認め,PDGFRAには変異を認めなかった.

Histopathological examination of the resected tumor. (A) Resected tumor with the 3rd portion of the duodenum (asterisk). Arrowhead indicates a fistula. Bar: 5.0 cm. (B) The cut surface of the tumor. Duodenal lumen communicates with a cystic cavity in the tumor. Arrowhead indicates a fistula. DM: duodenal mucosa, MP: muscularis propria, N: necrotic area, T: viable tumor, H: hemorrage. (C) Low power view of the tumor. Viable tumor tissue is predominant in the left side of the panel, and coagulative necrosis on the right side of the panel. (D) Middle power view of the duodenal mucosa. Atypical spindle cells (arrowheads) invade to the submucosal layer and lamina propria. Asterisk indicates ulceration with necrotic debris.
術後経過:GIST遺残が考えられ,高リスク群であることを考慮し,術後30日目よりIM 400 mg/日を再開した.2011年9月腹部CTで局所再発を認めたが,その後変化なく経過観察中である.
GISTは消化管壁筋層内のカハール細胞を起源とし5)6),発育形式は管内発育型・壁内発育型・壁外発育型と多様である.
GISTの画像診断には生検と病変の陥凹・潰瘍も含めた形状の確認目的の内視鏡,超音波内視鏡,CT,MRIが推奨されている.GISTは初期では均一な腫瘤の形態を示すが,腫瘍が増大するに従って中央に壊死・出血・石灰化を伴うようになり,多彩な画像所見を示すようになる.増大した腫瘍の中心壊死部分が消化管内に穿破・交通すると,消化管内のガスが腫瘍内に流入してニボー像を形成する.これをTorricelli-Bernoulli signという.
鑑別を要する腫瘍としては,非上皮系腫瘍では間葉系腫瘍(平滑筋腫・平滑筋肉腫,神経系腫瘍など),血管原性腫瘍,脂肪腫・脂肪肉腫,悪性リンパ腫,後腹膜腫瘍(傍神経節腫瘍)などが,上皮系腫瘍では卵巣腫瘍,カルチノイド,粘膜下腫瘍の形態をとる癌腫,転移性腫瘍などである.
医学中央雑誌で「GIST」,「卵巣疾患」,「鑑別(に苦慮)」または「誤診」をキーワードとして検索したところ会議録含め1983~2012年に94例が報告されていた.Torricelli-Bernoulli signを認める場合は診断に苦慮しないが,そうでない場合は造影CTにて腫瘍辺縁血管から栄養血管を同定することにより卵巣腫瘍と鑑別できると報告されている7)8).これら誤診または診断に苦慮したGISTの原発臓器は胃から大腸にまで及び,全ての進行GISTは卵巣腫瘍と誤診される危険性がある.
今回,我々はネオアジュバント療法中に穿通したことにより初めて原発臓器を特定できた非常にまれな十二指腸水平部原発の巨大後腹膜GISTを経験した.医学中央雑誌で検索可能な十二指腸GISTの本邦報告例は約1,000例に及ぶが,詳細が明らかな118例の部位別の発生頻度をまとめると,球部が14.4%,下行脚が62.7%,水平部が18.6%,上行部が4.2%であった.リスクに関して,発生部位・核分裂像・腫瘍径から決定されるMiettinen分類での高リスクに該当する症例は54例認め,さらに腫瘍径10 cm以上に限定するとわずか22例であった.部位別の症例に含まれる10 cm以上の進行症例/Miettinen分類の高リスク症例の頻度は,球部が5.8%/23.5%,下行脚が17.5%/48.6%,水平部が18.1%/46%,上行部が80.0%/80.0%であり,肛門側の方が高リスクの頻度が高い傾向を認め,ことさら上行部の頻度の高さが際立っていた.腫瘍径10 cm以上の症例は全て壁外発育型であり,消化管通過障害を来さないことが高度に進行した状態で発見された原因であろう.本症例のように後腹膜に存在する十二指腸GIST症例はわずか7例9)~15)のみで,十二指腸穿通(穿孔含む)の報告はなく,本症例が本邦第1例目であった.
腫瘍が後腹膜に進展した理由は,十二指腸の水平部から上行部は後腹膜内に位置し,頭側に膵臓と上腸間膜動脈根部,前方に上腸間膜動静脈の本幹が走行,背側は下大静脈・大動脈・脊椎と3方向が強固な壁を形成している解剖学的構造に起因する.ここに壁外発育型腫瘍が発生した場合,尾側にのみ進展するスペースが残されており,後腹膜に進展すると考えられた.
治療の第一選択は外科治療である.本邦では十二指腸GISTに対して部分切除,膵頭十二指腸切除術(pancreaticoduodenectomy;以下PDと略記,幽門輪温存含む),幽門側胃切除術が施行されていた.本症例のような10 cm以上の進行症例(22症例)に施行された術式は,幽門側胃切除術(球部1例),PD(下行脚8例/13例,水平部・上行部1例/8例),部分切除(12例)であった.PDを選択した理由は,病変が膵浸潤あり,または膵と接していたためであり,下行脚の病変であっても膵の対側の病変は部分切除にて切除されていた.本症例は多臓器と接していたが,腫瘍が十二指腸水平部~上行部原発であったことに加え,膵と反対側の腸管から壁外性に発育していたことにより十二指腸部分切除にて腫瘍を摘出できた.
ネオアジュバント療法は,marginally resectable GIST「拡大手術により手術が可能であるが術後合併症のリスクが大きい・R0切除になるとは限らない局所進行GISTの症例」を対象として,IMが投与される.本邦での2010年GIST診療ガイドラインでは推奨グレードC(根拠が明確でない)とされている.National Comprehensive Cancer Network(NCCN)ガイドラインの2010年改訂16)以降,IMによる腫瘍縮小により手術合併症リスクが減少する症例は推奨グレード2Aであり,2010年European Society for Medical Oncology(ESMO)ガイドライン17)でも推奨グレード4Aである.しかし,手術適応基準・投与中の効果判定・手術に切り替えるタイミングなどについて明確な手順は示されておらず,いまだ臨床試験の段階である.本症例では,初回手術の際に腫瘍穿破を認めたために,腫瘍細胞の腹腔内散布が疑われ手術による根治可能性が低いと考えられた.これに加えて,外科的切除のためには広範囲腸管合併切除を要することが懸念されたため,患者と加療を行う医療従事者側の両者が臨床試験の段階のネオアジュバント療法施行を全く躊躇しなかったのが事実である.今後同様の理由からネオアジュバント療法施行症例が増えることにより,穿孔(穿通を含む,以下穿孔と略記)症例が増加する可能性があると考えられる.本症例を含むとネオアジュバント療法中のGIST穿孔は会議録を含め2004年に1例18),2009年5例19)~23),2012年1例の計7例であったが,内訳はIM投与が6例で,スニチニブ投与によるものを1例認めた.ただし,スニチニブは腫瘍部位以外の消化管穿孔の報告が多数あるため,本考察から除外する.IM投与後の穿孔は投与開始後12日の1例(本症例),24日1例,2か月2例,4か月1例,6か月1例であったが,12日の本症例と 24日という早期に穿孔した2例はいずれも消化管内腔への腫瘍露出を認めていた.そのためわずか6例の検討ではあるが,消化管内腔に腫瘍露出を認める症例は投与開始後早期の穿孔のリスクが高い可能性がある.
本症例では,初回手術後に 原発巣同定のための消化管内視鏡検査を患者本人が希望されなかったため施行できなかったが,上部消化管内視鏡検査に関しては十二指腸上行部までの診断に有効と報告されており部位診断のために本症例は施行すべきであったと考えられる.もし施行していれば消化管内腔への腫瘍露出が確認できたことによりIM投与開始後早期の消化管穿孔のリスクを予見できた可能性がある.
遺伝子変異検索に関しては,本症例でも認められたc-kitのエクソン9変異は予後やや不良とされ,IMの感受性はやや不良であることが報告されている24).だが本症例はネオアジュバント療法ならびに再発後の治療にてIMは奏効しており,感受性は良好と考えられた.
今後更なる症例が集積され,初回投与量・手術に切り替えるタイミングなど本邦におけるガイドラインが示され本症のような問題が回避されることを期待する.同時にネオアジュバント療法は,頻度が少ないが消化管穿孔を起こす可能性があり,発生時には緊急の対応を要することを念頭におく必要がある.
利益相反:なし