2013 年 46 巻 4 号 p. 310-316
2013 年 46 巻 4 号 p. 310-316
他の肝機能検査が正常でありながらインドシアニングリーン15分血中停滞率(indocyanine green retention rate at 15 minutes;以下,ICGR15と略記)のみ異常高値を示す体質性ICG排泄異常症(constitutional ICG excretory defect;以下,CIEDと略記)の疑われる患者に肝細胞癌(hepatocelluar carcinoma;以下,HCCと略記)が発生した場合,術前肝機能評価に難渋する可能性がある.今回,我々はICGR15が高度異常(60%以上)を示すもChild-Pugh grade Aで,術前からCIEDが疑われたHCC手術症例4例を経験した.それぞれICGR15は60.6,72.0,78.8,96.6%であった.全例術後肝不全を起こすことなく経過した.若干の文献的考察を加え報告する.
肝細胞癌(hepatocelluar carcinoma;以下,HCCと略記)に対する肝切除術は,根治的治療として広く行われている1).しかし,HCC患者は慢性ウイルス性肝炎や肝硬変などの慢性肝疾患を有していることが多く1),術前の肝機能評価が重要となる.これを誤ると手術可能な症例を手術不能と判定したり,術後致死的な肝不全を起こす可能性がある.インドシアニングリーン15分血中停滞率(indocyanine green retention rate at 15 minutes;以下,ICGR15と略記)は術前に肝予備能を測る重要な指標として広く用いられており,ICGR15が高度異常を示す場合,肝切除の適応外とされる可能性が高い2)3).しかし,他の肝機能検査が正常でありながらICG試験のみ異常を示す体質性ICG排泄異常症(constitutional ICG excretory defect;以下,CIEDと略記)の報告があり4)~6),このような症例の場合,手術適応や術式の選択に迷うことが考えられる.今回,我々はCIEDが疑われたHCC手術症例4例を経験し,全例術後肝不全を起こさず経過したので報告する.
症例1:64歳,男性
経過:破裂を伴ったHCCで,TACE後2か月で当科入院.腹水なく神経学的異常なし.HBs抗原(+),HBs抗体(–),HCV抗体(–).一般肝機能検査ではT-Bil 0.9 mg/dl,D-Bil 0.4 mg/dl,Alb 3.80 g/dl,PT 88.4%,AST/ALT 28/37 IU/l,ALP 160 IU/l,ChE 221 IU/lで,Child-Pugh grade Aであった(Table 1(our case 1)).Protein induced by vitamin K absence or antagonist II(以下,PIVKA-IIと略記)357 mAU/ml,AFP 15.1 ng/ml.ICGR15=60.6%で再検査でも同様の高値(73.8%)であった.CTで外側区域を占めるHCCとS4に多発肝内転移を認めた.大きなA-Pシャントはなかった.一般肝機能検査とICGR15の結果に乖離を認め,CIEDを疑い肝左葉切除を行った.最終診断は,H2,Mt(12)-L(1),16.0 cm,多結節癒合型,M(11),衛星結節,中分化型HCC,eg,fc(–),sf(–),s3,N0,vp0,vv0,b0,P0,sm(–),LF,t3,N0,M0,stage IIIであった.術後T-Bil最高値は術当日の2.4 mg/dlであった.神経ブロックを要する創部痛があったが改善し28日目に退院した(Table 1(our case 1)).
| Case | Author/Year | Age/Sex | ICGR15 (%) | Child-Pugh grade | T-Bil (mg/dl), Alb (g/dl), PT (%) | Preoperative evaluation of liver function | Type of hepatectomy | Non cancerous portion | Postoperative course | Postoperative peak values of T-Bil (mg/dl) |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Onitsuka9) 1990 |
48/M | 82, 76 | A | 2.3, 4.4, 84 | BSP | S8 partial resection | LC | hyperbilirubinemia, ascites controled by diuretics |
8.3 |
| 2 | Kin10) 1995 |
64/M | 70, 70 | A | 0.7, 3.5, 89 | BSP, liver biopsy, CDUS, AKBR | lt hemihepatectomy | CH | uneventful, discharge on POD 24 | 1.3 |
| 3 | Yamanaka11) 2001 |
61/M | 72 | A | 0.8, 3.9, 83 | BSP, liver biopsy, GSA | S8 partial resection | CH | uneventful, discharge on POD 21 |
— |
| 4 | Maeda12) 2007 |
69/M | 83.8 | A | — | BTR | anterior segmentectomy | — (no LC) | uneventful, discharge on POD 11 |
— |
| 5 | Our case 1 | 64/M | 60.6, 73.8 | A | 0.9, 3.8, 88.4 | lt hemihepatectomy | LF | Intractable wound pain requiring nerve block, discharge on POD 28 | 2.4 (POD0) | |
| 6 | Our case 2 | 76/M | 72.0, 74.3 | A | 0.9, 4.1, 89.2 | S3 partial resection | LC | ascites controlled by diuretics, discharge on POD 37 |
1.4 (POD1) | |
| 7 | Our case 3 | 69/M | 78.8, 71.2, 79.4 | A | 1.0, 3.6, 87.6 | anterior segmentectomy | CH | bile leakage requiring bilioenteric anastomosis, discharge on POD 88 | 3.3 (POD3) | |
| 8 | Our case 4 | 72/M | 96.6, 78.2 | A | 1.0, 3.8, 61.6 | GSA | lt hemihepatectomy and S5 partial resection | LF | uneventful, discharge on POD 12 |
2.3 (POD0) |
ICGR15: indocyanine green retention rate at 15 minutes; BSP: sulfobromophthalein; LC: liver cirrhosis; CDUS: color Doppler US, AKBR: arterial ketone body ratio, CH: chronic hepatitis; POD: postoperative day; GSA: 99mTc-galactosyl-human serum albumin; —: not described; BTR: branched chain amino acid and tyrosine ratio; LF: liver fibrosis
症例2:76歳,男性
経過:近医でC型慢性肝炎と肝右葉のHCCで経皮的エタノール注入療法を受けていた.CTで肝外側区域(S3)にHCCが出現しTACEを受けたが,9か月後に同部の周囲に腫瘤を認め当科入院.腹水なく神経学的異常なし.HBs抗原(–),HBs抗体(–),HCV抗体(+).一般肝機能検査ではT-Bil 0.9 mg/dl,D-Bil 0.5 mg/dl,Alb 4.1 g/dl,PT 89.2%,AST/ALT 47/26 IU/l,ALP 203 IU/l,ChE 155 IU/lで,Child-Pugh grade Aであった(Table 1(our case 2)).PIVKA-II 12 mAU/ml,AFP 3.2 ng/ml.ICGR15=72.0%で再検査でも同様の高値(74.3%)であった.CTでS3に径約4.0 cmの腫瘤を認めた.右葉に明らかなHCC再発所見は認めず,また大きなA-Pシャントはなかった.S3の腫瘤に対し血管造影,TACEを行ったが腫瘍濃染像やリピオドールの沈着がみられず,再生結節などを疑い経皮的針生検を行ったところHCCであった.一般肝機能検査とICGR15の結果に乖離を認め,CIEDを疑い手術を行うこととし,肝S3部分切除を行った.最終診断はHs,St-L,4.6 cm,単純結節型,高分化型HCC,eg,fc(–),sf(–),s0,N0,vp0,vv0,b0,P0,sm(–),LC,t2,N0,M0,stage IIであった.術後T-Bil最高値は術後1日目の1.4 mg/dlであった.腹水を認めたが利尿剤で軽快し,術後37日で退院となった(Table 1(our case 2)).
症例3:69歳,男性
経過:高血圧の経過観察での血液検査で肝機能障害を指摘され,腹部USを受けたところ肝腫瘤をみとめ,CTでHCCと診断された.翌月当科入院.腹水なく神経学的異常なし.HBs抗原(–),HBs抗体(–),HCV抗体(+).一般肝機能検査ではT-Bil 1.0 mg/dl,D-Bil 0.5 mg/dl,Alb 3.6 g/dl,PT 87.6%,AST/ALT 108/168 IU/l,ALP 299 IU/l,Ch-E 256 IU/lで,Child-Pugh grade Aであった(Table 1(our case 3)).PIVKA-II 573 mAU/ml,AFP 6.5 ng/ml.ICGR15=78.8%で再検査でも同様の高値(71.2%,79.4%)であった.CTでS5に径7.5 cm,S6に1.0 cmのHCCを認めた.大きなA-Pシャントはなかった.CT volumetryでは前区域切除で35.1%の肝切除率であった.一般肝機能検査とICGR15の結果の乖離からCIEDを疑い手術を行うこととし,S6の一部を含む肝前区域切除を行った.最終診断はH2,Mt(2)-A(1),7.5 cm,単純結節周囲増殖型,P(1),1.0 cm,単純結節型,中分化型HCC,eg,fc(+),fc-Inf(+),sf(+),s0,N0,vp0,vv0,va0,b0,P0,sm(+),LF,t3,N0,M0,stage IIIであった.術後T-Bil最高値は術後3日目の3.3 mg/dlであった.術後に術中の後区域胆管損傷によると思われる胆汁瘻が持続したため,後区域胆管空腸吻合を行い,初回手術後88日で退院となった(Table 1(our case 3)).
症例4:72歳,男性
経過:5年前より脂肪肝を指摘され,2年前に肝S4のHCCに対しTACEと経皮的ラジオ波焼灼術(radiofrequency ablation;以下,RFAと略記)を,その3か月後にS3のHCCに対しRFAを施行された.2か月前にMRIでS4のRFA施行部周囲に再発を認め当科入院.腹水なく,神経学的異常なし.HBs抗原(–),HBs抗体(+),HCV抗体(–).一般肝機能検査ではT-Bil 1.0 mg/dl,D-Bil 0.4 mg/dl,Alb 3.8 g/dl,PT 61.6%,AST/ALT 29/22 IU/l,ALP 370 IU/l,Ch-E 330 IU/lで,Child-Pugh grade Aであった(Table 1(our case 4)).PIVKA-II 14,383 mAU/ml,AFP 8.9 ng/ml.ICGR15=96.6%で再検査でも78.2%と高値であった.腹部血管造影下CTで肝S4に径約3 cm,S5に約1 cmのHCCを認めた(Fig. 1).大きなA-Pシャントはなかった.CT volumetryでは全肝890 ml,左葉195 ml(22.4%)であり,左葉切除後の残肝量は77.6%であった.99mTc-galactosyl-human serum albumin scintigraphy(以下,GSAシンチと略記)ではHH15 0.532,LHL15 0.844,maximum removal rate of 99mTc-galactosyl-human serum albumin(以下,GSARmaxと略記)0.355 mg/minであり,SPECT画像による機能的残肝量は73%で,残肝のGSARmaxは0.244であった.一般肝機能検査とICGR15,GSAシンチの結果の乖離からCIEDを強く疑い手術を行うこととし,肝左葉切除,S5部分切除を行った.最終診断は,H2,Mt(2)-M(1),4.2 cm,多結節癒合型(Fig. 2),A(1),0.8 cm,単純結節型,中分化型HCC,eg,fc(+),fc-Inf(+),sf(+),s0,N0,vp0,vv0,va0,b0,P0,sm(–,4 mm),LF(f3),t3,N0,M0,stage IIIであった.術後血中T-Bil最高値は術当日の2.3 mg/dlで,その他D-Bil,AST,ALT,Albも著変なく経過し,12日目に退院した(Table 1(our case 4)).
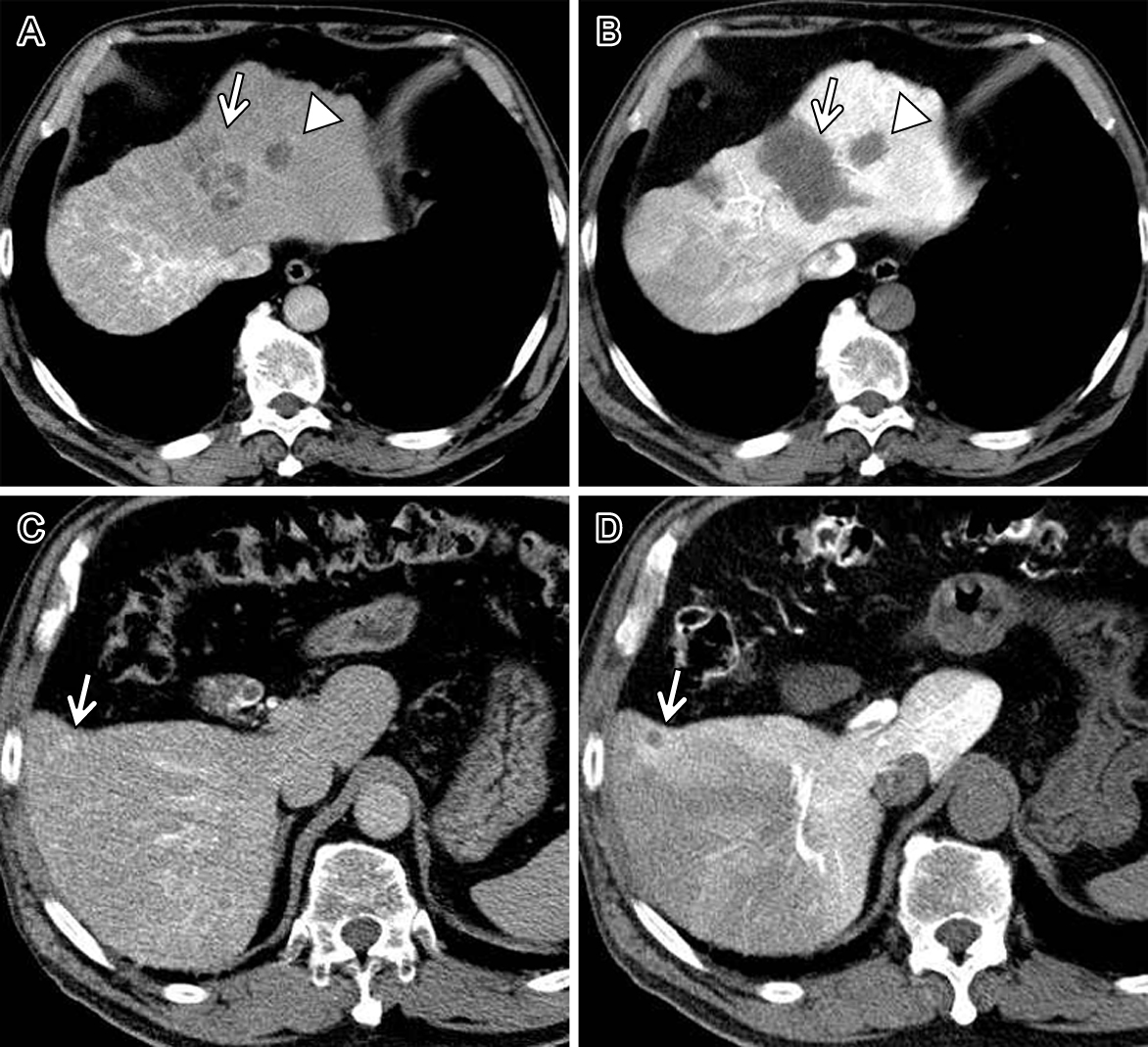
CT during hepatic arteriography (CTHA) and arterioportography (CTAP) A: CTHA shows a tumor with septum formation that is irregularly stained in the medial segment (arrow). A hypodensity area in the lateral segment is a scar of radiofrequency ablation (RFA) that was previously performed (arrowhead). B: The tumor (arrow) and scar (arrowhead) are shown as perfusion defects in CTAP. C: CTHA shows a small tumor that was faintly stained in the anterior segment. D: A small tumor is shown as a perfusion defect in CTAP (arrow).

The resected specimen of S4 of the liver shows a tumor that is confluent multinodular type and 4.2×3.5 cm in size. Non-tumorous liver shows moderate fibrosis.
南部ら4)によると,体質性ICG排泄異常症の確診例として,ICGR15が高度異常(少なくとも50%以上)を示すがsulfobromophthalein(以下,BSPと略記)試験は正常で,一般肝機能検査成績や肝臓の病理組織学的検査所見に異常がないもしくは家族内発生がみられるものとしている.しかし,以前はBSP試験が肝機能検査として広く行われていたが,アナフィラキシーショックの発生や精度に劣ることから,現在はBSP試験は行われなくなっている.また,HCC患者では背景にウイルス性肝炎やアルコールなどによる慢性肝疾患を伴うことが多いため,体質性ICG排泄異常症を持つHCC患者では,肝臓の病理組織学的検査所見には異常が見られることが多いと考えられる.そこで今回の検討ではICG高度異常(60%以上)を示しChild-Pugh grade Aで,大きなA-Pシャントのない症例をCIED疑いとし,組織学的な変化は問わないこととした.当施設での1990年から2010年までのHCC手術患者で,術前肝機能Child-Pugh grade Aの患者のうちICGR15が60%以上を示した症例が4例(1.1%)見られた.これらの症例では通常の肝機能検査とICGR15とが大きく乖離し,またこれらを説明できるような大きなA-Pシャントもなく,何らかの体質性ICG排泄異常を有すると考え,今回はこれらの症例を検討した.これらの症例では実際術前CIEDが疑われ,症例1~3ではChild-Pugh gradeから,症例4ではこれにGSAシンチの結果も加味し手術に踏み切った.
南部ら4)はCIED発生率は0.007%と極めてまれとしており,我々の施設でのHCC手術患者のCIED疑い例はこれに比べると非常に高率(1.1%)に見られたことになる.今回の症例ではBSP試験がなされておらず真のCIEDではない症例も含まれている可能性はあるが,BSP試験が事実上行えない今日,他の肝機能検査と乖離してICGR15異常高値を示す症例が見られた場合はCIED疑い例としてさらなる肝機能検査を行う必要がある.BSP試験を含まないCIEDの診断基準の作成が待たれる.
CIEDのメカニズムについては,種々の報告がある.ICGの肝細胞への取り込みの異常が示唆され4),肝細胞膜でのICGのactive transportが障害されている7)との報告がある.一方,organic anionであるICGの肝細胞内transportの異常であり,いくつかのstepの異常が混在している5)との報告もある.また,Gilbert症候群と同じような高間接ビリルビン血症の合併例も報告(連続した高間接ビリルビン血症49例のうち,44例はGilbert症候群で,残りが本例)8)されており,体質性黄疸との関連例も含まれていると思われる.
CIEDが疑われた肝細胞癌手術症例の4例に対し,いずれも肝不全の合併なく手術が可能であった.左葉切除(症例1,2)や前区域切除(症例4)といった肝切除でも術後肝機能に問題はなかった.
過去の報告で,ICG排泄異常症を伴うHCC患者に対する肝切除例をPubMedで検索年数を1950年から2012年3月まで(Key words:“hepatocellular carcinoma”and“indocyanine green or ICG”and“excretory defect or constitutional defect or marked retention”and“surgery or resection or hepatectomy”)および医学中央雑誌で1983年から2012年3月まで(キーワード:「ICG排泄異常症or ICG負荷試験の著明な停滞」,「肝細胞癌or肝癌」,「切除or手術」)で報告年に制限をかけず調べたところ,4例の報告があった(Table 1).いずれも本邦からの報告で,報告例全例で術後大きな問題はなく経過していた9)~12).ICG試験以外の術前肝機能評価法としては,一般肝機能検査に加え,近年Yamanakaら11)はGSAシンチの有用性を述べている.HCC以外の患者のCIEDで肝左葉切除を行った報告でもGSAシンチの有用性が強調されている13)が,肝機能低下例の多いHCC症例では術前検査として特に有用性が高いと考えられる.本研究でも近年の症例である症例4においてGSAシンチを行い有用であった.Kwonら14)は,SPECT画像により術後残肝予定部のGSARmaxを測定し,0.15 mg/min以下の場合術後肝不全の危険性があると報告している.当施設でもこれに基づき評価し,左葉切除で残肝GSARmax=0.244であり耐術可能と判断した.ICGR15が高度に不良(60%以上)であっても,Child-Pugh grade AであればCIEDの可能性を考え,一律に手術の可能性を排除しなくてよいと思われる.肝機能の評価としては,肝障害度より検査項目としてICGR15を含まないChild-Pugh grade を使用すべきである.CIEDが疑われた場合,今回の症例1~3のように手術に踏み切るのも可能と思われるが,症例4のGSAシンチのようにプラスαの肝機能評価の結果が良好であれば信頼性が向上する.過去の報告ではこうしたプラスαの肝機能評価法としてcolor Doppler US10),arterial ketone body ratio(AKBR)10),branched chain amino acid and tyrosine ratio12)も用いられている.また,肝生検も術前行われているが10)11),これは侵襲のある検査でありできれば避けたほうがよいと思われる.
利益相反:なし