Abstract
症例は55歳の女性で,腹部USで肝腫瘍を指摘され当院へ紹介された.腹部CTでは早期層で辺縁優位に造影され,後期相で洗い出しされる径19 mm大の腫瘍を認めた.腹部血管造影では辺縁優位に濃染像を認めた.腫瘍マーカーは正常であったが,画像検査から肝細胞癌を疑い腫瘍が深部に存在し右肝静脈に接することより右肝切除を施行した.肝腫瘍は被膜の形成なく白色充実性で境界明瞭であった.病理組織学的検査所見で肝reactive lymphoid hyperplasia(以下,RLHと略記)と診断された.肝RLHは肝悪性腫瘍と診断され手術に至ることが多い.そのため造影早期に造影される肝腫瘍の鑑別疾患にRLHの存在を念頭に置くことで,確定診断に至らない場合,診断目的で針生検を検討する必要があると考えられた.
はじめに
Reactive lymphoid hyperplasia(以下,RLHと略記)は,組織学的に,リンパ濾胞が胚中心の反応性過形成を示し,個々のリンパ球の異型は少なくpolyclonalな増殖を認めるものと定義される1)2).近年,画像診断の進歩とともに肝RLH報告例が散見されるが,名称,原因,診断法,治療法など統一した見解がないのが現状である.今回,我々は原発性肝細胞癌と鑑別困難であった肝RLHを経験した.肝腫瘍の鑑別診断として示唆に富む症例であり文献的考察を加え報告する.
症例
患者:55歳,女性
主訴:特記事項なし.
既往歴:高血圧,糖尿病
家族歴:特記事項なし.
現病歴:近医にて胆囊結石経過観察中に肝腫瘤を指摘され,精査加療目的に2012年1月入院となった.
入院時身体所見:身長148 cm,体重56.5 kg.結膜に黄疸,貧血なし.表在リンパ節を触知せず.
腹部は平坦,軟で腫瘤は触知しなかった.
血液生化学検査所見:γ-GTP 177 IU/l,HbA1c 7.7%と上昇を認めた.肝炎ウイルスマーカーは陰性,腫瘍マーカー(CEA,CA19-9,AFP,PIVKA-II)は基準値内であった.Child-Pugh分類はgrade AでありICG15分値は4.0 %,ICG K値は0.214と正常であった.
腹部超音波検査所見:肝S7/8深部に19×19 mmの境界明瞭な低エコー腫瘤を認めた(Fig. 1).
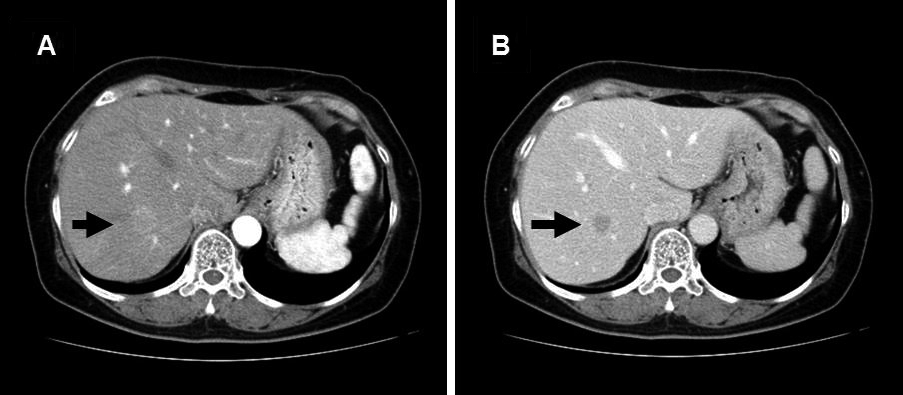
腹部CT所見:腫瘍は単発で,単純CTでS7/8に18 mmの低吸収域を認め,動脈相で辺縁優位に造影され,門脈相・平衡相では洗い出しされた(Fig. 2).
腹部MRI所見:腫瘍はT1強調画像では低信号,T2強調画像では高信号を示した.
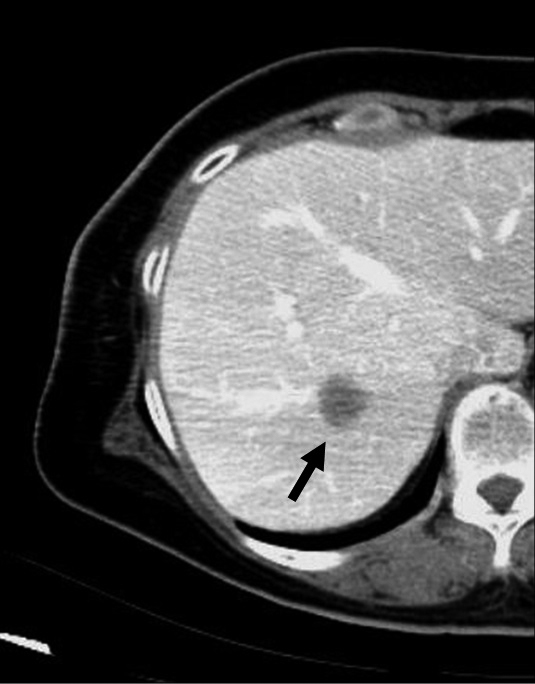
腹部血管造影およびCT during helical arterioportography(以下,CTAPと略記)所見:腹部血管造影では,A7をfeederとする辺縁優位に造影される淡い腫瘍濃染を認め(Fig. 3),CTAPでは腫瘍部はperfusion defectを認めた(Fig. 4).
以上より,動脈血優位の比較的早い腫瘍内血流が認められ,確定診断には至らなかったが原発性肝細胞癌(以下,HCCと略記)を強く疑った.肝生検による播種を危惧したため生検は施行せず根治術である手術を選択した.肝機能は正常で腫瘍が深部に存在し右肝静脈と接すること,またvolumetryを行い右肝切除を施行した際の残肝容積は465 ml,残肝率は38.5%,残肝ICGKは0.077でありNaginoら3),前田ら4)が提唱する肝切除前肝予備能評面≥0.05を満たすため右肝切除を施行した.
手術所見:2012年1月手術を施行した.右上腹部J字切開,右第9肋間にて開胸開腹した.肝臓は正常肝の所見であった.術中超音波検査では肝S7/8深部に周囲肝よりhypoechoicに描出される直径23 mmの腫瘍を認めた.定型的に右肝切除術を施行した.出血量409 ml,無輸血であった.
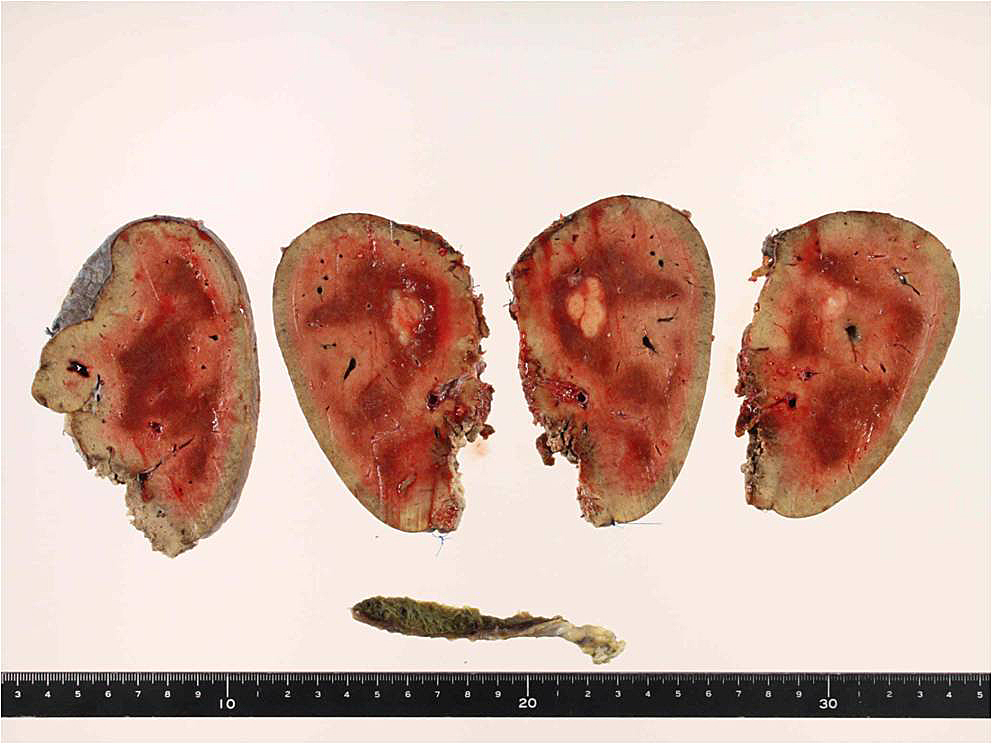
切除標本肉眼所見:腫瘍は22×25×20 mm,被膜の形成なく白色充実性で境界明瞭であった(Fig. 5).
病理組織学的検査所見:腫瘤は組織学的には,主として門脈域を中心に結節性に増生するリンパ濾胞より形成されていた.HEではリンパ濾胞は,tingible body macrophageの見られる胚中心を有し,マントル帯も明瞭で二次濾胞と判断した.周辺のリンパ球にも異型は乏しかった.腫瘤周辺の門脈域にも,リンパ球の集蔟が見られた.反応性の変化と診断したが(Fig. 6),リンパ腫(特にfollicular lymphoma)の否定のため免疫染色検査を行った.
免疫染色検査の結果は以下のごとくである.
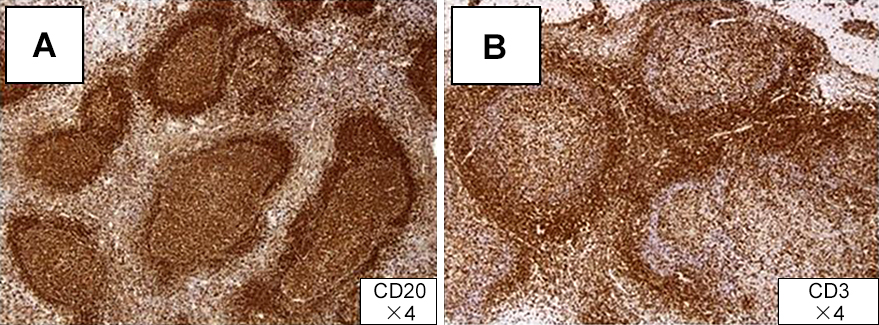
胚中心は,CD79a陽性,CD20陽性,CD10陽性,bc12陰性で,follicular lymphomaは否定できた.濾胞周辺に浸潤するリンパ球は,CD20陽性,CD79a陽性のB-cellとCD3陽性のT-cellリンパ球が混在して見られ,T-cell優位であった(Fig. 7A, B).リンパ球に異型はなく,lymphoepithelial lesion(以下,LELと略記)は見られず,MALT type lymphomaは否定できた.CD5はCD3と同様の分布を示し,cyclinD1は陰性で,mantle cell lymphomaも否定した.周辺の門脈域の浸潤リンパ球は,B-cellとT-cellが混在して見られ,T-cell優位であった.
以上の結果より,組織学的には,反応性のリンパ濾胞の集蔟と判断し,RLHと診断した.
術後経過に問題なく26病日に退院した.術後2年2か月の現在,元気に社会復帰している.
考察
RLHは一般に消化管5)~8),肺9)10),眼窩11),皮膚12)13)などの発生することが知られている.RLHは,組織学的には反応性の胚中心を伴ったリンパ濾胞を認め,リンパ球に異型がなくpolyclonalな反応性の増殖を認めるものと定義される.
医学中央雑誌,PubMedを用いた1983年から2012年までの期間で「RLH」,「肝臓」,「肝細胞癌」をキーワードとして会議録を除いて検索しえたかぎりでは,肝RLHは自験例を含め43例の報告例がある(Table 1)1)14)~48).特徴として中年以降の女性に多く(男性5例,女性38例),慢性肝炎,膠原病,悪性腫瘍との合併が指摘されているが関連性は明らかではない.併存疾患では糖尿病5例2)16)17)21),悪性疾患10例(胃癌4例15)20)31)44),大腸癌4例31)32)35)39),腎癌2例26)41)),自己免疫疾患10例(原発性胆汁うっ滞性肝硬変6例22)23)42)~44),Sjögren症候群2例22)25),抗リン脂質抗体症候群1例45),甲状腺炎3例24)38)45),CREST症候群1例23),慢性肝炎5例(HBV 2例1)45),HCV 3例20)43)48))などが報告されている.本症例は糖尿病および抗核抗体陽性であるが関連性は明らかでない.
Table 1
Case of reactive lymphoid hyperplasia of the liver in the literature and the present case
| Case |
Author |
Year |
Age |
Sex |
Location |
Size (cm) |
Preoperative diagnosis |
Operation |
Association |
| 1 |
Snover14) |
1981 |
15 |
F |
— |
— |
— |
– |
Combined immunodeficiency |
| 2 |
Grouls15) |
1987 |
85 |
F |
Right lobe |
1.4, 0.8 |
Metastatic liver tumor |
– |
Gastric cancer |
| 3 |
Isobe16) |
1993 |
59 |
F |
Left lobe |
0.9 |
Malignant tumor |
+ |
DM |
| 4 |
Katayanagi17) |
1994 |
66 |
F |
Right lobe |
1.5 |
HCC |
+ |
DM |
| 5 |
Ohtsu1) |
1994 |
42 |
F |
S6 |
1.5 |
HCC |
+ |
HBV |
| 6 |
Endo18) |
1996 |
38 |
F |
S7 |
1.7 |
Metastatic liver tumor |
+ |
— |
| 7 |
Tanizawa19) |
1996 |
67 |
F |
Left lobe |
2 |
HCC |
+ |
— |
| 8 |
Kim20) |
1997 |
72 |
M |
S3 |
1.7 |
HCC |
+ |
Gastric cancer, HCV |
| 9 |
Nishijima21) |
1998 |
58 |
F |
S7 |
1.5 |
CCC |
+ |
— |
| 10 |
Sato22) |
1999 |
41 |
F |
Right lobe |
1.1 |
RLH |
– |
PBC, Sjögren’s syndrome |
| 11 |
Sharifi23) |
1999 |
52 |
F |
Right lobe |
0.4 |
— |
+ |
PBC, OLT |
| 12 |
Sharifi23) |
1999 |
56 |
F |
Left lobe |
1.5 |
— |
+ |
CREST synd, OLT |
| 13 |
Sharifi23) |
1999 |
56 |
M |
— |
— |
— |
+ |
— |
| 14 |
Nagano24) |
1999 |
47 |
F |
S7 |
1.7 |
HCC |
+ |
Chronic thyroiditis |
| 15 |
Okubo25) |
2001 |
49 |
F |
Right lobe |
2 |
HCC |
+ |
Sjögren’s symdrome |
| 16 |
Pantanowitz26) |
2001 |
65 |
F |
Right lobe |
1.7 |
Metastatic liver tumor |
+ |
Renal cell carcinoma |
| 17 |
Mori27) |
2002 |
49 |
F |
S7/8 |
1.8 |
HCC |
+ |
— |
| 18 |
Okuhama28) |
2003 |
70 |
M |
S6 |
4.7 |
HCC |
+ |
— |
| 19 |
Shiozawa29) |
2004 |
51 |
F |
S3 |
1.5 |
HCC |
+ |
— |
| 20 |
Ota30) |
2006 |
63 |
F |
Right lobe |
1.6 |
RLH |
– |
— |
| 21 |
Sato31) |
2006 |
75 |
F |
Right lobe |
1.4 |
Metastatic liver tumor |
+ |
Gastric cancer |
| 22 |
Sato31) |
2006 |
|
|
Left lobe |
2 |
|
|
— |
| 23 |
Takahashi32) |
2006 |
77 |
F |
S3 |
1.5 |
Metastatic liver tumor |
+ |
Colon cancer |
| 24 |
Maehara33) |
2006 |
72 |
F |
S3 |
1.3 |
CCC |
+ |
— |
| 25 |
Willenbrock34) |
2006 |
36 |
F |
S8 |
1.8 |
— |
Open excisional biopsy |
— |
| 26 |
Takahashi35) |
2007 |
64 |
F |
S2 |
1 |
HCC |
+ |
Colon cancer |
| 27 |
Matsumoto36) |
2007 |
67 |
F |
S5 |
1.2 |
HCC |
– |
PEIT |
| 28 |
Miyamoto37) |
2007 |
60 |
F |
S8 |
1.2 |
HCC,ML |
+ |
— |
| 29 |
Machida38) |
2007 |
53 |
F |
S4, 6, 7 |
0.8, 1.1, 1.3 |
HCC |
+ |
Autoimmune thyroiditis |
| 30 |
Lin39) |
2008 |
44 |
F |
S1 |
1.5 |
Metastatic liver tumor |
+ |
Colon cancer |
| 31 |
Jiménez40) |
2008 |
34 |
F |
S6 |
2.7 |
Benign tumor |
+ |
— |
| 32 |
Park41) |
2008 |
46 |
F |
S5 |
1 |
Metastatic liver tumor |
+ |
Renal cell carcinoma |
| 33 |
Okada42) |
2009 |
68 |
F |
S6, 7 |
0.4, 1.0 |
HCC |
+ |
PBC |
| 34 |
Fukuo43) |
2010 |
47 |
F |
S2, S7 |
0.5, 1.5 |
HCC |
+ |
PBC |
| 35 |
Ishida44) |
2010 |
68 |
F |
S8 |
2 |
Malignant tumor |
+ |
Gastric cancer, PBC |
| 36 |
Zen45) |
2010 |
63 |
F |
S7, S6 |
0.9, 0.5 |
— |
+ |
PBC, Chronic thyroiditis |
| 37 |
Zen45) |
2010 |
40 |
M |
S6 |
2 |
— |
+ |
HBV |
| 38 |
Zen45) |
2010 |
81 |
M |
S3 |
5.5 |
RLH |
– |
— |
| 39 |
Zen45) |
2010 |
64 |
F |
S5, S7 |
3.5, 1.0 |
RLH |
– |
APS |
| 40 |
Sibulesky46) |
2010 |
37 |
F |
S7/8 |
1 |
— |
+ |
Donor |
| 41 |
Hayashi47) |
2011 |
59 |
F |
S3 |
1 |
HCC |
+ |
— |
| 42 |
Yamazaki2) |
2011 |
71 |
F |
S5 |
2 |
HCC |
+ |
HCV, DM, ML |
| 43 |
Suzuki48) |
2012 |
65 |
F |
S4 |
1.5 |
HCC |
+ |
HCV |
| 44 |
Our case |
|
55 |
F |
S7/8 |
1.8 |
HCC |
+ |
DM |
肝RLHは血液検査所見や画像所見に確定診断に至る特徴を認めず,悪性腫瘍との鑑別は困難であり手術に至ることが多い.画像検査における過去の報告として,腹部超音波検査では境界明瞭な低エコー腫瘤として描出,単純CTではlow density,造影CTでは早期相から造影され,後期相で洗い出しされる症例が多い.詳細なCT所見が記されていたのは21例で,辺縁優位に早期に造影されたのが5例(24%),早期に腫瘍全体が造影されたのが10例(47%),造影されなかったものが6例(28%)であった.単純MRIではT1強調像でlow intensity,T2強調像でhigh intensityを呈し,Gd-DTPAを用いた造影T1強調像では,早期相で造影され,後期相で洗い出しされる.Superparamagnetic iron oxide particlesやGd-EOB-DTPAを用いた造影MRIでは造影剤の取り込みが認められない29)30)45).血管造影下CTでは,CTAで腫瘍の濃染像を認め,CTAPではperfusion defectを呈する症例が多い.詳細な血管造影下CT所見が記されていたのは15例でCTAで辺縁優位に造影されたのが4例(27%),腫瘍全体が造影されたのが9例(60%),造影されなかったものが2例(13%)であった.また,FDG-PETで集積を認めた症例もあり39)47),肝悪性腫瘍と診断され手術に至ることが多い.31例に手術が施行され,術前診断はHCC 18例1)2)17)19)20)24)25)27)~29)35)~38)42)43)47)48),胆管細胞癌2例19)33),転移性肝癌8例15)18)26)31)32)33)39)41),悪性リンパ腫1例37)であった.
確定診断に至る唯一の方法は肝生検であると考えられる.塩澤ら29)が報告するように,以前は採取される検体量が少なく組織情報量が十分でないこと,また標本採取,作成過程でリンパ球に挫滅が加わることが多く異型性を含め形態判断が困難になっている場合が多く,生検材料からの確定診断は困難と考えられてきたが,近年の生検機材の改良と技術の進歩により以前と比べかなりの量の肝組織を採取することが可能となり,RLHと診断できる十分な組織情報量が得られるようになった.
しかし,問題は悪性腫瘍を疑う場合には播種が危惧される点であり,適応は慎重に検討する必要があると考えられる.
病理組織学的に重要な鑑別診断としては,悪性リンパ腫があげられる.実際,本腫瘤は光顕で大小リンパ球の集族性増殖からなり,二次濾胞様の結節性集族性増殖を示す部分を介在し,核小体の目立つ大型異形単核細胞を混じており悪性リンパ腫が疑われた.
しかし,免疫染色検査としてCD79a,CD20,CD10,bcl-2,CD3,CD5,cyclinD1を追加することで前述のごとくそれらの染色パターンの相違によりfollicular lymphoma,MALT type lymphoma,mantle cell lymphomaは否定されRLHの確定診断に至った.多クローン性であること,増生しているリンパ球に異形が乏しい点もRLHを支持する所見であった.また,炎症性偽腫瘍も鑑別にあがるが線維芽細胞の介在を認める点で鑑別可能である.
RLHは良性疾患と考えられるが,現時点では画像診断で確定診断に至る方法がないため切除に至ることが多い.
本例における反省点としてHCCを想定した術式として右肝切除は過大であったと考えられる.肝癌診療ガイドライン49)に従い,腫瘍径も25 mmと小型であり,小範囲の系統的切除を選択すべきであった.
本疾患を肝腫瘍の鑑別疾患として念頭に置くことで,HCCの確定診断に至らない場合,肝腫瘍の診断目的で針生検を検討する必要があると考えられた.
利益相反:なし
文献
- 1) Ohtsu T, Sasaki Y, Tanizaki H, Kawano N, Ryu M, Satake M, et al. Development of pseudolymphoma of liver following interferon-alpha therapy for chronic hepatitis B. Intern Med. 1994 Jan;33(1):18–22.
- 2) 山崎 慎太郎, 高山 忠利, 岩間 敦子, 吉田 直, 渡邊 慶史, 桧垣 時夫,ほか.肝reactive lymphoid hyperplasiaの一例.日本臨床外科学会雑誌.2011;72(4):960–964.
- 3) Nagino M, Kamiya J, Nishio H, Ebata T, Arai T, Nimura Y. Two hundred forty consecutive portal vein embolizations before extended hepatectomy for biliary cancer: surgical outcome and long-term follow-up. Ann Surg. 2006;243:364–372.
- 4) 前田 敦行, 上坂 克彦, 松永 和哉, 金本 秀行, 坂東 悦郎, 斉藤 修治.予定残肝ICG消失率(ICG Krem)による肝門部胆管癌術前肝予備能評価.胆道.2008; 22(4):500–506.
- 5) Smith JL, Helwig EB. Malignant lmphoma of the stomach: its diagnosis, distinction and biologic behavior [abstract]. Am J Pathol. 1958;34(3):553.
- 6) Tokunaga O, Watanabe T, Morimatsu M. Pseudolymphoma of the stomach. A clinicopathologic study of 15 cases. Cancer. 1987 Apr;59(7):1320–1327.
- 7) Abbondanzo SL, Sobin LH. Gastric “pseudolymphoma”: a retrospective morphologic and immunophenotypic study of 97 cases. Cancer. 1997 May;79(9):1656–1663.
- 8) Kojima M, Itoh H, Motegi A, Sakata N, Masawa N. Localized lymphoid hyperplasia of the rectum resembling polypoid mucosa-associated lymphoid tissue lymphoma: a report of three cases. Pathol Res Pract. 2005;201(11):757–761.
- 9) Holland EA, Ghahremani GG, Fry WA, Victor TA. Evolution of pulmonary pseudolymphomas: clinical and radiologic manifestations. J Thorac Imaging. 1991 Sep;6(4):74–80.
- 10) Abbondanzo SL, Rush W, Bijwaard KE, Koss MN. Nodular lymphoid hyperplasia of the lung: a clinicopathologic study of 14 cases. Am J Surg Pathol. 2000 Apr;24(4):587–597.
- 11) Knowles DM, Jakobiec FA, McNally L, Burke JS. Lymphoid hyperplasia and malignant lymphoma occurring in the ocular adnexa (orbit, conjunctiva, and eyelids): a prospective multiparametric analysis of 108 cases during 1977 to 1987. Hum Pathol. 1990 Sep;21(9):959–973.
- 12) Medeiros LJ, Picker LJ, Abel EA, Hu CH, Hoppe RT, Warnke RA, et al. Cutaneous lymphoid hyperplasia. Immunologic characteristics and assessment of criteria recently proposed as diagnostic of malignant lymphoma. J Am Acad Dermatol. 1989 Nov;21(5 Pt 1):929–942.
- 13) Baldassano MF, Bailey EM, Ferry JA, Harris NL, Duncan LM. Cutaneous lymphoid hyperplasia and cutaneous marginal zone lymphoma: comparison of morphologic and immunophenotypic features. Am J Surg Pathol. 1999 Jan;23(1):88–96.
- 14) Snover DC, Filipovich AH, Dehner LP, Krivit W. ‘Pseudolymphoma’. A case associated with primary immunodeficiency disease and polyglandular failure syndrome. Arch Pathol Lab Med. 1981 Jan;105(1):46–49.
- 15) Grouls V. Pseudolymphoma (inflammatory pseudotumor) of the liver. Zentralbl Allg Pathol. 1987;133(6):565–568.
- 16) Isobe H, Sakamoto S, Sakai H, Masumoto A, Sonoda T, Adachi E, et al. Reactive lymphoid hyperplasia of the liver. J Clin Gastroenterol. 1993 Apr;16(3):240–244.
- 17) Katayanagi K, Terada T, Nakanuma Y, Ueno T. A case of pseudolymphoma of the liver. Pathol Int. 1994 Sep;44(9):704–711.
- 18) 遠藤 高, 磯部 義憲, 松永 敬二, 吉本 暢元, 北野 雅史, 瀧川 政和,ほか.肝pseudolymphomaの1例.臨床画像.1996;12(10):1230–1234.
- 19) Tanizawa T, Eishi Y, Kamiyama R, Nakahara M, Abo Y, Sumita T, et al. Reactive lymphoid hyperplasia of the liver characterized by an angiofollicular pattern mimicking Castleman’s disease. Pathol Int. 1996 Oct;46(10):782–786.
- 20) Kim SR, Hayashi Y, Kang KB, Soe CG, Kim JH, Yang MK, et al. A case of pseudolymphoma of the liver with chronic hepatitis C. J Hepatol. 1997 Jan;26(1):209–214.
- 21) 西島 弘二, 清水 康一, 大西 一朗, 長谷部 健, 谷 卓, 橋本 哲夫,ほか.肝pseudolymphomaの1例.肝臓.1998;39(1):23–27.
- 22) Sato S, Masuda T, Oikawa H, Satoh T, Suzuki Y, Takikawa Y, et al. Primary hepatic lymphoma associated with primary biliary cirrhosis. Am J Gastroenterol. 1999 Jun;94(6):1669–1673.
- 23) Sharifi S, Murphy M, Loda M, Pinkus GS, Khettry U. Nodular lymphoid lesion of the liver: an immune-mediated disorder mimicking low-grade malignant lymphoma. Am J Surg Pathol. 1999 Mar;23(3):302–308.
- 24) Nagano K, Fukuda Y, Nakano I, Katano Y, Toyoda H, Nonami T, et al. Reactive lymphoid hyperplasia of liver coexisting with chronic thyroiditis: radiographical characteristics of the disorder. J Gastroenterol Hepatol. 1999 Feb;14(2):163–167.
- 25) Okubo H, Maekawa H, Ogawa K, Wada R, Sekigawa I, Iida N, et al. Pseudolymphoma of the liver associated with Sjögren’s syndrome. Scand J Rheumatol. 2001;30(2):117–119.
- 26) Pantanowitz L, Saldinger PF, Kadin ME. Pathologic quiz case: hepatic mass in a patient with renal cell carcinoma. Arch Pathol Lab Med. 2001 Apr;125(4):577–578.
- 27) 森 倫人, 古賀 靖大, 大楽 耕司, 岸川 正彦.肝pseudolymphomaの1例.肝臓.2002;43(8):376–380.
- 28) 奥濱 幸博, 兼城 隆雄, 大嶺 稔, 金城 隆夫, 真喜屋 實佑.肝pseudolymphomaの1例.消化器外科.2003;26(10):1557–1562.
- 29) 塩澤 健, 木下 秀樹, 鶴田 英夫, 中村 研二, 内藤 慎二, 古賀 満明,ほか.診断に生検が有用であった肝偽リンパ腫の1例.日本消化器病学会雑誌.2004;101(7):772–778.
- 30) Ota H, Isoda N, Sunada F, Kita H, Higashisawa T, Ono K, et al. A case of hepatic pseudolymphoma observed without surgical intervention. Hepatol Res. 2006 Aug;35(4):296–301.
- 31) Sato K, Ueda Y, Yokoi M, Hayashi K, Kosaka T, Katsuda S. Reactive lymphoid hyperplasia of the liver in a patient with multiple carcinomas: a case report and brief review. J Clin Pathol. 2006 Sep;59(9):990–992.
- 32) Takahashi H, Sawai H, Matsuo Y, Funahashi H, Satoh M, Okada Y, et al. Reactive lymphoid hyperplasia of the liver in a patient with colon cancer: report of two cases. BMC Gastroenterol. 2006;6:25.
- 33) Maehara N, Chijiiwa K, Makino I, Ohuchida J, Kai M, Kondo K, et al. Segmentectomy for reactive lymphoid hyperplasia of the liver: report of a case. Surg Today. 2006;36(11):1019–1023.
- 34) Willenbrock K, Kriener S, Oeschger S, Hansmann ML. Nodular lymphoid lesion of the liver with simultaneous focal nodular hyperplasia and hemangioma: discrimination from primary hepatic MALT-type non-Hodgkin’s lymphoma. Virchows Arch. 2006 Feb;448(2):223–227.
- 35) 高橋 広城, 松尾 洋一, 山本 稔, 沢井 博純, 佐藤 幹則, 岡田 祐二,ほか.大腸癌に合併した肝reactive lymphoid hyperplasiaの1例.日本消化器外科学会雑誌.2007;40(3):331–336.
- 36) Matsumoto N, Ogawa M, Kawabata M, Tohne R, Hiroi Y, Furuta T, et al. Pseudolymphoma of the liver: Sonographic findings and review of the literature. J Clin Ultrasound. 2007 Jun;35(5):284–288.
- 37) 宮本 久督, 伊牟田 真功, 山下 康行, 田中 洋, 別府 透, 馬場 秀夫,ほか.画像診断と病理 肝偽リンパ腫.画像診断.2007;27(11):1288–1289.
- 38) Machida T, Takahashi T, Itoh T, Hirayama M, Morita T, Horita S. Reactive lymphoid hyperplasia of the liver: a case report and review of literature. World J Gastroenterol. 2007 Oct;13(40):5403–5407.
- 39) Lin E. Reactive lymphoid hyperplasia of the liver identified by FDG PET. Clin Nucl Med. 2008 Jun;33(6):419–420.
- 40) Jiménez R, Beguiristain A, Ruiz-Montesinos I, Villar F, Medrano MA, Garnateo F, et al. Image of the month. Reactive lymphoid hyperplasia. Arch Surg. 2008 Aug;143(8):805–806.
- 41) Park HS, Jang KY, Kim YK, Cho BH, Moon WS. Histiocyte-rich reactive lymphoid hyperplasia of the liver: unusual morphologic features. J Korean Med Sci. 2008 Feb;23(1):156–160.
- 42) Okada T, Mibayashi H, Hasatani K, Hayashi Y, Tsuji S, Kaneko Y, et al. Pseudolymphoma of the liver associated with primary biliary cirrhosis: a case report and review of literature. World J Gastroenterol. 2009 Sep;15(36):4587–4592.
- 43) Fukuo Y, Shibuya T, Fukumura Y, Mizui T, Sai JK, Nagahara A, et al. Reactive lymphoid hyperplasia of the liver associated with primary biliary cirrhosis. Med Sci Monit. 2010;16(7):CS81–6.
- 44) Ishida M, Nakahara T, Mochizuki Y, Tsujikawa T, Andoh A, Saito Y, et al. Hepatic reactive lymphoid hyperplasia in a patient with primary biliary cirrhosis. World J Hepatol. 2010 Oct;2(10):387–391.
- 45) Zen Y, Fujii T, Nakanuma Y. Hepatic pseudolymphoma: a clinicopathological study of five cases and review of the literature. Mod Pathol. 2010 Feb;23(2):244–250.
- 46) Sibulesky L, Satyanarayana R, Menke D, Nguyen JH. Reactive nodular hyperplasia mimicking malignant lymphoma in donor liver allograft. Transplant Proc. 2010 Jun;42(5):1970–1972.
- 47) Hayashi M, Yonetani N, Hirokawa F, Asakuma M, Miyaji K, Takeshita A, et al. An operative case of hepatic pseudolymphoma difficult to differentiate from primary hepatic marginal zone B-cell lymphoma of mucosa-associated lymphoid tissue. World J Surg Oncol. 2011 Jan;9:3.
- 48) 鈴木 史恭, 横山 隆秀, 秋田 眞吾, 清水 明, 中田 岳成, 小林 聡,ほか.術前に肝細胞癌と診断された肝reactive lymphoid hyperplasiaの1例.日本消化器外科学会雑誌.2012;45(4):400–409.
- 49) 國土 典宏,長谷川 潔.手術 標準的な肝切除術式とは? 日本肝臓学会編.肝癌診療ガイドライン.東京:金原出版;2013. p. 80–83.