Abstract
肝腫瘍として見つかり,肝切除術後に原発不明神経内分泌癌(neuroendocrine carcinoma;以下,NECと略記)と診断された症例を経験したので報告する.症例は67歳の男性で,肝S6に20 mm大の腫瘤と肝門部リンパ節腫大が確認された.腫瘍が増大傾向にあり,PET-CTでもFDG集積が確認されたため,肝S6亜区域切除および肝門部リンパ節郭清を行った.切除標本でNECと診断され,肝S6に主病変以外にも12個の腫瘍があった.肝門部リンパ節転移もあり,原発不明NECの肝転移およびリンパ節転移と診断した.その後多発肝転移再発を認め,化学療法,オクトレオチド投与,肝ラジオ波焼灼術や肝動脈化学塞栓術による加療を行った.予後不良と考えられたが,術後34か月の生存が得られた.NECは予後不良とされるが,集学的治療により生存期間延長が期待できる可能性がある.
はじめに
神経内分泌腫瘍(neuroendocrine tumor;以下,NETと略記)および神経内分泌癌(neuroendocrine carcinoma;以下,NECと略記)は近年増加しつつあり,消化管もしくは気管支や肺の原発が多いとされる1).発見時には肝転移を伴っていることも多い.今回,肝S6亜区域切除および肝門部リンパ節郭清後に原発不明NECの多発肝転移およびリンパ節転移と診断された症例を経験した.予後不良と考えられたが,集学的治療により34か月間の生存が得られた.NEC肝転移の治療については定まったものがないが,集学的治療により生存期間の延長が期待できる可能性がある.NETおよびNEC(NETとNECを総称してneuroendocrine neoplasm;以下,NENと略記)の予後と治療法に関して文献的考察を加えて報告する.
症例
患者:67歳・男性,身長165 cm,体重55.0 kg,体表面積1.60 m2
主訴:特になし.
既往歴:慢性糸球体腎炎
現病歴:2010年4月,近医にてスクリーニングの腹部超音波検査で腹部腫瘤を指摘された.精査のためMRI撮影したところ,肝S6に20 mm大の腫瘤と肝門部に25 mm大のリンパ節腫大が確認された.画像的には肝血管腫が疑われていた.3か月後の腹部超音波検査とCT再検時に腫瘤増大傾向が確認され,PET-CTを施行したところ肝腫瘤および肝門部リンパ節へのFDG集積を認め当院紹介となった.
家族歴:特記事項なし.
現症:特記する所見なし.
来院時検査所見:AFP 10.8 ng/mlと上昇を認めた.クレアチニン1.21 mg/dl,BUN 18.1 mg/dlであった.
腹部超音波検査所見:肝S6にhaloを伴うhigh echoicな腫瘤あり.
CT所見:肝S6に30×26 mm大の低吸収域あり,早期濃染および後期相でのwash out,被膜様構造の濃染を認めた.肝門部に膵臓に接して25×21 mm大の腫大したリンパ節が指摘された(Fig. 1).
MRI所見:肝S6に,T1WIで低信号,脂肪抑制T2WIおよびfluid attenuated inversion recovery(以下,FLAIRと略記)で軽度高信号を呈する腫瘤あり.肝血管腫の可能性もあると考えられたが,血管腫としてはT2W1の所見が典型的ではなかった(Fig. 2).
PET-CT所見:肝S6腫瘤とリンパ節にFDG集積あり.SUV maxはそれぞれ通常相4.5・遅延相5.2,通常相2.7・遅延相3.5であった.
前医で肝S6腫瘍の生検が行われ,肝細胞癌との病理組織学的診断であった.以上より,肝S6肝細胞癌およびリンパ節転移と診断し,肝S6亜区域切除術および肝門部リンパ節郭清の予定となった.
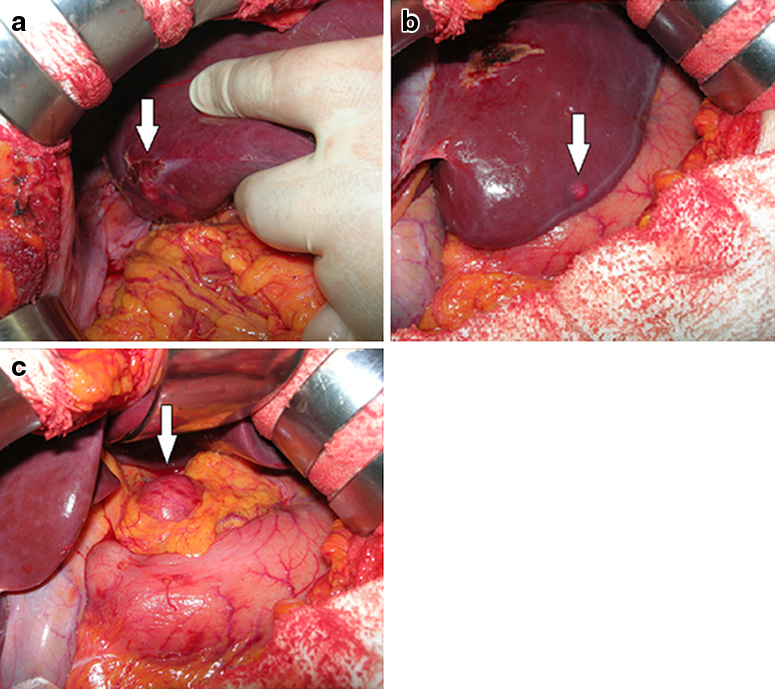
手術所見:2010年8月,手術を行った.開腹したところ,術中超音波検査で肝S6に主腫瘤以外に4個の結節があり,肝S3に1個,S8にも2個の結節を認めた(Fig. 3).肝S3の結節の切除を行い迅速病理組織学的診断に提出したところ,前医での肝S6腫瘍の生検結果と同様の肝細胞癌との結果が得られた.よって,肝S6(一部S7を含む)亜区域切除および肝門部リンパ節郭清を行った.肝S8の2結節はともにマイクロ波凝固を行った.
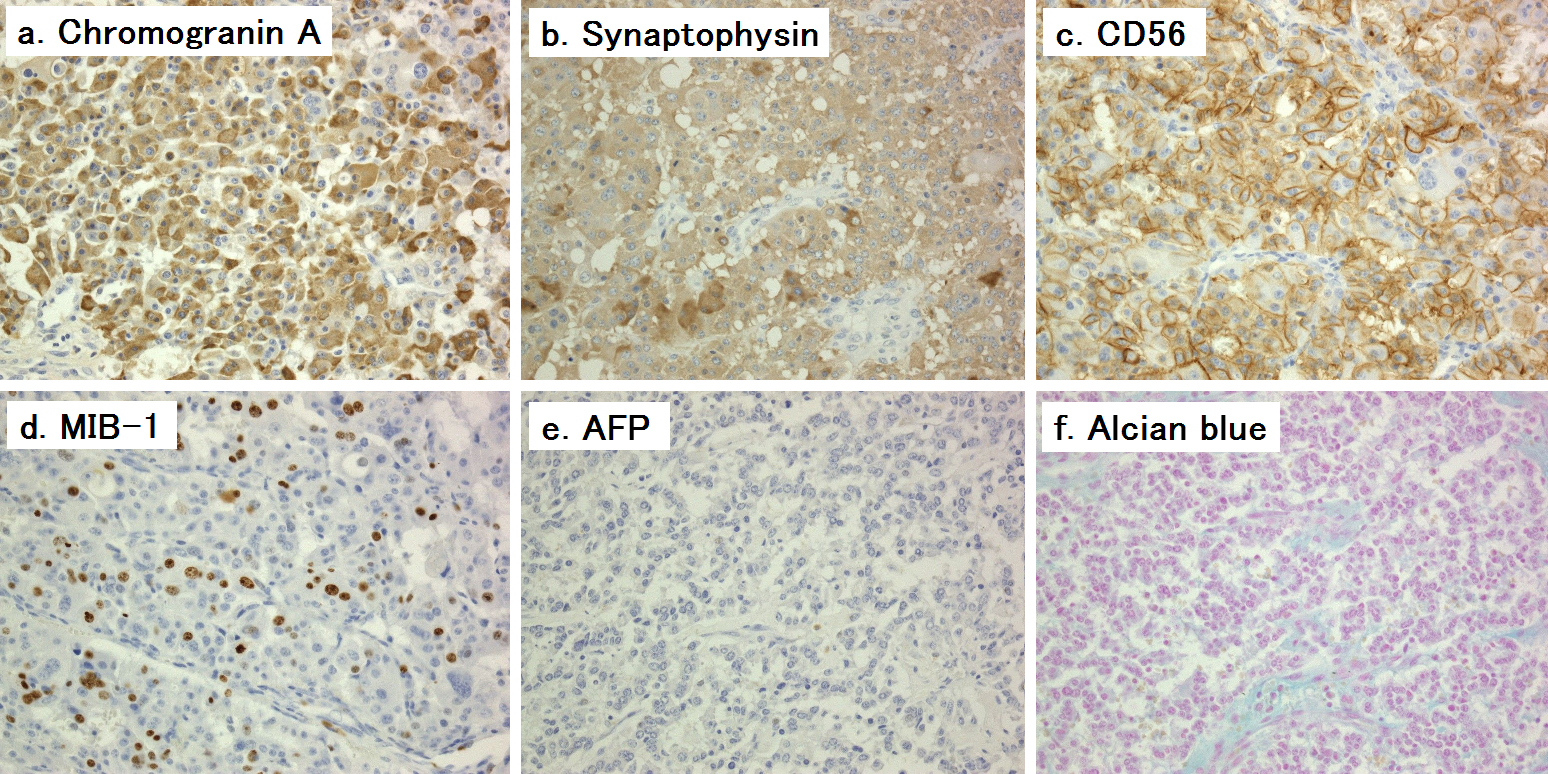
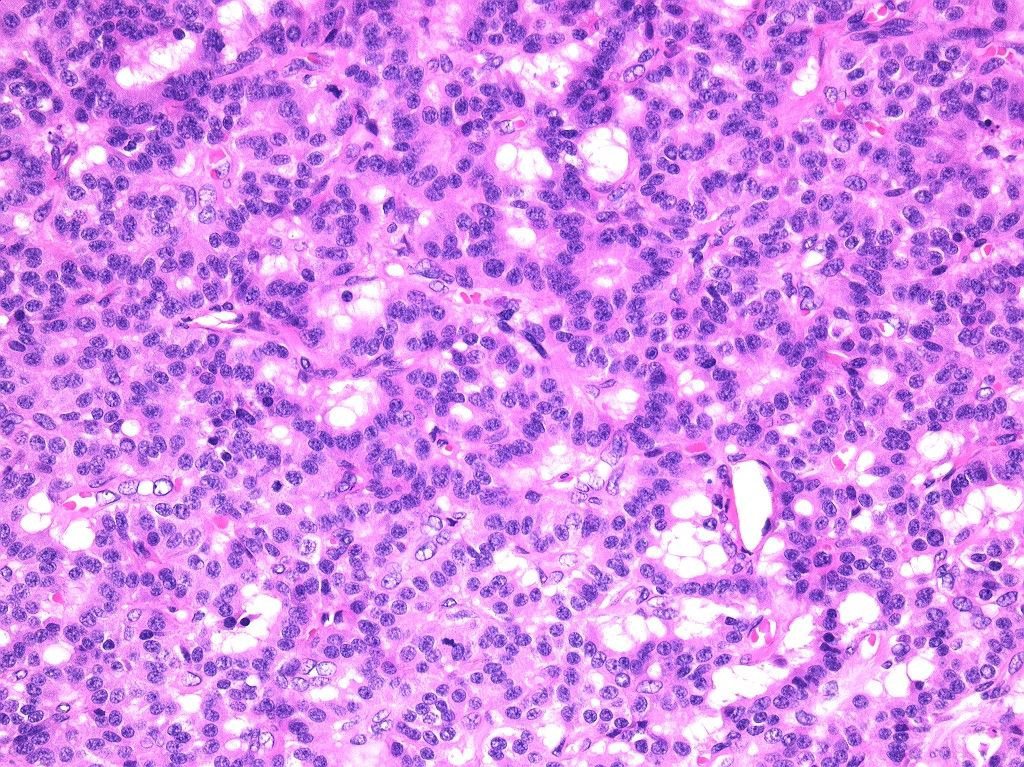
病理組織学的検査所見:肝S6には主病変以外にも12個のmicroscopic~4 mm程度の結節を認めた.腫大した#8aの1個のみ転移が確認できた.大型細胞で広い胞体や大型核,奇怪な核を有する異型の強い細胞が見られ,索状配列や腺様構造を示していた(Fig. 4).免疫染色検査では,synaptophysin陽性,chromogranin A陽性,CD56陽性,AFP陰性,Alcian blue陰性であり,術前の肝生検および術中の迅速病理組織学的診断では肝細胞癌とされていたがNENであった(Fig. 5).MIB-1 index:17%,核分裂像:22個/10 HPF(WHO分類の記載にある通り50 HPF以上観察済み)であり,病理組織学的分類は2010年版WHO分類でNECのlarge cell typeと判定された.
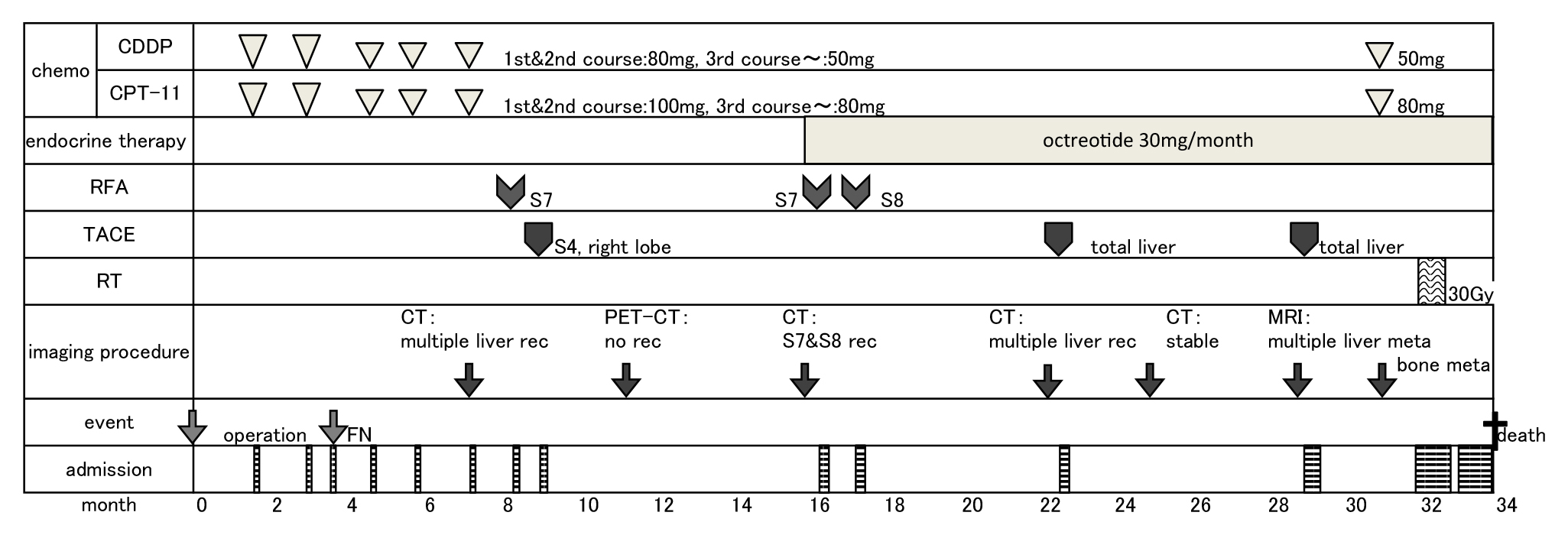
術後経過:肝臓に多発する肝細胞に分化傾向のない腫瘤であり,リンパ節転移も伴っていることから,肝原発というよりかは原発不明NECの肝転移およびリンパ節転移と考えられた.シスプラチン+イリノテカンによる術後補助化学療法を行った.シスプラチン80 mg/m2(day 1)+イリノテカン70 mg/m2(day 1)を4週間1コースのレジメンであったが,慢性枝球体腎炎で腎機能低下があるためシスプラチンを40%減量して80 mg,イリノテカンを100 mgとして投与した.2コース目終了後に発熱性好中球減少症を起こしたため,シスプラチン50 mg,イリノテカン80 mgに3コース目から投与量をさらに減量した.投与を継続したが,5コース目終了後の術後7か月で多発肝転移再発を指摘された.肝ラジオ波焼灼術(radiofrequency ablation;以下,RFAと略記)や肝動脈化学塞栓術(transarterial chemoembolization;以下,TACEと略記)を行い,また,ソマトスタチン受容体(somatostatine receptor;以下,SSTRと略記)2a陽性であったことからオクトレオチド投与も行った.これらの集学的治療を継続し,新たな肝転移再発が指摘されればRFAやTACEを行うことで病勢のコントロールはできていた.しかし,術後32か月に肝以外の転移再発として腹腔内リンパ節転移再発と多発骨転移再発が新たに見つかり,その後は急速に腫瘍が増大し術後34か月で死亡した.肝外転移再発が指摘されてから死亡するまでは入院となったものの,それ以外の期間は化学療法やTACEなどの治療に要するとき以外は外来で経過をみることができ,生活の質は良好に保たれていたと思われる.その経過を表に示す(Table 1).術後にPET-CTや上部および下部消化管内視鏡検査を行っているが,原発巣は最後まで不明のままであった.剖検は行わなかった.
考察
頻度は高くないものの,本症例のように肝腫瘤として発見される原発不明NENもある.Yaoら1)はSurveillance,Epidemiology and End Results(以下,SEERと略記)programのデータベースを用い,アメリカでの1973年から2004年の報告で,NENの35,618例中4,752例(13.3%)が原発不明であったと報告している.Spigelら2)は99例の原発不明NENで,腫瘍の部位は後腹膜20例,リンパ節14例,縦隔12例,肝臓12例,骨11例,その他16例,多発14例であったと報告している.しかし,欧米と日本では発症部位や症状に違いがあることが知られている.Itoら3)4)が本邦における疫学調査を行っており,消化管と膵臓のNENについて述べられているが,原発不明の頻度については明らかではない.
1983年から2013年までで医学中央雑誌で「神経内分泌腫瘍」と「原発不明」をキーワードとして検索(会議録を除く)した結果,症例報告が7例あるのみであった(Table 2)5)~11).平均年齢は62.8歳(40~77歳,年齢不詳の1例を除く),男女比は男性:女性=1:6であった.最初に腫瘍を指摘された部位として肝臓が2例で最も多かった.リンパ節腫脹で発見された症例が3例あったが,その部位はそれぞれ縦隔,膵頭十二指腸周囲,鼠径部といずれも異なっていた.治療は,手術可能であった症例はまず切除術が行われており,手術不能例や術後再発では化学療法が行われていた.松毛ら5)は,初回手術で病変は画像上切除できているものの,原発巣不明NECであり予後不良と考えられたため,肺小細胞癌に準じて術後補助化学療法を行ったと報告している.シスプラチン+エトポシド投与を行い,その後肺原発巣が判明し増大を認めたためカルボプラチン+エトポシド投与を行っている.田丸ら11)はスニチニブ投与により11か月間の無増悪期間が得られたと報告している.スニチニブは膵神経内分泌腫瘍に対し保険適応が追加されたが,膵臓以外の神経内分泌腫瘍に対しては保険適応となっていないものの効果が期待される.多発肝転移再発に対して廣瀬ら8)はTAEを繰り返し行い,長期の生存が得られたとしている.
Table 2
Reported cases of neuroendocrine tumor and neuroendocrine carcinoma with initially unidentifiable primary sites
| Case |
Author/Year |
Age/
Sex |
First indication |
Tumor size (mm) |
Source of sample |
Primary lesion |
Period from first indication (month) |
WHO classification |
Treatment |
Prognosis |
Survival period (month) |
Autopsy |
| 1 |
Matsuge5)
/1999 |
64/M |
mediastinal LN |
50 |
Surgical resection |
lung |
2 |
NEC |
surgical resection chemotherapy |
death |
28 |
– |
| 2 |
Nishimori6)
/2005 |
40/M |
maxillary sinus |
30 |
Autopsy |
pancreas |
8 |
unknown |
chemotherapy |
death |
13 |
+ |
| 3 |
Kimura7)
/2007 |
fifties/M |
adrenal gland |
90 |
Biobsy Autopsy |
unknown |
|
unknown |
none |
death |
1 |
+ |
| 4 |
Hirose8)
/2010 |
71/M |
liver |
unknown |
Surgical resection |
ileum |
39 |
unknown |
surgical resection TAE |
death |
78 |
– |
| 5 |
Ueda9)
/2010 |
73/M |
pancreaticoduodenal LN |
40 |
Surgical resection |
unknown |
|
NEC |
surgical resection |
alive |
12 |
– |
| 6 |
Hisamori10)
/2010 |
77/M |
inguinal LN |
unknown |
Surgical resection |
unknown |
|
NEC |
surgical resection |
alive |
36 |
– |
| 7 |
Tamaru11)
/2013 |
52/F |
liver
mesentery |
26 |
Biobsy |
unknown |
|
NET G2 |
chemotherapy |
alive |
11 |
– |
| 8 |
Our case |
67/M |
liver hepatoduodenal ligament LN |
25 |
Surgical resection |
unknown |
|
NEC |
surgical resection chemotherapy RFA, TACE |
death |
34 |
- |
LN: lymph nodes, TAE: transcatheter arterial embolization, TACE: transarterial chemoembolization, RFA: radiofrequency ablation, NET: neuroendocrine tumor, NEC: neuroendocrine carcinoma
前述の原発不明NENの報告7例のうち原発巣がのちに判明したものは3例であった.廣瀬ら8)の報告では肝転移NETの切除術後に39か月を経て原発巣が判明している.海外の文献でも原発巣が判明するまでに2年を要した症例が報告されている12).よって,肝NENが見つかった場合,原発とするかどうかは慎重な判断を要すると思われる.肝原発NENの報告は散見されるが,2年以下の経過観察期間で報告されているものや短期間での死亡例もあり,肝原発として良いかについては疑問が残るものもある.本症例は34か月で死亡するまで原発巣と考えられる病変は指摘できなかった.しかし,前述のとおりリンパ節転移を伴う肝臓に多発する腫瘍であることから,原発不明NECの肝転移と考えるのが妥当であろう.
原発不明NENの局在診断としては,CT,MRI,PET,選択的動脈内刺激薬注入法(selective arterial secretagogue injection test;以下,SASI testと略記),ソマトスタチン受容体シンチグラフィ(somatostatin receptor scintigraphy;以下,SRSと略記)などがある.SASI testは機能性NENに有効であり,カルシウムなどの刺激薬物をカテーテルを用いて血管選択的に動注し,肝静脈に留置したカテーテルからホルモン値の上昇を見る検査である.SRSは,膵NENでは高頻度にSSTR 2a,5を発現していることを利用した検査で,全身検索に有用であるが,試薬が日本未承認である.その他,各種内視鏡検査で消化管内の検索を行うことも必要である.
本症例では前医での肝生検結果と術中迅速診断でともに肝細胞癌と診断されており,肝切除後の最終診断でNECと確定診断された.このようにNENは肝細胞癌と組織像が類似することがある12).Core needle biopsyでは,肝転移性NEN 10件中4件で肝細胞癌と判定されたという報告もあり,注意を要する13).本症例ではAFPが若干高値であった.もし画像上肝腫瘤が多発していたら,全く違う治療方針になっていたと思われる.
NECの薬物治療としては,小細胞肺癌の治療に準じ白金製剤をベースとした多剤併用療法が行われてきた.おもにシスプラチン+エトポシドまたはシスプラチン+イリノテカンが使用されている.また,オクトレオチド投与によりホルモン由来の症状改善だけでなく腫瘍縮小効果もみられることがある14).本症例はシスプラチン+イリノテカンによる化学療法を行い,腫瘍縮小効果を狙ってオクトレオチド投与も行った.オクトレオチド投与による腫瘍縮小効果がどれほど得られたかは判断が難しいが,大きな副作用なく使用しやすいため,本症例でも最後まで使用を続けた.
Manmalian target of rapamycin(以下,mTORと略記)阻害薬であるエベロリムスも治療薬として期待されている.エベロリムスは高分化型または中分化型の膵NETに対しての適応があり,無増悪生存期間をプラセボ群の4.6か月に対し11.0か月と,2.4倍に延長させたことが報告されている15).この中のサブグループ解析で,高分化型よりも中分化型NETで低いハザード比だったことが示されており,NETだけでなくNECにも効果がある可能性がある.さらに,NECではNETよりもmTOR発現率が高いとの報告もあり16),現在エベロリムスはNEC治療の適応になっていないものの,有用性が期待される.
SEERのデータベースより,Yaoら1)は高分化型NET患者の生存期間中央値は124か月,低分化型NET(2010年WHO分類のNECに相当)は生存期間中央値10か月と報告している.本症例では,肝切除術後にNECと診断された.残念ながら術後7か月目に多発肝転移再発を指摘されたものの,化学療法,RFA,TACE,オクトレオチド投与などにより術後34か月の生存が得られた.NECの肝転移切除については定まった評価がなく,本症例は原発巣が不明のままであったものの,画像上R0手術が行えておりその後の集学的治療法により比較的長期の予後が得られた.NECは予後不良とされるが,集学的な治療により予後改善が期待できる可能性があると考えられた.
利益相反:なし
文献
- 1) Yao JC, Hassan M, Phan A, Dagohoy C, Leary C, Mares JE, et al. One hundred years after “carcinoid”: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol. 2008;26(18):3063–3072.
- 2) Spigel DR, Hainsworth JD, Greco FA. Neuroendocrine carcinoma of unknown primary site. Semin Oncol. 2009;36(1):52–59.
- 3) Ito T, Tanaka M, Sasano H, Osamura YR, Sasaki I, Kimura W, et al. Preliminary results of a Japanese nationwide survey of neuroendocrine gastrointestinal tumors. J Gastroenterol. 2007;42(6):497–500.
- 4) Ito T, Sasano H, Tanaka M, Osamura RY, Sasaki I, Kimura W, et al. Epidemiological study of gastroenteropancreatic neuroendocrine tumors in Japan. J Gastroenterol. 2010;45(2):234–243.
- 5) 松毛 真一, 細川 誉至雄, 佐藤 一人, 村上 洋平, 山川 智士, 畠山 広巳,ほか.縦郭リンパ節転移を初発症状としたlarge cell neuroendocrine carcinomaの1例.日本胸部臨床.1999;58(9):668–672.
- 6) 西森 久和, 高橋 俊二, 永崎 栄次郎, 小林 隆之, 横山 雅大, 篠崎 英司,ほか.原発特定が不可能であった転移性膵内分泌腫瘍の1剖検例.癌と化学療法.2005;32(5):671–673.
- 7) 木村 優子, 橋本 朋子, 大和田 雅彦, 菅原 隆, 川村 実, 佐熊 勉.原発臓器同定に苦慮した右副腎巨大腫瘤を伴う大細胞性神経内分泌癌の1剖検例.岩手県立病院医学会雑誌.2007;47(1):32–36.
- 8) 廣瀬 淳史, 伏田 幸夫, 木下 淳, 尾山 勝信, 藤村 隆, 太田 哲生.多発肝転移・腸間膜リンパ節転移・腹膜播種を伴った回腸カルチノイドの長期生存の1例.日本臨床外科学会雑誌.2010;71(8):2033–2037.
- 9) 上田 純志, 相本 隆幸, 中村 慶春, 廣井 信, 山初 和也, 早川 朋宏,ほか.十二指腸癌を合併し診断に難渋した原発不明神経内分泌細胞癌リンパ節転移と考えられた1例.日本消化器病学会雑誌.2010;107(12):1941–1946.
- 10) Hisamori S, Okabe H, Yoshizawa A, Sakai Y. A case of long-term recurrence-free poorly differentiated neuroendocrine carcinoma of lymph nodes treated by surgical resection without any chemotherapy. Int J Clin Oncol. 2010;15(5):493–496.
- 11) 田丸 智巳, 水野 聡朗, 小田 裕靖, 菅原 由美子, 齋藤 佳菜子, 山下 芳樹,ほか.スニチニブにて長期間Stable Diseaseが得られた高分化型神経内分泌腫瘍の1例.癌と化学療法.2013;40(9):1237–1240.
- 12) Arista-Nasr J, Fernández-Amador JA, Martínez-Benítez B, de Anda-González J, Bornstein-Quevedo L. Neuroendocrine metastatic tumors of the liver resembling hepatocellular carcinoma. Ann Hepatol. 2010;9(2):186–191.
- 13) Prosser JM, Dusenbery D. Histocytologic diagnosis of neuroendocrine tumors in the liver: a retrospective study of 23 cases. Diagn Cytopathol. 1997;16(5):383–391.
- 14) Rinke A, Müller HH, Schade-Brittinger C, Klose KJ, Barth P, Wied M, et al. Placebo-controlled, double-blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors: a report from the PROMID Study Group. J Clin Oncol. 2009;27(28):4656–4663.
- 15) Yao JC, Shah MH, Ito T, Bohas CL, Wolin EM, Van Cutsem E, et al. Everolimus for advanced pancreatic neuroendocrine tumors. N Engl J Med. 2011;364(6):514–523.
- 16) Catena L, Bajetta E, Milione M, Ducceschi M, Valente M, Dominoni F, et al. Mammalian target of rapamycin expression in poorly differentiated endocrine carcinoma: clinical and therapeutic future challenges. Target Oncol. 2011;6(2):65–68.