2015 年 48 巻 2 号 p. 165-171
2015 年 48 巻 2 号 p. 165-171
症例は77歳の男性で,1990年に膀胱癌に対して膀胱全摘+Indiana pouch造設術を施行した.2012年7月に血尿を認め,CTでIndiana pouch内に隆起性病変,リンパ節転移,多発肝転移を認めた.Indiana pouch内の腫瘍からの生検で大腸高分化腺癌と診断された.遠隔転移を伴う大腸癌であり,まずmFOLFOX6+bevacizumab療法を6クール施行した.化学療法後に原発巣およびリンパ節転移,肝転移の縮小を認め,Indiana pouch摘出術+尿管皮膚瘻造設を施行した.以降,化学療法を継続中である.Indiana pouch内に発生した大腸癌の報告は現在までに自験例を含めて11例のみであり,非常にまれである.若干の文献的考察を含めて報告する.
尿路再建に腸管を利用することは,1852年に尿管S状結腸吻合術が発表されて以来,150年以上の歴史があり,尿路再建後の腸管腺癌の発生報告が散見される1).そのうち,膀胱全摘後の大腸・小腸を用いた代用膀胱であるIndiana pouch内に発生した大腸癌の報告は非常にまれである.今回,我々は膀胱全摘術後22年目にIndiana pouch内に発生した大腸癌に対して化学療法施行後,手術を行った症例を経験したため,若干の文献的考察を含めて報告する.
患者:77歳,男性
主訴:血尿
既往歴:高血圧,68歳時に右肺癌に対して右下葉切除術を施行.
嗜好歴:アルコール 機会飲酒,タバコ 20本/日×35年,20年前から禁煙中.
現病歴:1990年に膀胱癌(T1a,ly1,v(+),N(–))に対して膀胱全摘+Indiana pouch造設術(Fig. 1)を施行した.術後は再発なく経過し,近医通院中であった.2012年7月に血尿が出現し,精査のCTでIndiana pouch内の隆起性病変,腹腔内リンパ節腫大,肝臓内の多発腫瘤を指摘された.Indiana pouch内の隆起性病変からの生検でtubular adenocarcinomaが検出され,当科紹介となった.

The Indiana pouch is a composite structure using an ileal patch and cecum. The antireflux mechanism is provided with tunneled ureteral implantation along the tenia of the cecum.
身体所見:身長163.3 cm,体重67.5 kg.結膜に貧血,黄疸なし.腹部は平坦・軟で,圧痛なし.腫瘤も触知せず.上下腹部正中に手術痕あり,臍右に代用膀胱開口部あり.
血液検査所見:WBC 10,400/μl,RBC 450×104/μl,Hb 14.7 g/dl,Ht 42.2%,Plt 21.6×104/μl,Na 143 mEq/l,K 3.6 mEq/l,Cl 106 mEq/l,BUN 16 mg/dl,Cr 0.91 mg/dl,TP 7.6 g/dl,Alb 4.2 g/dl,T-Bil 1.4 mg/dl,I-Bil 1.2 mg/dl,AST 27 U/l,ALT 28 U/l,LDH 244 U/l,CK 133 U/l,AlP 214 U/l,γ-GTP 31 U/l,CRP 4.6 mg/dl.軽度の炎症反応上昇を認めた.腫瘍マーカーは,CEA 28.8 ng/ml,CA19-9 248.0 U/mlと上昇していた.
膀胱鏡検査所見:Indiana pouch内に境界明瞭な隆起性病変を認めた(Fig. 2).生検結果は,tubular adenocarcinoma(tub1>tub2)であった.
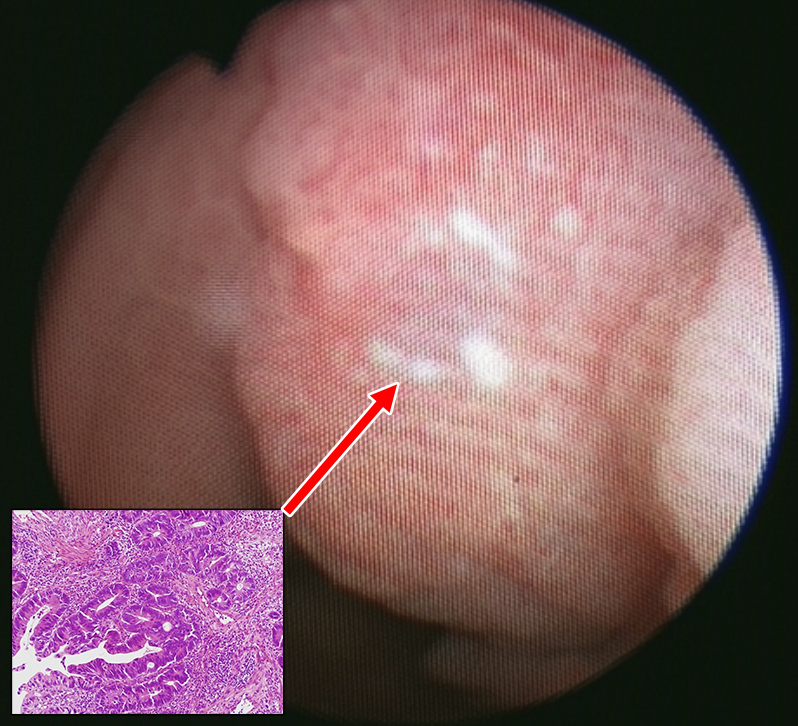
Pouchscopy (pre-chemotherapy). A tumor is detected in an Indiana pouch and biopsy of specimens led to the diagnosis of colon cancer adenocarcinoma (tub1).
胸腹部CT所見:Indiana pouch頂部に腹壁浸潤を伴う壁肥厚を認めた(Fig. 3).回結腸動脈周囲に腫大したリンパ節が数個あり,右腎門部に造影効果のある腫瘤を認めた.肝臓内には3~10 mm大の転移巣を7か所認めた(Fig. 4).腹水,腹膜転移,肺転移は認めなかった.
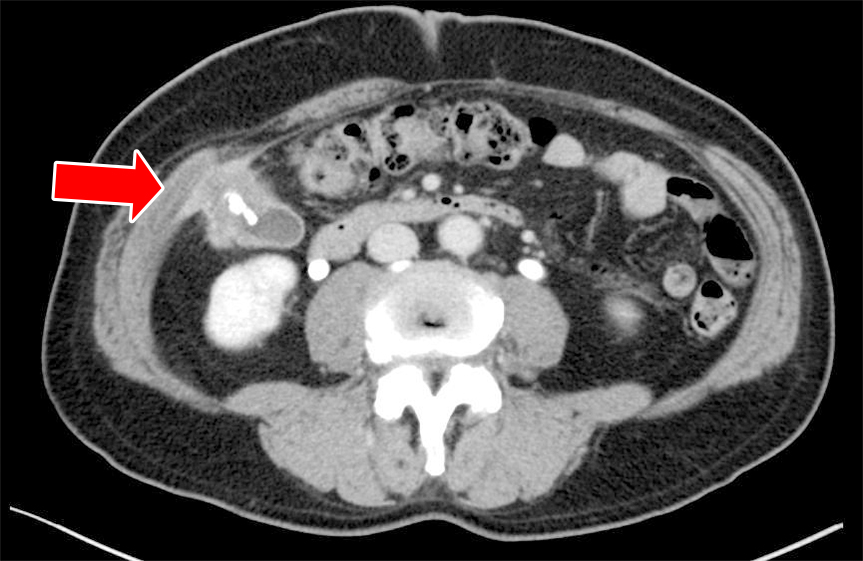
Abdominal enhanced CT (pre-chemotherapy) shows raised lesions in the Indiana pouch (arrow).
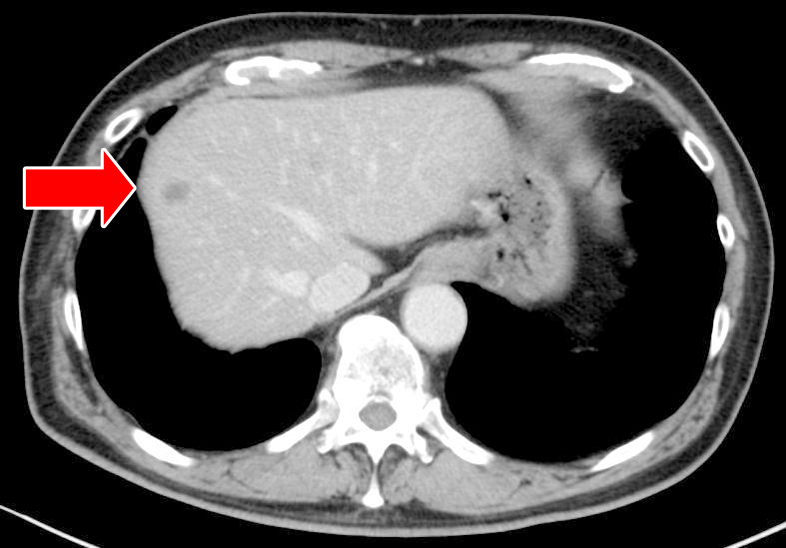
Abdominal enhanced CT (pre-chemotherapy) shows multiple metastases (arrow).
臨床経過:colon cancer,A,type 1,T4b(SI:腹壁),N2,M1b(H2:grade C,LYN),Stage IVと診断した.遠隔転移を伴う大腸癌であり,化学療法を行う方針とした.mFOLFOX6+bevacizumab(以下,BVと略記)療法を6クール施行した(BVは4クールのみ施行).化学療法開始後から徐々に腫瘍マーカーは低下し,6クール終了後には全て正常化した.
膀胱鏡検査所見(化学療法後):腫瘍の隆起部分は平坦化し,著明に縮小していた(Fig. 5).

Pouchscopy (post-chemotherapy) shows a tumor scarring.
胸腹部CT所見(化学療法後):原発巣およびリンパ節,右腎門部の腫瘤の縮小を認めた.しかし,原発巣の腹壁への浸潤は残存していた(Fig. 6).肝転移巣は,全て縮小し,確認できるのは2個のみであった(Fig. 7).
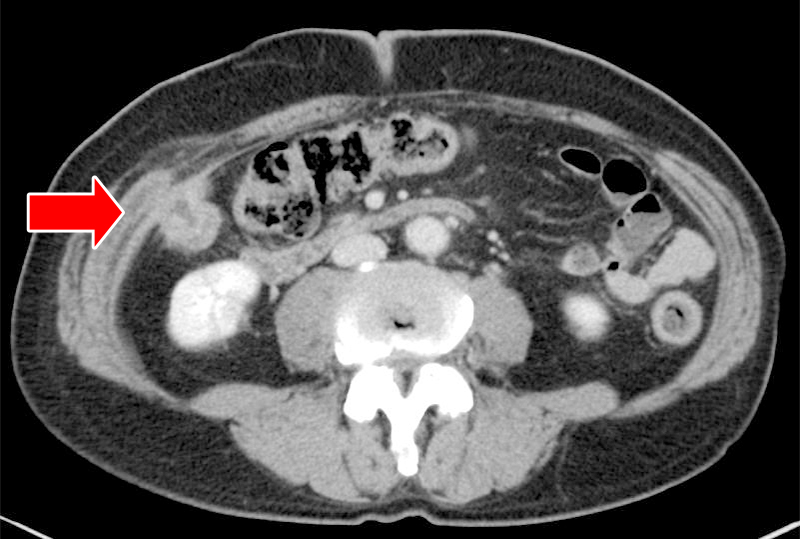
Abdominal enhanced CT (post-chemotherapy) shows reduction of the tumor in the Indiana pouch (arrow).
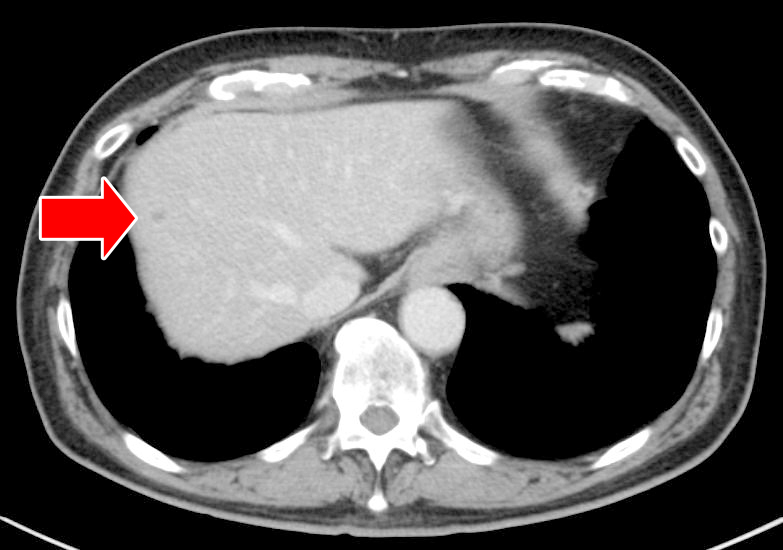
Abdominal enhanced CT (post-chemotherapy). Multiple liver metastases are reduced.
以上の検査結果より,腫瘍は縮小傾向で,新規病変の出現も認めないため,手術の方針とした.
手術所見:Indiana pouch頂部に腹壁浸潤を伴う腫瘍を認めた.腹腔内は高度の癒着を認めたが,右結腸切除術(D3郭清)を行う形で血管処理をし,浸潤した腹壁も含めて代用膀胱切除を施行後,尿管皮膚瘻を造設した.術中エコーを用いて肝臓内の検索を行ったが,明らかな腫瘤は指摘されず,肝切除は施行しなかった.
摘出組織肉眼的所見:Indiana pouch頂部に腹壁浸潤を伴う4.7 cm×3.3 cm大の腫瘍を認めた(Fig. 8).ゾンデは両側の尿管に通してあり,腫瘍の位置は,両側の尿管吻合部から離れていた.
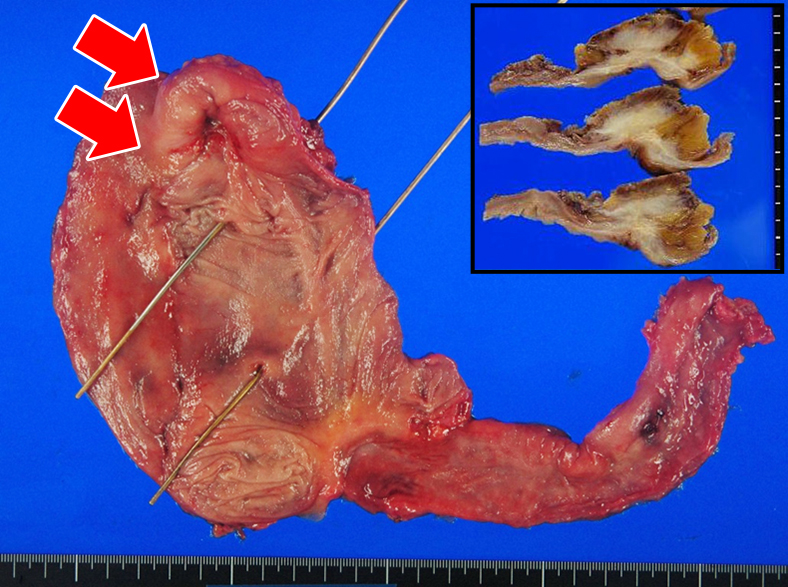
A large 4.7×3.3 cm tumor (arrows) develops in a segment of the ascending colon. Tumor has invaded into the abdominal wall.
病理組織学的検査所見:腫瘍部分には,moderately differentiated tubular adenocarcinoma(tub2)の増殖を認め,腹壁まで浸潤していた(Fig. 9).尿管開口部ならびに剥離面には明らかな腫瘍は認めなかった.主リンパ節一つに転移を認めた.腎門部の腫瘤もtub1と診断され,腹膜播種であった.
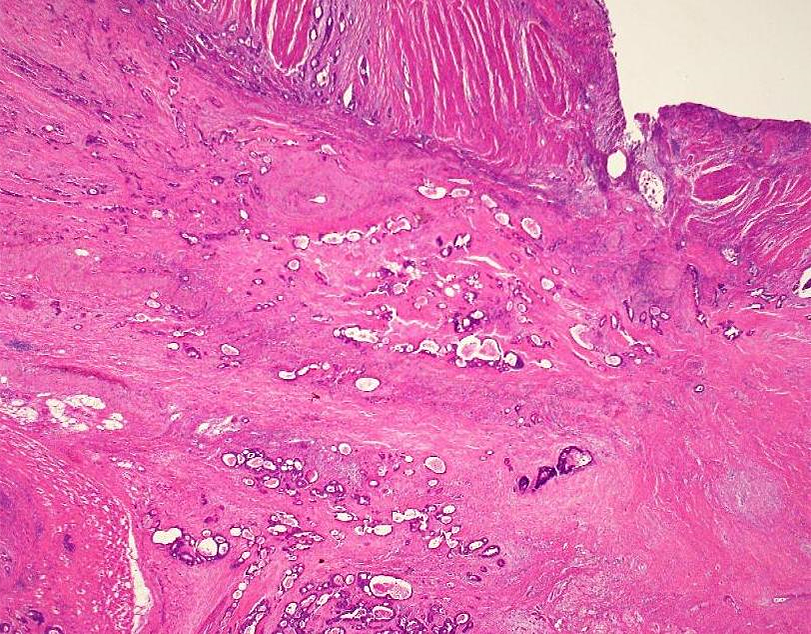
Histological examination demonstrates moderately differentiated tubular adenocarcinoma (tub2) that invades into the abdominal wall.
以上より,最終診断はcolon cancer,4.7×3.3 cm,A,type 1,tub2,T4b(SI:腹壁),int,INFb,ly2,v1,N3(1/16),M1b(H2:grade C,P1),Stage IVであった.術後は創部感染症を合併したが,抗生剤投与および洗浄にて軽快した.術後7週目より化学療法としてmFOLFOX6療法を開始した.3クール目施行時にオキサリプラチンによると思われるinfusion reactionが出現したため,mFOLFOX6療法の継続は困難と判断し,ロイコボリン/テガフール・ウラシルの内服へと変更し,術後10か月無再発生存中である.
尿路再建に腸管を利用することは,1852年に尿管S状結腸吻合術が発表されて以来,150年以上の歴史を持つ.尿路再建術後の腸管腺癌の発生報告は散見されるが,尿路として利用された腸管の発癌性を調べる疫学調査は存在しないため,正確な数は不明である.さまざまな術式がある中で尿管S状結腸吻合術では術後の結腸腺癌発生率の上昇が広く知られており,結腸癌の発生リスクは25~30歳では477倍,55~69歳では8倍高いという報告がある2).動物実験モデルにより尿と糞便の混合が発癌の原因と結論付けられてはいるが,発癌のメカニズムに関してはさまざまな機序の関与が提唱されており,詳細はいまだ明らかになっていない1).尿管S状結腸吻合術以外では,回腸や結腸などの遊離腸管を利用した術式がある.Austenら3)によると,回腸導管の発癌は7例であり,そのうち3例が腺癌であった.回腸導管は非禁制型尿路変向術のgold standardとされ,世界中で多用されている術式であり,その中での発現頻度としては低いと思われる.また,代用膀胱では,回腸のみを利用した代用膀胱に発生した癌の報告は1例のみであった4).それに比べ,Indiana pouch や結腸代用膀胱,尿禁制型パウチなどの結腸を利用した代用膀胱に発生した癌の報告は10例以上あるとされる3).報告症例数が異なるのは,正確な疫学調査が存在しないことも原因と考えるが,回腸に比べて結腸本来の発癌性が高いことも原因の一つと推察される.このため,尿路再建に結腸を用いた場合には,大腸腺癌発生を念頭に置いて定期的な検査を行う必要がある.
PubMed(1950年から2013年3月まで)にて「Indiana pouch」,「colon cancer」,医中誌Web(1983年から2013年3月まで)にて「Indiana pouch」,「大腸癌」をキーワードに検索したところ,Indiana pouch内に発生した大腸腺癌の報告は現在までに自験例を含めて11例の報告を認めるのみであった(Table 1)5)~13).11例の報告例をまとめると,年齢は63~77歳(中央値73歳),膀胱癌術後2年~22年(中央値10年)の経過を経て大腸腺癌を発症していた.主訴は血尿が7例と最も多く,その他は導尿困難が3例,腹痛が1例であり,全例とも症状の出現後に検査を施行し癌が発見されていた.深達度は,SMが2例,MP以深が8例であり,報告のあった7例中4例に遠隔転移を認め,症状を有してからでは癌が進行している場合が多く,早期での症状の発現率は少ないと考えられた.
| No | Author | Year | Age | Sex | Chief complaint | Time between creation of the Indiana pouch (years) | Treatment | Outcome and follow-up |
|---|---|---|---|---|---|---|---|---|
| 1 | Lisle5) | 2000 | 76 | M | hematuria | 6 | Operation | No recurrence at 6 months |
| 2 | Gazzaniga6) | 2000 | 73 | M | difficulty with catheterization | 2 | Operation | No recurrence at 9 months |
| 3 | L’Esperance7) | 2001 | 72 | F | hematuria | 5.5 | Operation | — |
| 4 | Uesugi8) | 2002 | 71 | M | hematuria | 9.5 | Operation | No recurrence at 5 months |
| 5 | Komai9) | 2005 | 63 | F | difficulty with catheterization | 6 | Operation→Chemotherapy | Deceased at 17 months |
| 6 | Ho10) | 2007 | 66 | F | hematuria | 17 | — | — |
| 7 | Saito11) | 2007 | 76 | F | stomachache | 15 | Operation (EMR) | No recurrence at 15 months |
| 8 | Ikeda12) | 2010 | 76 | M | difficulty with catheterization | 11 | Chemotherapy | Deceased at 4 months |
| 9 | Jian13) | 2012 | 73 | F | hematuria | 10.5 | Operation | No recurrence at 36 months |
| 10 | Jian13) | 2012 | 77 | M | hematuria | 9 | Operation | Deceased at 3 months |
| 11 | Our case | 77 | M | hematuria | 22 | Chemotherapy→Operation | No recurrence at 10 months |
診断は,尿細胞診や尿路造影,CT,膀胱鏡が施行されていた.尿細胞診にて,腺癌細胞を認め確定診断に至った症例もあるが,Indiana pouch内の尿にはさまざまに変性した腸上皮細胞,移行上皮細胞,白血球,大腸菌等の細菌など多数の成分を認めるため,判定に苦慮し,複数回の検査を要した例も見られた.一方,膀胱鏡では,直接Indiana pouch内を観察し生検の施行が可能であること,さらにIndiana pouch内の腫瘍が大腸粘膜または尿管結腸吻合部から発生したかの鑑別が治療方針の選択のうえで重要であり,診断と治療に最も有効な検査であると考えられる.Indiana pouchの入口部は非常に狭く通常のファイバーは通過できず,これまでは検査困難であった.しかし,近年では高画質の細径ファイバーが開発されており,スクリーニング検査が容易に可能な環境となっている.
治療は,記載のあった10例では手術および化学療法が施行されていた.手術は9例(うち2例は化学療法を併用)であり,化学療法単独は1例のみであった.術式としては,内視鏡的粘膜切除術が1例,開腹手術が8例(代用膀胱全摘7例,代用膀胱部分切除1例)であった.遠隔転移を有する進行大腸癌は自験例を含めて4例であった.予後の記載は9例にあり,期間は3~36か月で,中央値は9か月であった.
自験例では,発見時に肝転移およびリンパ節転移を認める進行癌であったが,通常の大腸癌と同様,分子標的治療薬を用いた化学療法が有効であり,原発巣ならびに転移巣の縮小を認め,手術が施行しえた.手術に関しては,解剖の変位や強度の癒着を認めるものの,通常どおりのリンパ節郭清が施行可能であり,積極的な手術が予後の改善に関与すると考えられた.
利益相反:なし