2016 年 49 巻 12 号 p. 1222-1228
2016 年 49 巻 12 号 p. 1222-1228
症例は43歳の男性で,腹痛にて前医を受診し,胆石性膵炎の診断で入院した.翌日の腹部CTで壊死性膵炎が疑われ,当院救命救急センターに転院となり,保存的加療を行った.入院後21日の腹部CTで膵体部を中心に壊死腔が形成されていた.保存的加療を継続するも壊死腔が増大したため,入院後57日に超音波ガイド下で壊死腔にドレナージチューブを挿入し,入院後66日にvideo-assisted retroperitoneal debridement(以下,VARDと略記)を施行した.手術時間は215分,出血量は90 mlであった.合併症を認めず,術後32病日に退院した.感染性膵壊死に対する主たる治療は,ネクロセクトミーやドレナージであり,近年では低侵襲性を考慮した超音波内視鏡検査下経胃ネクロセクトミーなどが報告がされている.今回,我々は感染性壊死性膵炎に対して,VARDが有効であった症例を経験したため報告する.
現在でも,重症急性膵炎で死に至る例は多い1).さらに,壊死性膵炎に併発する膵周囲滲出液に感染がみられると死亡率は高くなる2)~5).
感染性膵壊死に対する主たる治療は,ネクロセクトミー6)やドレナージであり,近年では低侵襲性を考慮した超音波内視鏡検査(endoscopic ultrasonography;以下,EUSと略記)下経胃ネクロセクトミー7)や,video-assisted retroperitoneal debridement(以下,VARDと略記)4)8)の報告がされている.
今回,我々は感染性壊死性膵炎に対してVARDが有効であった症例を経験したため,文献的考察を加え報告する.
症例:43歳,男性
主訴:腹痛
既往歴:高血圧
飲酒歴:なし.
喫煙歴:なし.
現病歴:以前から食後の腹痛を繰り返していたが,就寝中に腹痛が出現し,血液が混入した嘔吐を繰り返すため,救急車を要請し,近医に搬送された.腹部CT,血液生化学検査にて,胆石性膵炎を疑い,緊急ERCPを施行し,内視鏡的経鼻胆道ドレナージチューブを挿入された.翌日,腹部CTにて,膵尾部に広範な造影不良域を認め,壊死性膵炎の疑いにて,当院救命救急センターに搬送された.
当院入院時現症:腹部平坦,軟.全体に圧痛はあるが筋性防御や反跳痛はなかった.血圧142/80 mmHg,体温38.1°C,呼吸数20回/分,脈拍127回/分であった.
血液検査所見:アミラーゼ,リパーゼ,ビリルビン,肝胆道系酵素,白血球,CRPの上昇と,アルブミン,カルシウムの低下を認めた(Table 1).
| Hematology | Amy | 1,191 IU/l | |
| WBC | 19,200/μl | lipase | 1,243 IU/l |
| RBC | 510×104/μl | ChE | 287 IU/l |
| Hb | 16.7 g/dl | BUN | 19.0 mg/dl |
| Ht | 47.1% | Cre | 0.76 mg/dl |
| Plt | 19.0×104/μl | Na | 137 mEq/l |
| K | 4.2 mEq/l | ||
| Blood chemistry | Cl | 102 mEq/l | |
| TP | 6.2 g/dl | Ca | 6.8 mg/dl |
| Alb | 3.3 g/dl | CRP | 26.9 mg/dl |
| Glucose | 156 mg/dl | ||
| T-Bil | 2.9 mg/dl | Coagulation | |
| D-bil | 1.5 mg/dl | PT | 86.0% |
| AST | 84 IU/l | APTT | 29.8 sec |
| ALT | 304 IU/l | Fib | 606 mg/dl |
| ALP | 346 IU/l | D-dimer | 2.4 μg/ml |
| LDH | 703 IU/l | ATIII | 105% |
| γGTP | 310 IU/l |
動脈血液ガス分析(room air):PH 7.489,PaCO2 31.9 mmHg,PaO2 66.0 mmHg,HCO3 23.7 mmHg,BE 1.3.
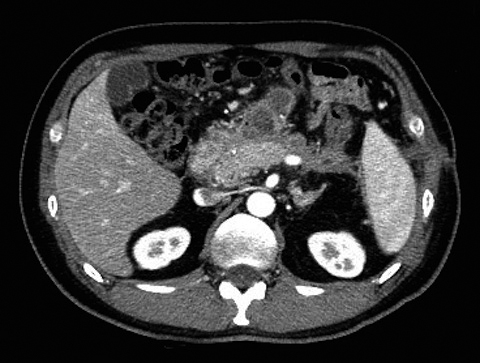
腹部造影CT所見:膵実質造影不良域が二区域にかかり,両側腎下極位遠に及ぶ炎症所見がみられた(Fig. 1).
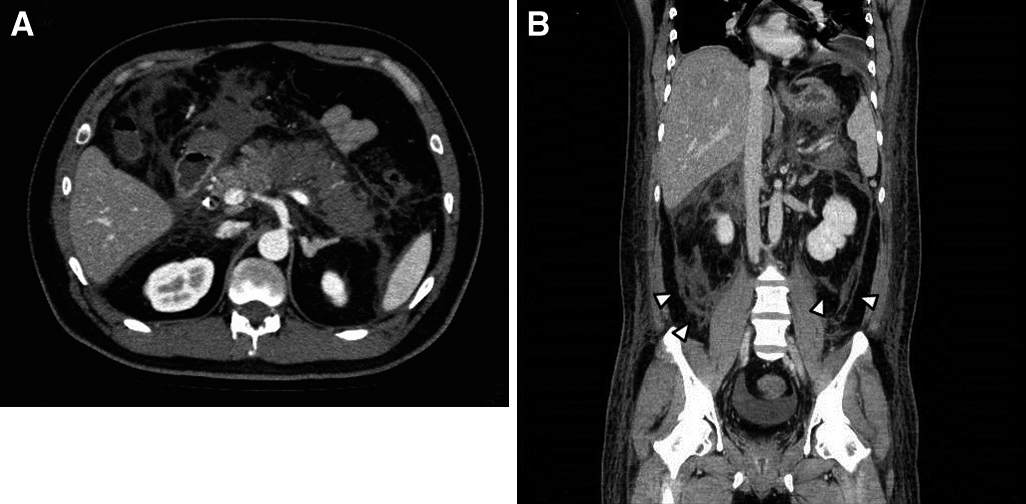
Abdominal CT on admission shows hypo-enhanced area in the body and tail of pancreas (A) and fluid around the bilateral pararenal space (arrowheads) (B).
以上より,急性膵炎重症度判定基準で4点,CT grade 3点と判定し,重症膵炎と診断した.膵酵素阻害剤とカルバペネム系抗生剤の投与を開始した.入院後3日目に2点に低下した.入院後7日目に経管栄養剤の経口投与を開始した.入院後21日に38.4°Cの熱発が出現した.腹部造影CTで,膵体部から両側腎下極に至る広範な壊死腔が形成されていた.その後,解熱し,炎症所見は改善したものの,入院後55日の腹部造影CTで,壊死腔が膵体尾部領域から両側腎上極にまで広範に増大していた(Fig. 2).Step-up approachに基づくEUS下ドレナージとネクロセクトミーでは,右腎上極周囲の壊死物質の除去が十分に行うことができないと判断し,左側腹部小切開でのVARDを行う予定とした.まず,入院後57日に超音波ガイド下に左側腹部から左腎上極を経由し,壊死腔に12Frカテーテルを挿入した.混濁した貯留液が多量に排出された.貯留液から微量の嫌気性菌が検出され,感染を伴う被包化壊死と診断した.入院後66日にVARDを施行した.
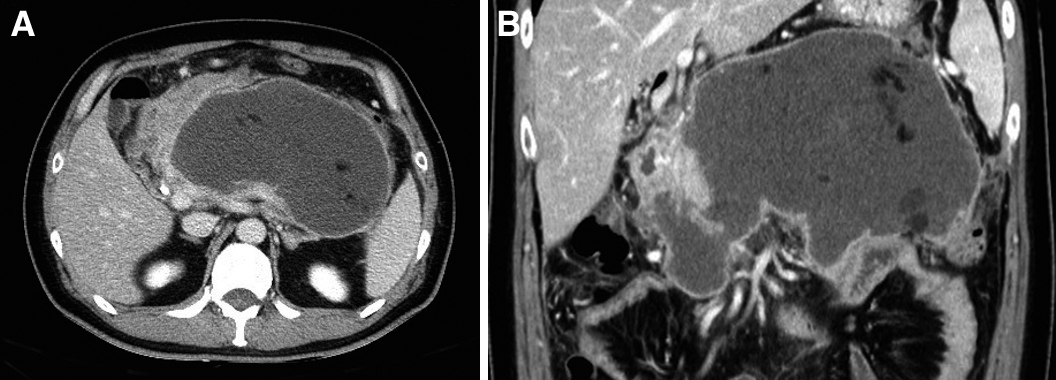
Abdominal CT on hospital day 55 shows a large walled-off necrosis around pancreas parenchyma (A, B).
手術所見:右半側臥位,腎摘位の体位とした.左側腹部に挿入したカテーテルをガイドに約6 cmの皮膚切開を行った.腹腔内に剥離が一部及んだが,安全に壊死腔に達することができた.超音波ガイド下ドレナージでは回収できない膵壊死物質が多量に存在していた.直視下で壊死物質の除去を可及的に行ったが,腹部CTで認めた右腎上極付近の壊死腔は直視下に確認することができなかった.5 mm硬性鏡を壊死腔内に挿入した.気密をせずに観察と操作は可能であった.腹腔鏡で使用する鉗子を用いて,壊死物質を除去した.先端が柔らかく球状である小玉型の吸引鉗子は隔壁を損傷せずに壊死物質を除去するには非常に有用であった(Fig. 3A).また,出血は,電気メスのソフト凝固モードを使用することで,確実な止血効果が得られ,周囲の組織の損傷を軽減できた.硬性鏡にて壊死腔のほとんどを確認することが可能であった.壊死腔にドレーンを2本挿入し(Fig. 3B),手術を終了した.手術時間は3時間35分,出血量は90 ml,膵壊死物質除去量は750 gであった.一連の手技のシェーマを示す(Fig. 4).
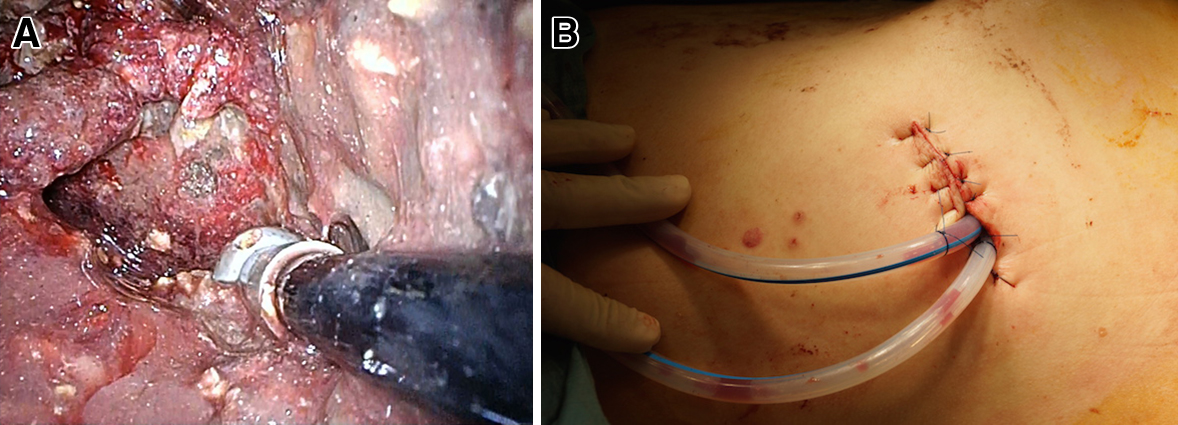
The operative findings.We could easily dissect the necrotic tissue using the suction device with spherical tip (A). Two drainage tubes were placed into the retroperitoneal necrotic space through the incision (B).
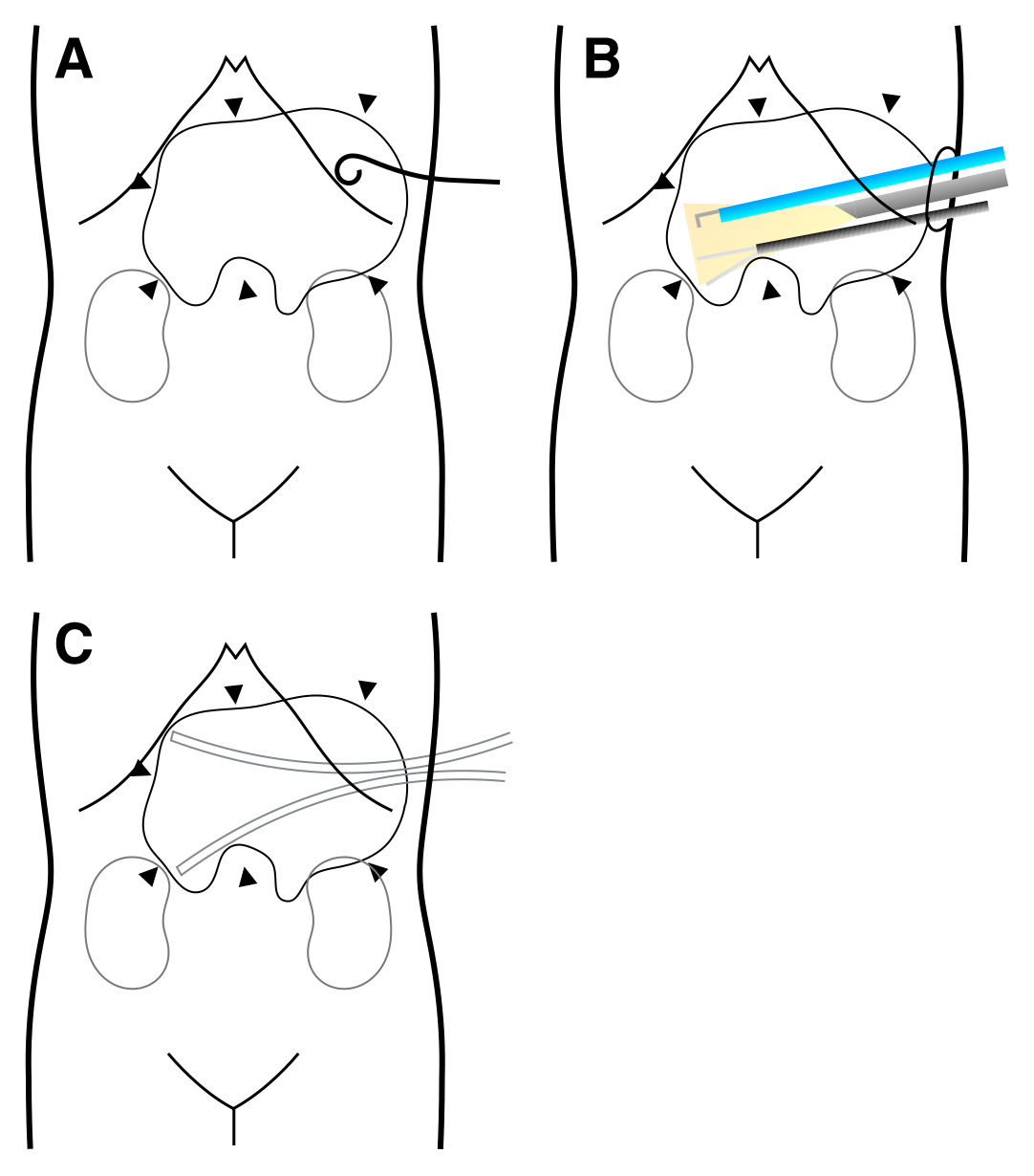
Percutaneous ultrasound-guided drainage of a walled-off necrosis (arrowheads) (A). Video-assisted retroperitoneal debridement through a 6-cm diameter skin incision in the left flank (B). Placement of drainage tubes at the end of procedure (C).
術後経過は良好で,術後2病日で経口摂取を開始し,ドレーンは術後27病日に全て抜去した.追加のネクロセクトミーは必要なかった.術後32病日に退院した.術後2か月の腹部造影CTでは,ほとんどの壊死腔は消失し(Fig. 5),術後1年8か月経過するも再燃を認めていない.
Abdominal CT postoperative two months later shows that walled off necrosis almost disappeared.
いまだに壊死性膵炎の死亡率は14~25%と高く1),本症例のような感染性壊死性膵炎では34%3)に達している.膵炎後液体貯留の形態は,最新のアトランタ分類9)にて改訂された.発症4週間以内で,壊死物質を伴わない急性膵周囲液体貯留(acute peripancreatic fluid collection)と壊死物質を伴う急性壊死性貯留(acute necrotic collection)に分類し,発症4週間以降で,壊死物質を伴わない膵仮性囊胞(pancreatic pseudocyst)と壊死物質を伴う被包化壊死(walled-off necrosis)に分類された.全てのカテゴリーは感染の有無でさらに分類される.
壊死性膵炎に対する治療は,保存的治療が原則である.しかし,感染を伴う場合には,インターベンション治療が選択される.感染の診断には,穿刺吸引細胞診(fine needle aspiration;FNA)を行う方法があるが,診断能は96~100%と良好な報告10)11)がある一方,偽陰性率が20~25%12)であるとの報告もあり,細菌学的検査で感染性壊死と診断できない場合でも,積極的な治療は念頭に置かなければならない.
感染を伴う壊死性膵炎の治療の施行時期は,発症早期には,貯留液などの壊死組織と正常部との境界となる組織の形成が不十分であり,治療に伴う出血や正常組織の損傷が引き起こされる.被包化壊死の形成を待つことで,治療を安全に行うことが可能となる.壊死性膵炎術後の排液中膵酵素の測定にて,約2週間まで,高濃度を示したと報告11)していることからも,可及的に後期である発症3~4週以降に行うことが推奨されている.
治療の目的は壊死物質の除去であり,ドレナージやネクロセクトミーが重要である.開腹によるネクロセクトミー後の死亡率は15%12)と報告があり,現在は,step-up approach13)に基づいた低侵襲である治療法のEUS下ネクロセクトミーやVARDが選択されている.壊死性膵炎被包化壊死に対するEUS下ネクロセクトミーは,治療成功率が75~91%,死亡率が5.8~11%と開腹下ネクロセクトミーより安全性が高いことが示唆されている8).しかし,平均6~7回14)15)と複数回の治療やENBDからの持続洗浄が必要になることがあり,骨盤腔まで広がる壊死腔には適応できない.
VARDは,超音波ガイド下もしくはCTガイド下で後腹膜経由にドレナージを行った後に,全身麻酔下でドレナージチューブをガイドに切開を行うことで,開腹に伴う侵襲や広範囲の腸管授動,癒着を考慮することなく,短時間に,壊死腔へ達することができ,直視下での観察を補う広範な観察や,壊死物質の除去,止血などにさまざまな機器を使用することができる.多施設prospective cohort研究16)では,壊死腔にCTガイド下ドレナージを施行した40例中,75%以下の改善の見られなかった30例に対し,25例にVARDが施行され,その結果,81%が一度の施行のみで終了し,開腹下ネクロセクトミーより低い死亡率と合併症率であったと報告している.諸家の報告をまとめると,施行時間は49~63分と短時間で終了し,死亡率は0~7%との報告4)8)16)であった.
VARDについて,医学中央雑誌において1977年から2015年12月の期間で「膵炎」,「ネクロセクトミー」,「後腹膜」,「video」をキーワードとして検索した結果,文献17)18)はあるものの,詳細な症例報告は該当しなかった.「膵炎」,「ネクロセクトミー」,「後腹膜」をキーワードとして検索した結果では,症例報告は経口内視鏡を使用した1例の会議録のみであった.また,腹腔鏡下で試みた症例19)や腹腔鏡補助下ネクロセクトミー20)の報告では,腹腔鏡下で壊死腔の観察や操作が可能であったが,腸管の授動や壊死腔までの到達は開腹下で行っていた.
今回,当科における開腹下ネクロセクトミーの経験よりVARDを選択した.上下腹部正中切開を必要としたネクロセクトミーより,腹壁破壊が少なく,短時間で壊死腔に達し,壊死物質除去,複数のドレーン管理,早期の経口摂取が可能となり,手術侵襲や術後管理の軽減,入院期間の短縮につながった.EUS下ネクロセクトミーとの比較では,侵襲は高くなるが,広範な壊死物質の除去が可能となり,複数回の処置を必要とせず,有効性があると考えられた.しかし,本法の妥当性については議論を重ねる必要があり,適応や安全性の観点から,VARDの利点を生かし,今後,さらなる症例の蓄積を行いたいと考えている.
利益相反:なし