Abstract
症例は63歳の男性で,2015年11月に直腸癌に対して腹腔鏡下低位前方切除術(D3郭清)および,カペシタビン併用術後照射,術後補助化学療法を施行した.手術から1年9か月後,仙骨前面左側に2 cm大の局所再発を認めた.根治には仙骨合併切除を伴う低位前方切除術が必要と考えられたが,インフォームドコンセントの結果,患者の希望により重粒子線治療を選択した.腫瘍は結腸と近接していたため,重粒子線治療後に腹腔鏡下低位前方切除術(被曝腸管切除術),回腸ストマ造設術を施行した.重粒子線治療時に腫瘍と近接臓器のセーフティーマージンを確保する方法としてスペーサー挿入術が報告されているが,本術式は重粒子線治療後に手術を行うため速やかに治療が開始でき,人工物を用いたスペーサー留置術に比べ感染やアレルギーなどの合併症が起こりにくく,重粒子線治療の適応拡大に有用であると考えられた.
Translated Abstract
A 63-year-old man with rectal cancer underwent laparoscopic anterior resection with D3 lymph node dissection in November 2015. Postoperative irradiation (50 Gy) combined with capecitabine and 2 courses of adjuvant chemotherapy with capecitabine plus oxaliplatin was added. One year and 9 months after surgery, a local recurrence of 2 cm was observed on the left front side of the sacrum. For radical cure, it was considered that low anterior resection with concomitant sacral resection was necessary, but as a result of informed consent, carbon ion radiotherapy was selected at the request of the patient. The tumor was in close proximity to the colon, and laparoscopic anterior resection was performed after one month of carbon ion radiotherapy (73.6 Gy). Spacer insertion surgery has been reported as a method to secure the safety margin of tumors and high radiation sensitive organs to reduce the exposure during carbon ion radiotherapy. The radiation exposed colon resection has three advantages: (1) the carbon ion radiotherapy can be started promptly because the operation is performed after irradiation; (2) it is considered that complications such as infection and allergies are less likely to occur compared with spacer insertion surgery using artificial objects; (3) the radiation exposed colon resection may be able to remove secondary lymph node metastasis from recurrent tumors. The radiation exposed bowel resection was considered to be useful for expanding the indication of carbon ion radiotherapy.
はじめに
直腸癌局所再発に対する重粒子線治療は優れた局所制御率を示しており,外科的治療法に匹敵する治療効果が報告されている1)~3).しかし,重粒子線は腸管など正常組織への影響も大きい.特に腸管が被曝すると潰瘍や穿孔を起こすことが知られている.直腸癌局所再発は腸管と近接することが多く,腸管穿孔などの合併症を避ける対策が求められる.そこで局所再発部位と放射線感受性臓器との間に一定の距離を保つために,照射前にスペーサーを挿入する方法が考案されている3)4).スペーサーには生体内組織5)や人工材料6)が用いられるが,生体内組織ではどの部位を用いるかなど術式に工夫が必要であり,人工物を用いた場合には異物反応や感染リスク,さらにはスペーサーによる臓器損傷のリスクを伴う4)7).また,手術そのものの合併症があり,手術を行うことにより照射開始時期が遅れるといった欠点もある.今回,直腸癌術後の局所再発に対して重粒子線治療後に腹腔鏡下被曝腸管切除術を施行した症例を経験したので報告する.
症例
症例:63歳,男性
既往歴:高血圧,糖尿病,白内障
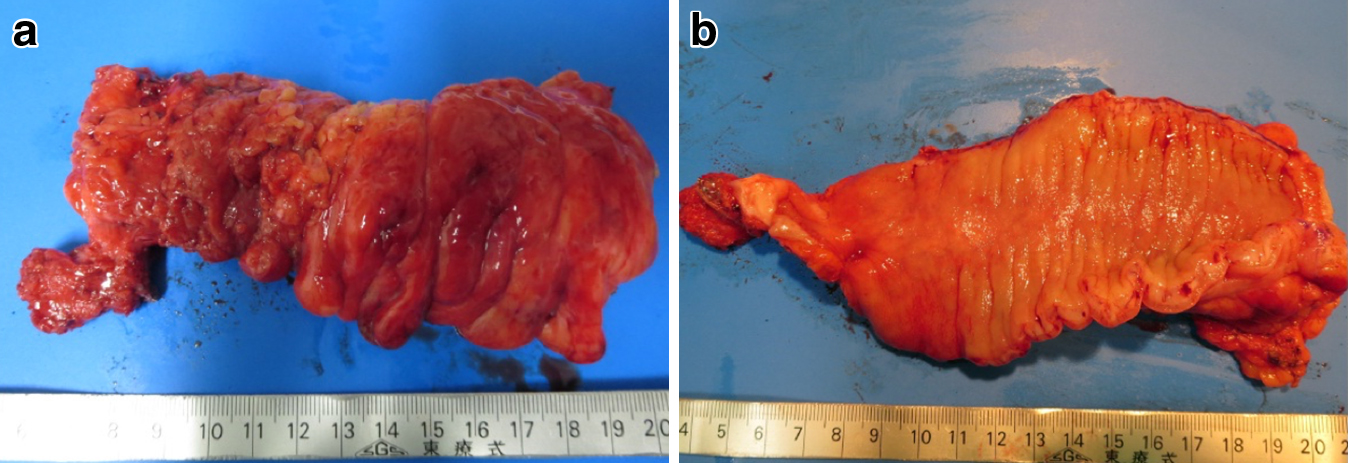
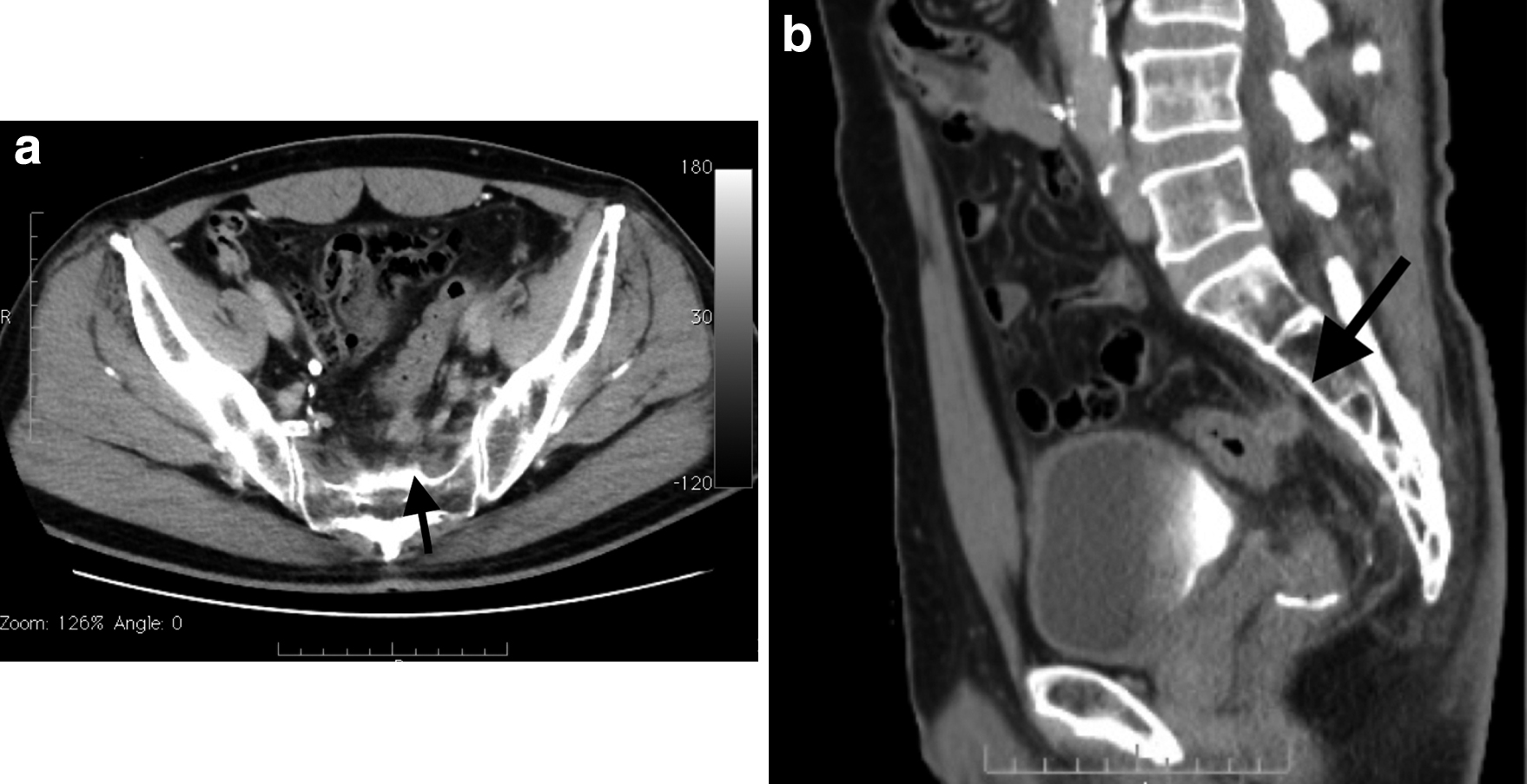
治療経過:2015年11月直腸癌(Ra)に対して腹腔鏡下低位前方切除術(D3郭清)を施行した.腫瘍縁から肛門側および口側断端までの距離は3 cmと16 cmで,病理組織診断では切除断端に癌遺残は認めず中分化型腺癌(Stage IIIb:T4a,N1a(1/20),H0,M0,P0,int,INFb,Ly1c,V0,Pn1a)であった.腫瘍と左骨盤内臓神経が近接していたが機能温存を優先するため合併切除は行わず,術中迅速組織診断にて剥離面の陰性を確認したうえで,再発予防目的に術後照射を行う方針とした.手術後約1か月目からカペシタビン併用術後照射(50 GyE)を施行し,さらに術後補助化学療法としてCapeOX療法を開始したが,腎機能低下に伴い4コース投与目で中止した.手術から1年9か月後に仙骨(S2-3)前面左側に2 cm大の局所再発を認めた(Fig. 1).根治には仙骨合併切除を伴う低位前方切除術が必要と考えられたが,十分なインフォームドコンセントを行った結果,画像検査でリンパ節転移を認めなかったこともあり患者は重粒子線治療を希望された.腫瘍は結腸と近接していたため,照射後に被曝腸管切除を行う方針とし,重粒子線治療(73.6 GyE(RBE)/16 fr)の約1か月後に腹腔鏡下低位前方切除術(被曝腸管切除術),回腸ストマ造設術を施行した.初回手術では左結腸動脈温存D3郭清を行ったが,今回の手術では吻合に備えて横行結腸から脾彎曲部を広く授動するため下腸間膜動脈を根部で切離した.再発腫瘍と結腸間膜が近接する部位では,癌細胞は重粒子線治療の高い局所制御率から照射により細胞死に至ると考えられるため,浸潤部位では術中合併症につながる無理な剥離操作は行わずあえて結腸間膜内に切り込むように切離した(Fig. 2).精囊や前立腺に切り込まないように骨盤内操作を進め,初回手術時の吻合部肛門側まで結腸を剥離したのち,double stapling technique(DTS)法により器械吻合を施行した.切除標本では肉眼的に照射による明らかな粘膜障害は認めなかった(Fig. 3).病理組織検査では再発腫瘍と接していた結腸間膜内に癌遺残は認めなかったが,被曝腸管の腸間膜リンパ節で繊維性結合組織に混ざって細胞死の前段階と考えられる空胞変性を伴う腺癌細胞が認められた(Fig. 4).術後経過は良好で術後2週間で退院となったが,その後も短期的な合併症は認めず,照射3か月後のCTでは再発腫瘍は縮小していた.
考察
直腸癌局所再発に対する治療は,画像検査をもとに再発部位や浸潤範囲などを慎重に術前評価し治療戦略を決定することにより,R0切除が可能な場合には手術侵襲やQOLを考慮したうえで外科的切除を行うよう推奨されている(エビデンスレベル2D)8).特に,再発腫瘍が吻合部周囲に限局している場合や第3仙骨より下位または骨盤内臓に接する腫瘍であれば外科的切除の良い適応とされる9).しかし,根治が期待できる一方で術後合併症も多く10)中には重篤なものも含まれるため,十分なインフォームドコンセントの下に集学的治療を含めた治療選択の中から手術適応を決定する必要がある8)11).
一方で,直腸癌局所再発に対する有効な治療法として,重粒子線治療の有用性が報告されている1)~3).重粒子線治療は従来の放射線治療に比べて,高い線量集中性を有するため,腫瘍周辺の正常組織への有害事象を軽減し病変部に十分な線量を集中させることが可能である.また,医療に用いられる粒子線は,陽子線,中性子線,重粒子線に大別されるが,重粒子線(炭素イオン線)は重い粒子を加速していることから殺細胞効果が高く,放射線抵抗性の癌細胞にも高い殺細胞効果を示す12).このため,頭頸部癌や肺癌,肝癌,前立腺癌,骨軟部腫瘍,直腸癌術後骨盤内再発などで有効とされているが13),中でも,直腸癌局所再発に対する重粒子線治療は,5年局所制御率88%と外科的治療に匹敵する高い局所制御率を有しており1),根治性および機能温存の観点からも極めて有用である.また,進行直腸癌では集学的治療として手術前後に放射線治療を行う機会が増えているが10)14),放射線照射後の局所再発症例に対してはX線や陽子線による放射線治療では周辺臓器への耐容線量や放射線抵抗性の問題から再照射による治療効果は少ないと考えられる.しかし,重粒子線治療では今回の症例のように手術前後に放射線治療を行った再発症例に対しても高い殺細胞性により効果が期待できる13).
重粒子線は高い線量集中性を有するが,子宮頸癌に対するphase I/II試験では腸管の被曝量が60 GyEを超えた症例の44例中8例に照射後1か月から数年後に発生した外科的治療を必要とする遅発性合併症(直腸膣瘻5例,直腸潰瘍2例,直腸穿孔1例)が報告され15),また,前立腺癌に対するphase II試験においても照射による高い消化管合併症発生率が報告されている16).このため,腸管穿孔などの合併症を予防するために腫瘍と周囲の放射線感受性臓器の間に5 mm以上の間隔を確実に取ることが要求される2).照射部位と放射線感受性臓器が近接している場合には,スペーサー挿入術による合併症予防が試みられており4),近年では今回の症例のように腹腔鏡手術の報告も見られる17)18).スペーサーには生体内組織5)や人工材料6)が用いられるが,生体内組織ではどの部位を用いるかにより術式に工夫が必要であり,人工物を用いた場合には感染リスクやアレルギー反応に留意する必要がある4).また,スペーサーによる臓器損傷の報告もある7).さらに,スペーサー挿入術を行う場合,再発腫瘍と分離すべき放射線感受性臓器の距離が近いため,浸潤した癌細胞が剥離面に露出する可能性がある.その場合には臓器側に切り込むように切離を行う必要があり,また,浸潤範囲が広ければ合併切除を考慮しなければならないため,腹腔内感染のリスクがさらに高くなる4).スペーサー挿入術は照射前に手術を行うため,術後合併症が生じた場合などでは照射開始時期が遅れるといった欠点もある.こういったスペーサー挿入術の欠点を解消するため,照射領域に近接する腸管を重粒子線治療後に予防的に切除する方法が考えられるが,医学中央雑誌(1964〜2018年6月)およびPubMed(1950〜2017年6月)にて「重粒子線」,「被曝腸管切除または予防的腸管切除」をキーワードとして検索したところ(会議録は除く),報告例は見られなかった.
被曝腸管切除術では再発部位に近接した腸管も照射範囲に加えたうえで被曝した腸管だけを切除するため,近接臓器に浸潤していたとしても照射後に切除するため局所制御率が高まる可能性がある.また,今回の症例では被曝腸管の所属リンパ節に転移を認めた.このリンパ節は初回手術時の郭清範囲には含まれない下行結腸領域のリンパ節であるため,再発腫瘍が結腸間膜内に浸潤しリンパ節転移に至ったと考えられる.この部位は再発腫瘍から少なくとも3 cm以上離れており,重粒子線治療における高線量照射領域ではないため,被曝腸管切除が局所再発だけではなく二次的なリンパ節転移を制御し予後を改善させる可能性がある.
重粒子線治療後の腹腔鏡下被曝腸管切除術は,再手術という点で腹腔内の高度な癒着が存在する場合には難易度が高くなるが,腹腔鏡下手術であることに加え,仙骨合併切除などの外科的切除のみで根治を目指す場合に比べると非侵襲的である.また,重粒子線治療は外科的切除に匹敵する治療成績が期待できるため,被曝腸管切除による適応拡大が直腸癌局所再発に対する治療戦略を広げると考えられる.腹腔鏡下被曝腸管切除術はスペーサー挿入術に比較して利点が多く,腫瘍と近接臓器のセーフティーマージンを確保する方法として重粒子線治療の適応拡大に有用であると考えられた.
利益相反:なし
文献
- 1) Yamada S, Kamada T, Ebner DK, Shinoto M, Terashima K, Isozaki Y, et al. Carbon-ion radiation therapy for pelvic recurrence of rectal cancer. Int J Radiat Oncol Biol Phys. 2016 Sep;96(1):93–101.
- 2) 磯崎 由佳, 山田 滋, 川城 壮平, 辻 比呂志, 鎌田 正, 松原 久裕.直腸癌局所再発に対する重粒子線治療の成績と今後の展望.外科.2016;78(13):1497–1501.
- 3) 山田 滋, 磯崎 哲朗, 磯崎 由佳, 安西 誠, 安田 茂雄, 鎌田 正,ほか.直腸癌局所再発に対する重粒子線治療.臨床外科.2014;69(10):1212–1218.
- 4) 高橋 慶一, 松本 寛, 中山 祐次郎, 高雄 美里, 河村 英恭, 中野 大輔,ほか.直腸癌局所再発に対する重粒子線治療の展開―スペーサー挿入の適応と意義.外科.2016;78(13):1502–1508.
- 5) 山本 明, 藤村 昌樹, 平野 正満, 佐藤 功, 新屋 久幸, 馬場 裕司,ほか.直腸癌局所再発例に対する放射線治療の経験―小腸被曝防止のための一工夫.日本消化器外科学会雑誌.1988;21(5):1351–1354.
- 6) 小松 昇平, 福本 巧, 堀 裕一, 村上 昌雄, 菱川 良夫, 具 英成.下大静脈腫瘍栓を伴った切除不能大腸癌肝転移に対してスペーサー留置術および陽子線照射による2段階治療が奏効した1例.日本消化器外科学会雑誌.2009;42(12):1831–1836.
- 7) Ogino T, Sekimoto M, Nishimura J, Takemasa I, Mizushima T, Ikeda M, et al. Intraluminal migration of a spacer with small bowel obstruction: a case report of rare complication. World J Surg Oncol. 2012 Feb;10:30.
- 8) 大腸癌研究会編.大腸癌治療ガイドライン医師用.2016年版.東京:金原出版;2016. p. 57.
- 9) 三澤 一成, 加藤 知行, 金光 幸秀, 小森 康司, 平井 孝.腫瘍進展の局在から見た直腸癌局所再発に対する外科的治療の効果.日本消化器外科学会雑誌.2006;39(12):1787–1796.
- 10) 植村 守, 関本 貢嗣, 三宅 正和, 池田 正孝, 前田 栄, 浜川 卓也,ほか.仙骨合併切除を伴う直腸癌局所再発手術.臨床外科.2016;71(8):969–975.
- 11) 植村 守, 関本 貢嗣, 三宅 正和, 池田 正孝, 前田 栄, 浜川 卓也,ほか.直腸癌局所再発に対する集学的治療 術前放射線化学療法.外科.2016;78(13):1486–1492.
- 12) Kamada T, Tsujii H, Blakely EA, Debus J, De Neve W, Durante M, et al. Carbon ion radiotherapy in Japan; an assessment of 20 years of clinical experience. Lancet Oncol. 2015 Feb;16(2):e93–100.
- 13) 齋藤 淳一, 中野 隆史.粒子線治療―重粒子線治療を中心に.癌と化学療法.2014;41(13):2546–2549.
- 14) 南 宏典, 小西 毅, 上野 雅資, 福長 洋介, 長山 聡, 藤本 佳也,ほか.大腸癌の集学的治療戦略.外科.2018;80(8):832–836.
- 15) Kato S, Ohno T, Tsuji H, Nakano T, Mizoe JE, Kamada T, et al. Dose escalation study of carbon ion radiotherapy for locally advanced carcinoma of the uterine cervix. Int J Radiat Oncol Biol Phys. 2006 Jun;65(2):388–397.
- 16) Ishikawa H, Tsuji H, Kamada T, Hirasawa N, Yanagi T, Mizoe JE, et al. Risk factors of late rectal bleeding after carbon ion therapy for prostate cancer. Int J Radiat Oncol Biol Phys. 2006 Nov;66(4):1084–1091.
- 17) 山崎 将人, 安田 秀喜, 幸田 圭史, 手塚 徹, 小杉 千弘, 樋口 亮太,ほか.肝細胞癌に対する重粒子線治療のために腹腔鏡下スペーサー挿入術を行なった1例.日本内視鏡外科学会雑誌.2010;15(1):73–78.
- 18) 中山 祐次郎, 松本 寛, 河村 英恭, 中野 大輔, 山口 達郎, 高橋 慶一.脊索腫に対する重粒子線治療前に腹腔鏡下スペーサー挿入術を行った1例.日本医科大学医学会雑誌.2016;12(1):26–29.
 https://orcid.org/0000-0002-8563-0436
https://orcid.org/0000-0002-8563-0436