目的:胃上部早期癌に対する噴門側胃切除(proximal gastrectomy;以下,PGと略記)は,術後の逆流やそれに続く体重減少,QOLの低下が問題であり,胃全摘術(total gastrectomy;以下,TGと略記)との選択はいまだに見解が分かれる.PG後の観音開き再建法(double-flap technique;以下,DFTと略記)は術後逆流や縫合不全が低率であることが期待されており,TGと比較し有用性を検討した.方法:2014年1月~2016年12月までに胃上部早期癌に対し(L)PG+DFTを施行した19例と(L)TG+Roux-Y再建16例を比較し周術期合併症,術後内視鏡検査での逆流性食道炎の有無,栄養状態,骨格筋減少量の短期成績を検討した.結果:(L)PG+DFT群は(L)TG+Roux-Y群と比較し高齢であったが,縫合不全や膵液漏,術後膿瘍などの周術期合併症はなく,術後逆流性食道炎は有意に低率であった(P=0.0368).栄養面では,血清総蛋白量(TP),アルブミン値(Alb),血色素値(Hb)の推移に有意差はなかったが,1年後体重減少率(P=0.0165),骨格筋減少率(P=0.0345)は(L)PG+DFT群で有意に低かった.結語:胃上部早期癌に対する(L)PG+DFTは(L)TG+Roux-Y再建と比較し,術後逆流性食道炎の出現,栄養,骨格筋維持の面で優れている術式であった.(L)PG+DFTは術後QOL維持に寄与する術式と考えられる.
Purpose: Proximal gastrectomy (PG) for early upper-third gastric cancer has problems associated with issues of reflux esophagitis, weight loss and poor QOL. The choice of methods of surgery for early upper-third gastric cancer between PG and total gastrectomy (TG) remains controversial. Double-flap technique (DFT) after PG is expected to help prevent reflux esophagitis and anastomotic leakage, so the usefulness of DFT was examined in comparison with TG in this present study. Methods: We compared the outcomes of 19 patients who underwent (L) PG+DFT and 16 patients who underwent (L) TG+Roux-Y for early upper-third gastric cancer between January 2014 and December 2016. We examined short-term results, including postoperative complications, grade of reflux esophagitis by postoperative endoscopy, nutritional status, and skeletal muscle loss, in both groups. Result: The (L) PG+DFT group had a greater number of elderly patients than the (L) TG+Roux-Y group, but there were no postoperative complications of anastomotic leakage, pancreatic fistula and abdominal abscess in the (L) PG+DFT group, and the number of reflux esophagitis was significantly less than that of the (L) TG+Roux-Y group (P=0.0368). Regarding nutrition, there were no significant differences in changes in serum total protein (TP), albumin (Alb), and hemoglobin (Hb) between both groups, but the weight loss rate after 1 year (P=0.0165) and skeletal muscle loss rate (P=0.0345) of the (L) PG+DFT group was significantly lower than the (L) TG+Roux-Y group. Conclusion: (L) PG+DFT for early upper-third gastric cancer was superior in terms of preventing reflux esophagitis, and maintaining good nutritional status and skeletal muscle. (L) PG+DFT is considered to be a good method for maintaining postoperative QOL.
胃癌は世界の癌関連死亡者数において第3位で,罹患率は第5位と高率である1).近年,日本を含めたアジアにおいて早期胃癌を含めた胃上部癌は増加傾向にあり2)~4),日本では癌検診の啓蒙により早期胃癌の発見率は約50%と検診の効率が高い2).胃上部癌に対する根治術は胃全摘術(total gastrectomy;以下,TGと略記)が基本であったが,噴門側胃切除術(proximal gastrectomy;以下,PGと略記)の胃温存によるビタミンB12の吸収障害予防や小胃症状改善に優れている点や,早期胃癌に対する腫瘍学的な根治性が証明された5)6)ことから胃癌治療ガイドライン第4版では胃の1/2以上を温存できるcT1N0症例に対してPGが認められている7).
一方,PGの最大の問題点は術後の高頻度の逆流性食道炎などの吻合部関連術後障害,それに続く体重減少である8)~10).PG術後の再建法は,食道残胃吻合,空腸間置法,ダブルトラクト法などが施行されている.しかし,これらの問題を解決するための標準的な再建方法は確立されておらず,PG術後のQOLの維持に関するエビデンスは乏しい.いまだにTGとの選択において議論の余地があり,現在でも胃上部早期癌の治療選択としてTGが選択されることもある8)11).
逆流防止目的に弁形成吻合法を改良した観音開き再建法(double-flap technique;以下,DFTと略記)を2001年に上川ら12)が報告している.DFTは逆流性食道炎予防や縫合不全などの吻合部関連障害の少なさが期待され,腹腔鏡やロボット支援下での報告もなされている13)14).
胃癌根治切除後の長期生存患者は増加傾向にあり,機能温存を考慮した術式の検討は重要な課題である.術式の選択のうえで食事摂取や栄養状態改善,体重減少予防は検討の余地がある.また,近年胃癌の長期予後や術後合併症とサルコペニアの主要診断項目である低骨格筋量の関連が報告されているが,骨格筋量維持に着眼した術式の検討はなされていない.
胃上部早期癌において,術後のQOL向上を目指した術式としてDFTを行った(L)PGの有用性を評価する目的で術後障害,栄養,骨格筋維持量を(L)TG+Roux-Yと比較検討を行った.また,DFTを行ったPG群で腹腔鏡を使用した群(LPG+DFT)と開腹群(OPG+DFT)を比較し腹腔鏡での安全性を検討した.
当院で,2014年1月から2016年12月に術前cT1N0と診断し,根治術が施行された胃上部早期癌患者41症例を対象とした.術後1年の内視鏡検査が施行されなかった患者6人を除外し,合計35人の患者を検討した.19人に(L)PG+DFTを16人に(L)TG+Roux-Y再建を行った(Fig. 1).全例で上部消化管内視鏡検査,上部消化管造影検査,全身CTを行い,胃癌取扱い規約第14版15)に従って術前診断を行った.術式の選択は,年齢やH. pyloriによる粘膜萎縮の程度は問わず,腫瘍がU領域に限局し十分な残胃が残ると判断したうえで,患者の同意を得られた症例ではPGを,多発病変やM領域にかかる症例ではTGを施行した.解析は当科のデータベースを使用し後方視的に行った.本研究は2018年5月に久留米大学倫理委員会の承認を得た.
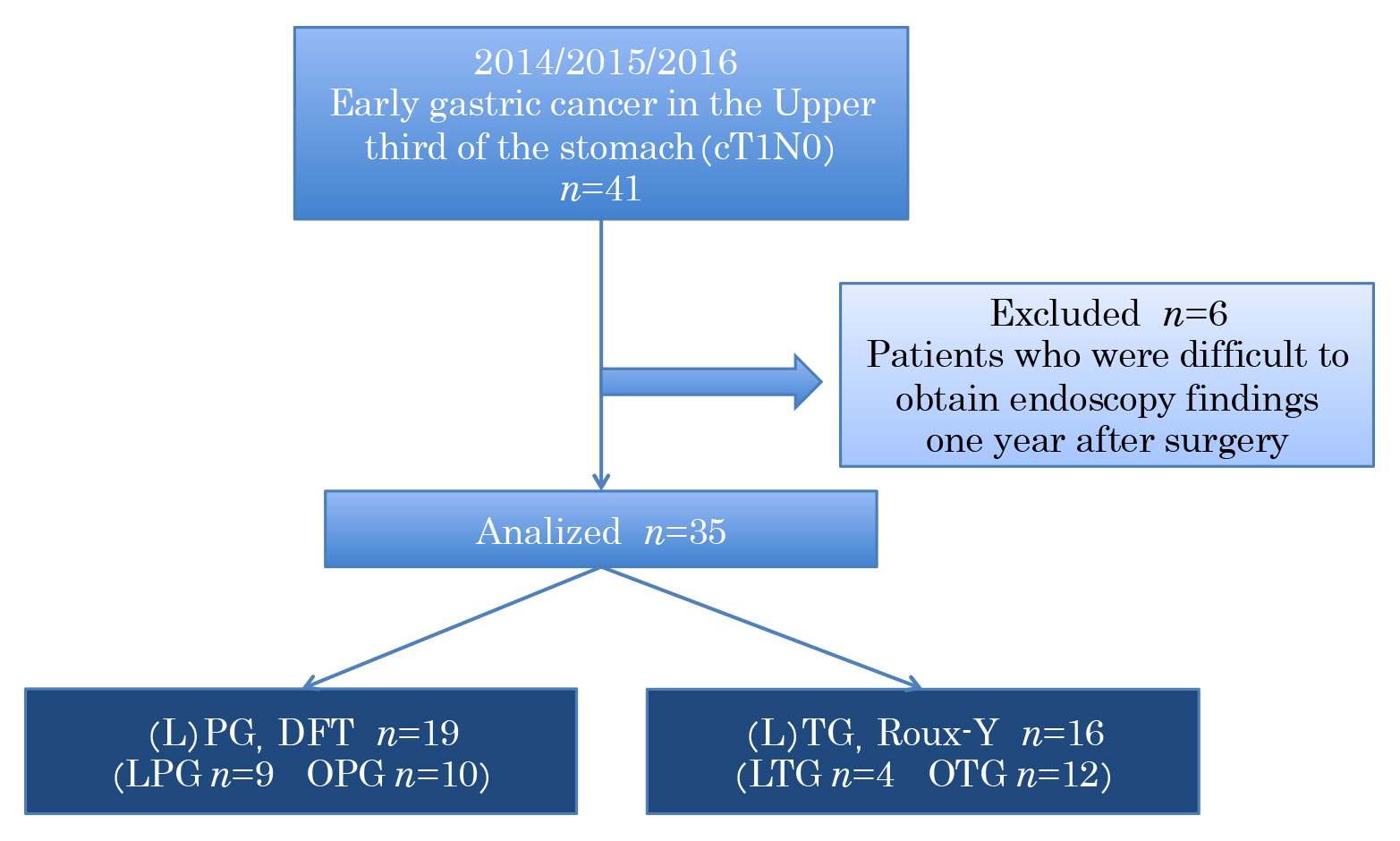
Outline of the study. PG: proximal gastrectomy, TG: total gastrectomy, LPG: laparoscopic proximal gastrectomy, LTG: laparoscopic total gastrectomy, OPG: open proximal gastrectomy, OTG: open total gastrectomy, DFT: double flap technique.
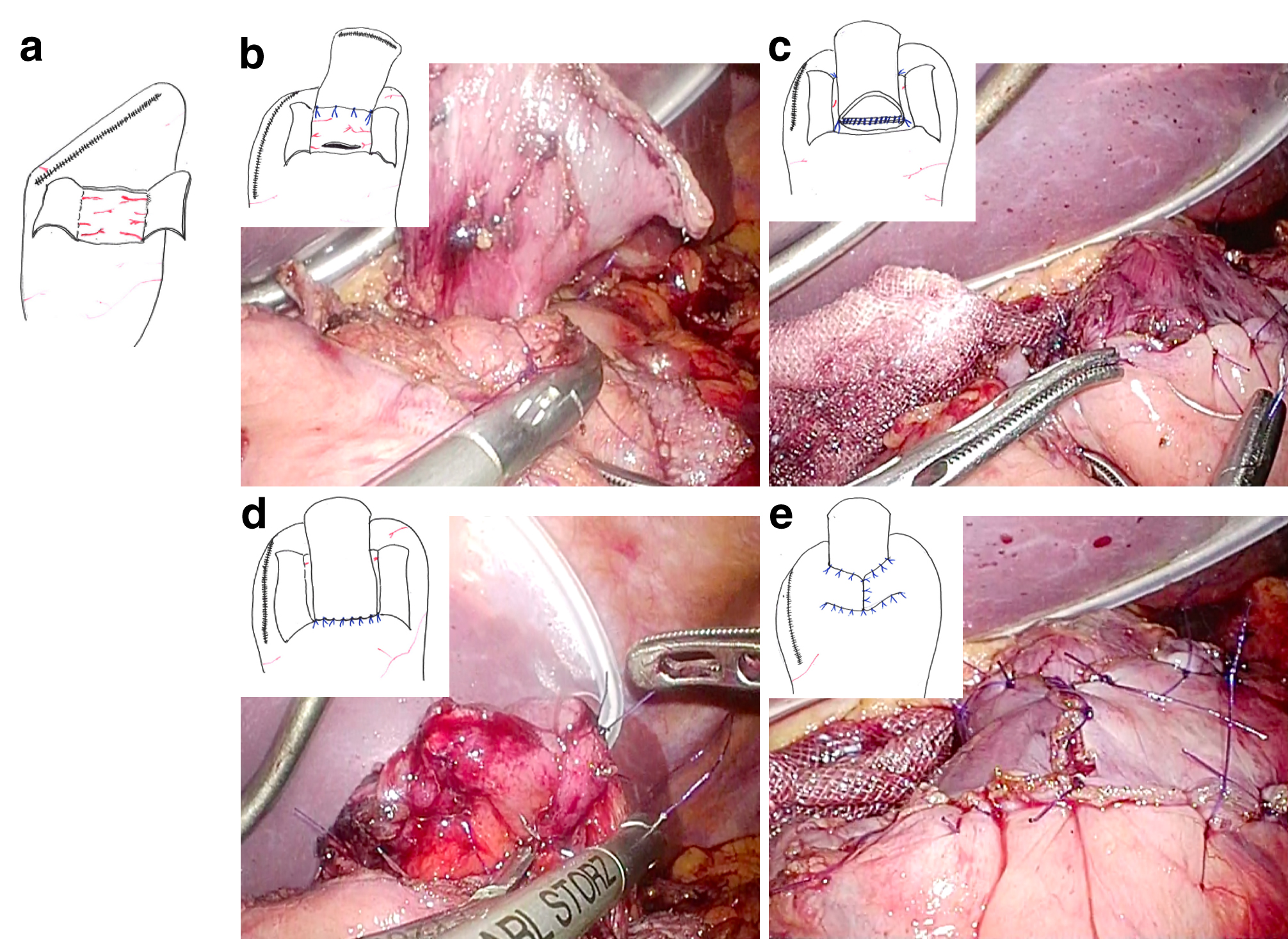
日本胃癌治療ガイドライン第4版に従い,(L)PG,(L)TGともにD1+リンパ節郭清を施行した.DFTは鏡視下手術において,開腹手術と同様に体外で3.5 cm×2.5 cmの漿膜筋層フラップを作成した.フラップ作成後は体内操作とし,吻合は体内結紮法で行った(Fig. 2).(L)TGは全例でRoux-Y再建方法とし,EEA 25~29 mmでの機械吻合を行った.
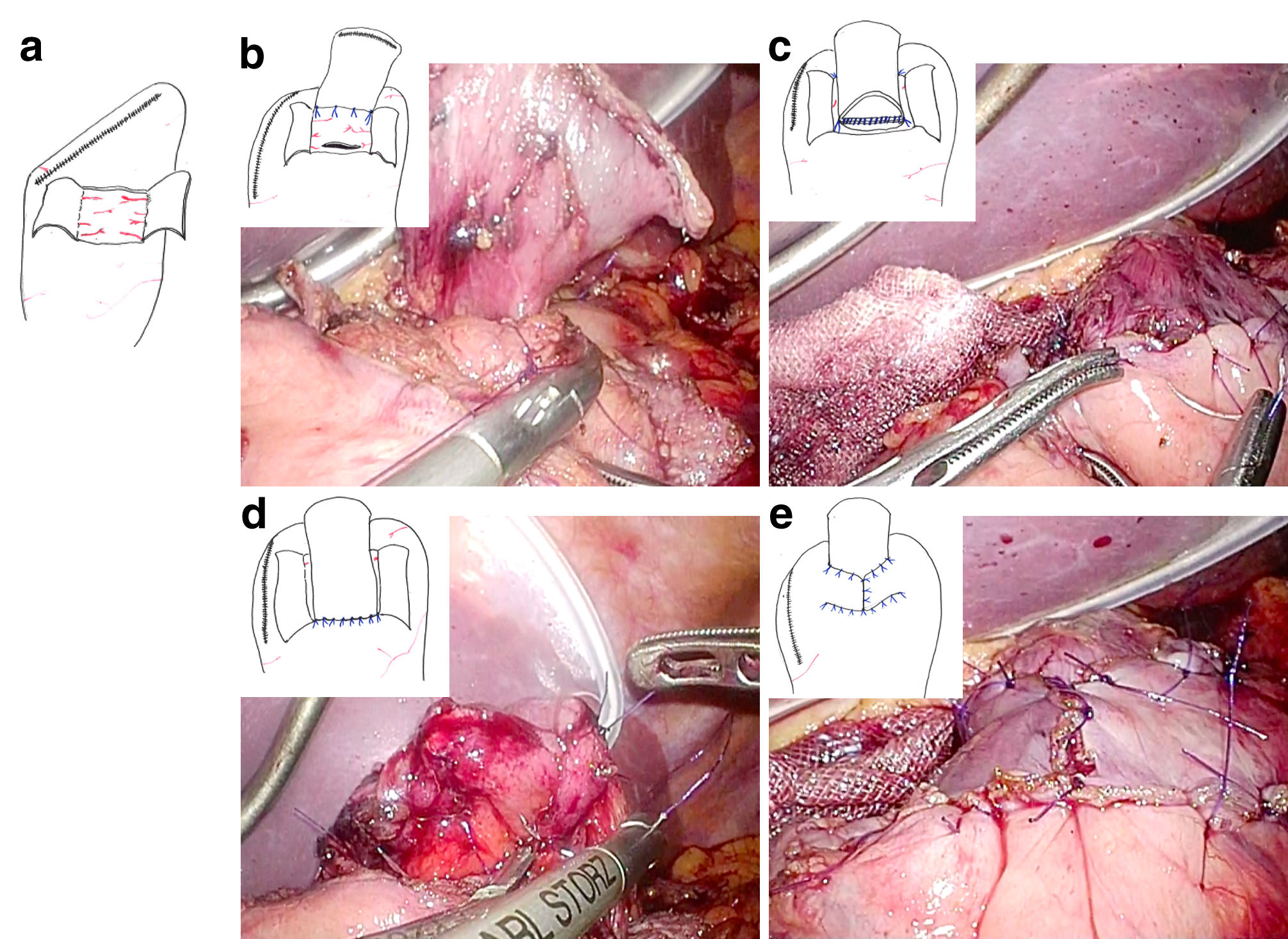
(a) The double seromuscular flaps (2.5 cm wide×3.5 cm high) were created at the anterior wall. (b) Four-point sutures are placed between the posterior side of the esophagus and the edge of the seromuscular flap on the gastric remnant. (c, d) Anastomosis of the posterior wall is performed by a single-layer suture. The anterior wall is sutured layer to layer. (e) The anastomosis was fully covered by the seromuscular flaps.
周術期合併症,退院後内視鏡検査所見,その他の合併症を分けて検討を行った.周術期合併症は縫合不全,膵液漏,腹腔内膿瘍,術後出血を検討し,Clavien-Dindo分類Grade II以上を合併症ありとした.
長期術後合併症は,術後1年目に行われた内視鏡検査における吻合部所見より,逆流性食道炎,吻合部狭窄,吻合部潰瘍の有無を評価した.ロサンゼルス分類のGrade M以上の逆流性食道炎を検討した.退院後の肺炎やダンピング症候群をその他の合併症に含めた.
4. 骨格筋減少量骨格筋量は診断目的に施行した術前CTと術後1年目の再発検索目的に施行したCTを使用し測定した.第3腰椎下縁レベルの全骨格筋量をImage J(National Institute of Health)を用いて測定した16).得られた面積を身長の2乗で除してSMI(skeletal muscle index, cm2/m2)値として算出した.術前測定値を100%として術後1年目の減少率を算出した.
5. 栄養指標全ての患者に対し,術式にかかわらず退院後3か月毎の受診時に栄養指標となる項目(TP,Alb,Hb)を含めた血液検査を行った.術前の血液検査データを基準に,3,6,12か月後の変化率を算出した.同様に術前の体重を100%として,術後1年目の体重減少率を算出した.
6. 統計対象群間の背景,手術結果,周術期合併症,術後内視鏡検査所見,栄養評価を比較した.連続変数は平均±標準偏差,または中央値(範囲)で要約し,Student-t検定またはMann-Whitney rank sum testで比較した.カテゴリ変数は頻度と割合で要約し,カイ2乗検定で比較した.引用した全てのP値は0.05以下を有意差ありとした.全ての統計はJMP®Pro 13.0.0(SAS Institute, Cary, NC, USA)を用いた.
(L)PG+DFT群と(L)TG+Roux-Y再建群の背景因子をTable 1に示す.性別,BMI,術前SMI,術前深達度,術後深達度,病理学的リンパ節転移,術後病期,術後補助化学療法の有無には有意差はなかった.患者年齢は(L)PG+DFT群で有意に高齢(P=0.0112)であり,腫瘍径は小さかった(P=0.0445).
| (L) PG, DFT n=19 |
(L) TG, R-Y n=16 |
||
|---|---|---|---|
| Age | 76 (57–90) | 65 (50–79) | P=0.0112 |
| Sex (M/F) | 15 (79)/4 (21) | 11 (68.85)/5 (31.25) | P=0.4917 |
| Weight (kg) | 56.7±2.2 | 56.5±2.4 | P=0.6375 |
| BMI (kg/m2) | 21.3±0.60 | 22.0±0.66 | P=0.4182 |
| Location | P=0.0021 | ||
| UE | 0 | 2 | |
| U | 19 | 8 | |
| UM | 0 | 6 | |
| Tumor size | 30.6±4.3 | 43.7±4.5 | P=0.0445 |
| Clinical T | P=0.2689 | ||
| T1a | 0 | 1 | |
| T1b | 19 | 15 | |
| Pathological T | P=0.1062 | ||
| T1 | 13 | 11 | |
| T2 | 2 | 4 | |
| T3 | 3 | 0 | |
| T4 | 1 | 1 | |
| Pathological N | P=0.7719 | ||
| N0 | 15 | 13 | |
| N1 | 2 | 2 | |
| N2 | 2 | 1 | |
| Pathological Stage | P=0.5817 | ||
| I | 14 | 13 | |
| II | 3 | 3 | |
| III | 2 | 0 | |
| Histological type | P=0.7131 | ||
| Differentiated | 13 (68.4) | 10 (62.5) | |
| Undifferentiated | 6 (31.6) | 6 (37.5) | |
| Laparoscopic | 9 (52.9) | 4 (25) | P=0.1006 |
| Postoperative adjuvant chemotherapy | 4 (21.05) | 2 (12.5) | P=0.5036 |
Values are expressed as n (%), mean±standard deviation or median (range).
両群において,手術時間に差は認めなかったが,(L)PG+DFT群で出血量は有意に少なく(P=0.0243),術後在院日数も有意に(L)PG,DFT群で短かった(P=0.0182)(Table 2).出血,縫合不全や膵液漏の周術期合併症は(L)PG+DFT群で有意に少なかった(P=0.0249).肺炎や晩期ダンピング症候群は(L)PG+DFT群では1例もなかった.退院後1年の内視鏡検査所見(Fig. 3)で,(L)PG+DFT群はロサンゼルス分類Grade Mの逆流性食道炎1例のみであった(P=0.0368).
| (L) PG, DFT n=19 |
(L) TG, R-Y n=16 |
||
|---|---|---|---|
| Operation time (min) | 243 (161–445) | 250 (193–448) | P=0.7248 |
| Blood loss (ml) | 47 (5–220) | 100 (10–811) | P=0.0243 |
| R0 resection | 19 (100) | 16 (100) | P=1 |
| Perioperative complication | 0/19 (0) | 3/16 (18.75) | P=0.0249 |
| CD (Clavien Dindo) ≥2 | |||
| Leakage | 0 | 2 (12.5) | P=0.1125 |
| Bleeding | 0 | 0 | P=1 |
| Pancreatic fistulea | 0 | 1 (6.25) | P=0.2689 |
| Abdominal abscess | 0 | 1 (6.25) | P=0.2817 |
| Complications after discharge (Comfirmed by endoscopy) |
|||
| Stenosis | 4 (21.05) | 2 (12.50) | P=0.5036 |
| GERD total | 1 (5.26) | 5 (31.25) | P=0.0368 |
| Grade M | 1 | 2 | |
| A | 0 | 1 | |
| B | 0 | 2 | |
| Ulcer | 1 (5.26) | 0 | P=0.3518 |
| Other complications | |||
| Pneumonia | 0 | 1 (6.25) | P=0.2689 |
| Dumping | 0 | 2 (12.5) | P=0.1125 |
| Mortality | 0 | 0 | P=1 |
| Postoperative hospital stay | 15 (10–22) | 18 (14–67) | P=0.0182 |
Values are expressed as n (%), mean±standard deviation or median (range).
Reflux esophagitis was evaluated according to the Los Angeles classification.
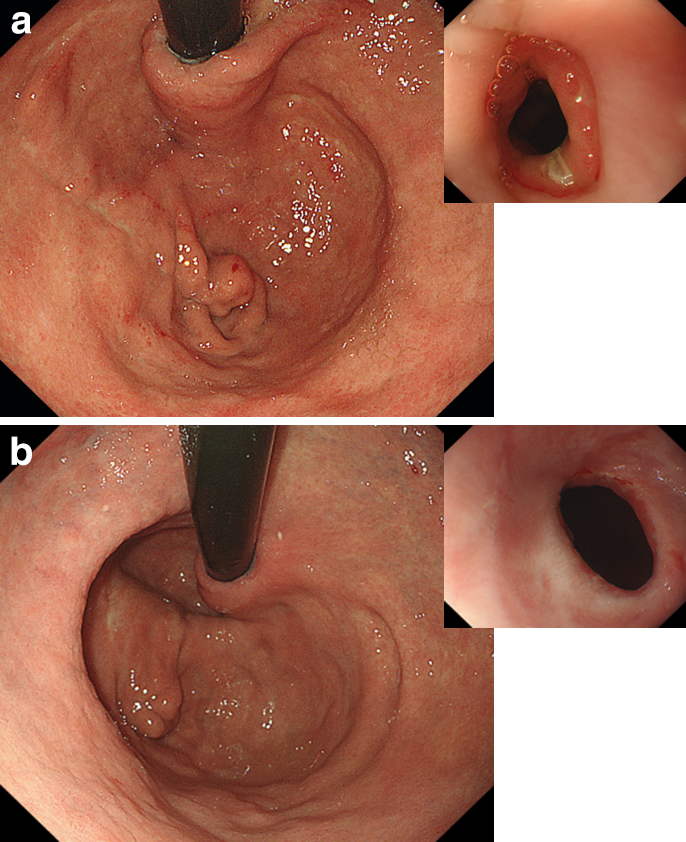
Endoscopic findings one year later. (a) (b) Insertion of the endoscopy is easy, and the formed pseudo-fornix is soft with a natural shape.
栄養指数となる血清TP,Alb,Hb値は3,6,12か月で両群に有意差はなかったが,1年後体重減少率は(L)PG+DFT群が有意に低かった(P=0.0165)(Fig. 4).術前の骨格筋量より算出されたSMIは両群で有意差はなかったが(40.5±1.5 vs 41.7±1.6,P=0.5953),術後1年目の評価CTで行った体組成の評価では,(L)PG+DFT群は有意に骨格筋の減少量は低かった(93.6%±1.8 vs 87.7%±1.9,P=0.0345)(Fig. 5).
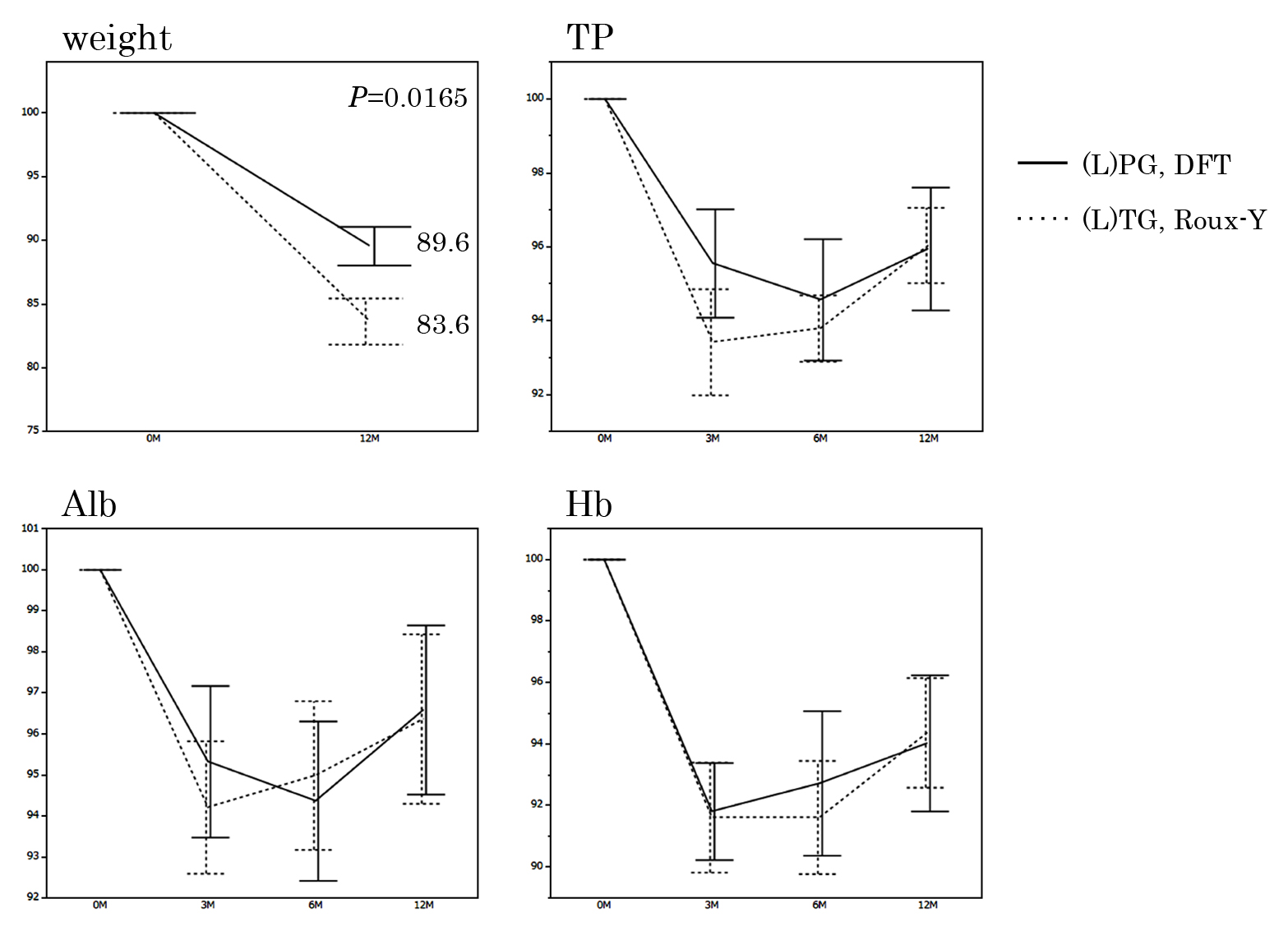
Nutritional parameters. All figures in the table are written as %. TP: total protein, Alb: albumin, Hb: hemoglobin.
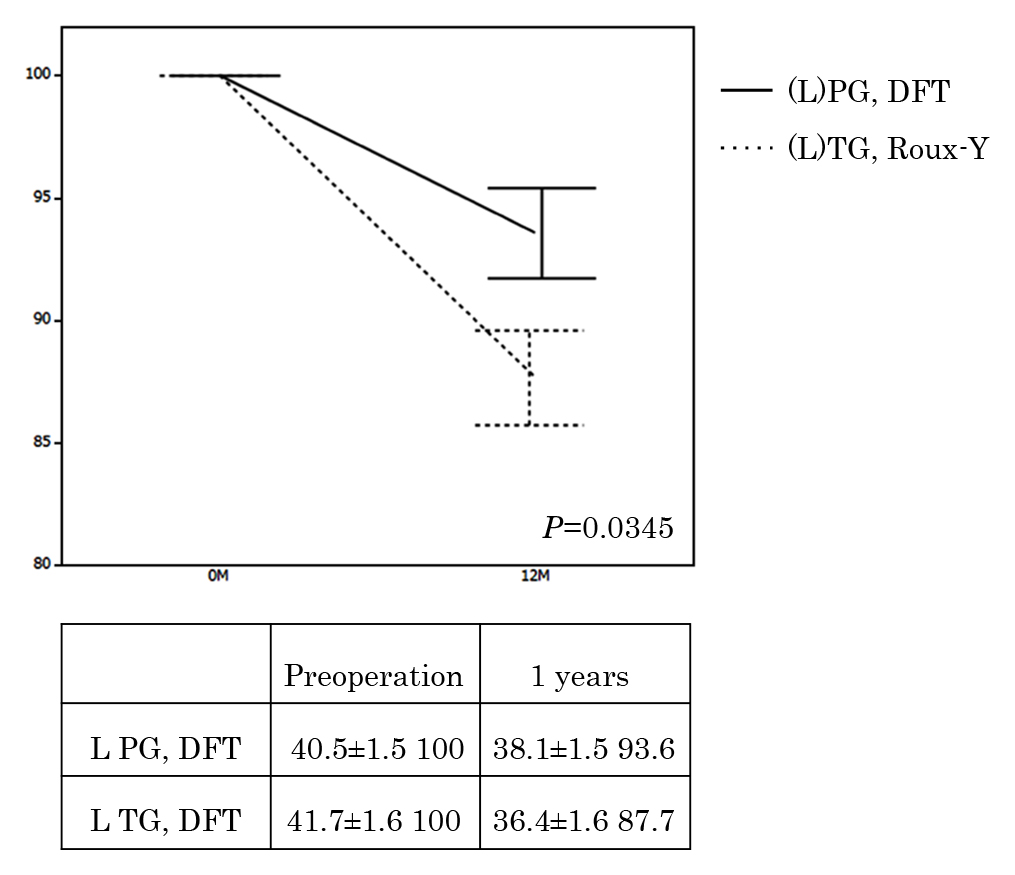
Body composition. Values are expressed as mean±standard deviation (%). SMI: skeletal muscle index (cm2/m2). SMI is calculated by correcting the total skeletal muscle area at the third lumbar vertebral level by height.
DFT施行したLPGとOPGの比較では,LPG群が有意に手術時間の延長を認めた(P<.0001)が,その他の出血量,周術期合併症,術後内視鏡検査所見,術後在院日数ではOPG群と有意な差は認めなかった(Table 3).
| LPG, DFT n=9 |
OPG, DFT n=10 |
||
|---|---|---|---|
| Age | 73 (57–79) | 76.5 (59–90) | P=0.2299 |
| Sex (M/F) | 7/2 | 8/2 | P=0.9056 |
| BMI (kg/m2) | 21.3±0.7 | 21.3±0.7 | P=0.9567 |
| Previous treatment (ESD) | 6 (66.7%) | 2 (20.0%) | P=0.0397 |
| Operation time (min) | 330 (284–445) | 193 (161–243) | P<0.0001 |
| Blood loss (ml) | 27 (5–220) | 59.5 (20–125) | P=0.9718 |
| No. of dissected lymph nodes | 37 (21–60) | 40 (24–65) | P=0.6259 |
| Perioperative complication | 0 | 0 | P=1 |
| Complications after discharge (Comfirmed by endoscopy) |
|||
| Stenosis | 3 (33.3%) | 1 (10%) | P=0.2129 |
| GERD | 0 | 1 (10%) | P=0.3297 |
| GradeM | |||
| Mortality | 0 | 0 | P=1 |
| Postoperative hospital stay | 14 (12–22) | 15.5 (10–22) | P=0.7838 |
Values are expressed as n (%), mean±standard deviation or median (range).
手術手技の進歩や,診断技術の発展により胃癌根治切除後の長期生存患者は増加傾向にあり,術後障害によるQOLの低下を予防することは重要な課題である.胃上部早期癌に対するPGは腫瘍学的な安全性は証明されたものの,最大の問題点は術後合併症や逆流性食道炎による嚥下機能低下,体重減少,QOLの低下のため胃全摘との選択に苦渋することも多い9)17).Postgastrectomy Syndrome Assessment Scale(PGSAS-45)を用いたPGとTGの全国他施設研究では,PG群で体重減少,下痢,ダンピングの有意な減少を認めたが,逆流症状はTGとの差はなくPGの最良な再建方法は確立していない17).当施設において,PGをする際に機械吻合を使用した食道残胃吻合を主軸に行っていた.2012~2013年の解析では,61%(8/13)のロサンゼルス分類Grade M以上の逆流性食道炎の発生率とTGとほぼ同等の体重減少(減少量:7.9 kg±1.74,減少率:87.1%±0.03)を認めており,2014年度よりDFTによる再建方法の導入を行った.
逆流性食道炎を引き起こす原因として,下部食道括約筋の損失,His角の消失が考えられている18).自験例においては,(L)PG+DFT群は(L)TG+Roux-Y群と比較し,術後逆流性食道炎の出現が有意に少なく,重度の逆流性食道炎は認めなかった.術後1年目の内視鏡検査所見では残胃に偽穹窿部が形成され,食道残胃の理想的な吻合部の形状と思われた.また,(L)PG+DFT群は縫合不全,術後膿瘍などの吻合部関連合併症の出現はなかった(0/17症例).このことからDFTは胃粘膜下層に埋め込まれた食道下端が胃内圧と胃漿膜筋層フラップに挟まる逆流防止弁として機能することが考えられる.また,食道残胃吻合の後壁縫合線は胃の内腔にあり,前壁吻合線の上を漿膜筋層フラップで覆うため,縫合不全の可能性が極めて低いことが合併症の予防に寄与していると考えられる.アプローチに関しても,LPG群はOPG群と比較して有意な手術時間の延長を認めたものの,出血量や合併症,術後在院日数には有意差はなく,腹腔鏡下でも安全に施行可能な術式と考えられた.LPG群の吻合時間中央値は116(92~158)minであり,吻合時間の短縮が今後の課題である.
PG術後のもう一つの問題は残胃癌発生である.幽門側胃切除術(distal gastrectomy;以下,DGと略記)後の残胃癌発生率0.4~2.5%に対して,PG後の発生率は3.6~9.1%と高く,積極的な術後内視鏡検査が望ましいとされる19).DFTによる再建方法は他のダブルトラクト法や空腸間置法と比較すると内視鏡検査が容易な点もメリットと考えられる.
栄養面に関して,術後1年目の血液生化学検査では血清TP,Alb,Hbに有意差は認めなかった.しかし,体重減少率は有意に(L)PG+DFT群で少なかった.これは残胃を温存することに加え,術後合併症や術後逆流性食道炎の少なさに伴う食事摂取量の上昇,QOLの向上が関連するものと考えられた.
近年,サルコペニアの主要診断項目である骨格筋量と胃癌関連の報告が散見され,低骨格筋量が胃癌術後合併症の増加や予後不良の予測因子として注目されている20)21).骨格筋の減少は,代謝障害やインスリン抵抗性と関連し胃癌患者の手術や術後補助化学療法への治療抵抗性を導くと報告されている22)23).自験例では,両群ともに術後の骨格筋の減少を認めたものの,(L)PG+DFT群の減少率が有意に低かった.(L)PG+DFTは骨格筋維持面でも優れている術式と考えられ,胃癌患者の治療抵抗性や長期予後改善に寄与することが示唆された.
一方で,LPG+DFT群では一定の確率で吻合部狭窄が出現していることは着眼すべきである.自験例でも有意差はなかったものの,LPG群はOPG群と比較して吻合部狭窄が多い傾向にあった.術後吻合部狭窄を生じた3症例は,いずれも術後約1~3か月に症状が出現し,外来での内視鏡下バルン拡張術が必要であった.1例は難治性であり,頻回の内視鏡下バルン拡張術に加えて,吻合部へのsteroid局注が必要となった.Muraokaら24)の報告でも同様にDFT導入初期の吻合部狭窄症例を報告しており,吻合の際のflap締め付けの調整と術中内視鏡を用いた吻合内腔の確保を行う対策を述べている.吻合部へのテンション軽減のために食道後壁とフラップ上縁を固定する際の食道の固定部を十分な距離(約5 cm)をとること,幅広い口径の吻合を心がけ,flapで吻合部を被覆する際に過度の吻合部へのテンションがかからないように幅広いflapの作成や積極的に術中内視鏡を使用することなどの工夫が吻合部狭窄軽減のために必要であり,吻合手技の定型化が重要である.
本研究にはいくつかの限界があり,第一に小規模単一施設内での検討であること.第二に後方視的な解析であり,実際の自覚する症状やQOLの改善の有無に関するアンケート調査を行っていない点である.
胃癌の中で最も術後QOLが低下すると考えられる胃上部癌に対して,術後障害を軽減する手術法や再建方法を検索することは今後も引き続き課題である.(L)PG+DFTは,胃上部早期癌の術後のQOL向上に貢献できる術式となりうる可能性が示唆された.
利益相反:なし