2020 年 53 巻 11 号 p. 882-891
2020 年 53 巻 11 号 p. 882-891
症例は73歳の女性で,上腹部痛を契機に認められた4.5 cm大の肝内胆管癌(intrahepatic cholangiocarcinoma;以下,ICCと略記)を疑って肝右3区域切除術を施行,中分化型の腫瘤形成型ICCと診断された.再肝部分切除術は,①初回術後2年1か月,肝S1の2 cm大の単発再発,②初回術後2年9か月,肝S1の3 cm大の単発再発,③初回術後3年8か月,肝S2の1.5 cm大の単発再発,④初回術後5年9か月,肝S3の2 cm大の単発再発,⑤初回術後6年11か月,肝S2に3 cm大の単発再発,に対して行った.再切除した腫瘍はいずれも中分化型の腫瘤形成型ICCの所見で被膜浸潤および脈管侵襲を認めなかった.現在,初回手術後12年以上経過したが無再発生存中である.ICC切除例として希少な症例と考えられ報告する.
A 73-year-old woman underwent right hepatic trisectionectomy for a mass forming type of intrahepatic cholangiocarcinoma (ICC) of 4.5 cm in size. She then underwent five resections for intrahepatic recurrence at the following times after the initial surgery: i) 2 years and 1 month, 2 cm in segment 1, ii) 2 years and 9 months, 3 cm in segment 1, iii) 3 years and 8 months, 1.5 cm in segment 2, iv) 5 years and 9 months, 2 cm in segment 3, and v) 6 years and 11 months, 3 cm in segment 2. Histopathologically, all the resected tumors were diagnosed as the mass forming type of ICC with moderately differentiated adenocarcinoma, but without capsule or vessel invasion. The patient remains alive and disease-free at 12 years after the initial surgery. We report a rare case of long-term survival achieved with repeated resections for intrahepatic recurrences of ICC.
肝内胆管癌(intrahepatic cholangiocarcinoma;以下,ICCと略記)の再発様式は残肝多発再発やリンパ節などの他臓器遠隔転移を伴う場合が多く,再肝切除の適応は限定的と考えられる1)2).一方,他臓器転移を伴わない残肝単発再発に対して再肝切除術を行った症例は予後が比較的良好との報告がある3)~5).今回,我々はICC根治切除後に来した5回の異時性残肝再発に対してその都度再肝切除術を施行した.初回手術から計6回の肝切除術を施行し,12年以上が経過した現在,無再発生存が得られている希少な症例であり,文献的考察を加えて報告する.
患者:73歳,女性
主訴:上腹部痛
既往歴:10年前に脳梗塞を発症,後遺症なく抗凝固療法は行わなかった.高血圧症にてアムロジピン5 mg/日を内服していた.
家族歴:父が脳梗塞.
生活歴:喫煙なし.飲酒なし.
手術歴・輸血歴:なし.
現病歴:前医で上記既往疾患に対してフォロー中に上腹部痛を自覚,CTで肝腫瘍を指摘され当科紹介となった.
受診時現症:身長143 cm,体重41.7 kg.眼瞼結膜に貧血,黄疸を認めなかった.心音・呼吸音異常なし.腹部平坦,軟,上腹部に軽度の圧痛を認めた.肝触知せず.波動触知せず.下肢浮腫なし.
血液検査所見:血清LDHが266 IU/l,ALPが391 IU/lと上昇していたが,その他の生化学検査,血算,凝固系に異常を認めなかった.肝炎ウイルス検査はHBs抗原,HBs抗体,HBc抗体,HCV抗体はいずれも陰性であった.Indocyanine greenテストは15分停滞率4.2%で,liver damage Aであった.腫瘍マーカーはCEA,AFP,PIVKA-IIいずれも正常範囲内であったが,CA19-9が75.0 U/mlと高値を呈した(Table 1).
| Peripheral Blood | Blood chemistry | Viral markers | |||
| WBC | 5,280/ul | T-bil. | 0.4 mg/dl | HBsAg | (−) |
| NEUT% | 64.2% | AST | 27 IU/l | HBsAb | (−) |
| LYMP% | 30.1% | ALT | 33 IU/l | HBeAg | (−) |
| MONO% | 4.0% | LDH | 266 IU/l | HBeAb | (−) |
| EOS% | 1.7% | ALP | 391 IU/l | HBcAb | (−) |
| BASO% | 0.0% | ChE | 211 IU/l | Anti-HCV | (−) |
| RBC | 455×104/ul | γ-GTP | 11 IU/l | ||
| Hb | 13.2 g/dl | Amy | 52 IU/l | Tumor markers | |
| Ht | 40.5% | TP | 7.2 g/dl | CEA | 2.8 ng/ml |
| MCV | 89.0 fl | Alb | 4.3 g/dl | CA19-9 | 75.0 U/ml |
| MCH | 29.0 pg | BUN | 21.0 mg/dl | AFP | 1.9 U/ml |
| MCHC | 32.5 g/dl | Cre | 0.78 mg/dl | PIVKA-II | 16 U/ml |
| Plt | 28.8×104/ul | Na | 140 mEq/l | ||
| Coagulation | K | 5.0 mEq/l | |||
| PT | 89.0% | Cl | 108 mEq/l | ||
| APTT | 30.5 s | CRP | 0.14 mg/dl | ||
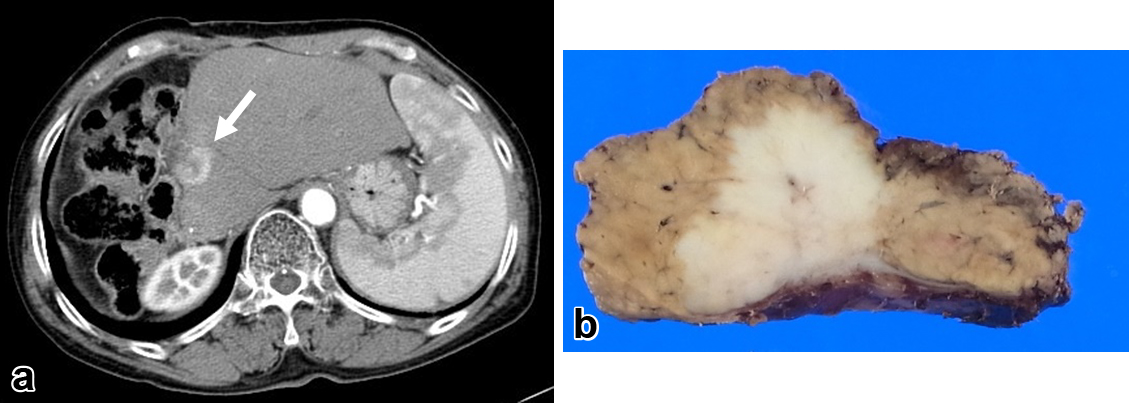
初回手術前腹部造影CT所見:肝内側区域および前区域を主座とし,グリソン右1次分枝を圧排する4.5 cm大の腫瘤を認めた.腫瘤は八頭状で,動脈相では辺縁に造影効果を認めたが内部造影は不良で,門脈相では腫瘤内部が不均一ながら遅延性に濃染された(Fig. 1a, b).

a) Abdominal contrast-enhanced CT before the initial operation revealed a mass of 4.5 cm in size located mainly in the median and anterior segments with poor internal contrast in the arterial phase. b) The mass compressed the right primary branch of the Glisson capsule (arrow) and stained with a delay in the portal phase. c) Macroscopically, the resected specimen from the initial operation was a yellow-white elastic hard tumor of 4.5 cm in size with well-defined and irregular margins. d) Histopathologically, the tumor cells were moderately differentiated adenocarcinoma with papillary proliferating grand ductal structures (HE stain ×4).
臨床経過(1):経皮径肝的門脈塞栓術を施行後に肝右3区域切除術および肝門部リンパ節郭清術を施行した.切除標本内に黄白色で境界明瞭,辺縁不整で,4.5 cm大の弾性硬の充実性腫瘍を認めた(Fig. 1c).病理組織学的検査にて腫瘍は乳頭状に増殖する腺管構造をともなう中分化型腺癌の像を呈しており(Fig. 1d),腫瘤形成型のICCと診断した.腫瘍はグリソン右1次分枝を圧排していたが脈管侵襲は認められず,脈管内に腫瘍栓は認めなかった.切除断端は癌陰性で,郭清したリンパ節に転移は認めなかった.また,背景肝はA0/F0相当の正常肝であった.原発性肝癌取扱い規約(第6版)に準じて,ICC,腫瘤形成型,中分化型腺癌,S4/5/8,H2,4.5×3.5 cm,T2,im(−),Ig,Fc(−),Fc-Inf(−),Sf(−),S0,N0,Vp0,Vv0,Va0,B0,P0,SM(−),NL,fStage IIと診断した.術後フォローとして,腫瘍マーカーとしてCEAおよびCA19-9の測定と造影CTまたはEOB造影MRIによる画像検査を3か月から6か月に1回のペースで施行していた.
臨床経過(2):初回術後2年1か月,造影CTにて残肝のS1に2 cm大の腫瘤を認めた(Fig. 2a).腫瘤は辺縁に造影効果を認め内部造影は不良であった.ICC術後肝内再発が第一に疑われ,全身状態に問題がなく,肝外病変を認めなかったことから手術適応と判断した.手術は腫瘍を含めた肝S1部分切除術を施行した(Fig. 2b).腫瘍は肝S1表在であったが,肝実質側では腫瘍から1 cm以上のマージンをとって切除した.病理組織学的に切除した腫瘍は2 cm大の中分化型腺癌で脈管侵襲は認めず,切除断端は癌陰性であった.術後は患者の希望により化学療法は導入しなかった.
a) 2 years and 1 month after the initial operation, follow-up abdominal contrast CT revealed a mass of 2 cm in segment 1 of the liver (arrow). b) Macroscopic view of the resected specimen in the second operation showing a white solid tumor of 2 cm in size.
臨床経過(3):初回術後2年9か月(2回目手術後8か月),EOB造影MRIで残肝S1に3 cm大の腫瘤を認めた(Fig. 3a).2回目手術時と同様に肝外病変はなく,単発のICC肝内再々発と判断し,全身状態良好であったことから肝S1部分切除術を施行した(Fig. 3b).術後に改めて化学療法の導入を検討し,患者が同意されたためS-1内服(80 mg/日,2週間内服,1週間休薬)を開始したが,好中球減少を来し,全身倦怠感が持続遷延するため開始後6か月で終了した.
a) 2 years and 9 months after the initial operation, follow-up abdominal contrast MRI revealed a mass of 3 cm in segment 1 of the remnant liver (arrow). b) Macroscopic view of the resected specimen in the third operation showing a white solid tumor of 3 cm in size.
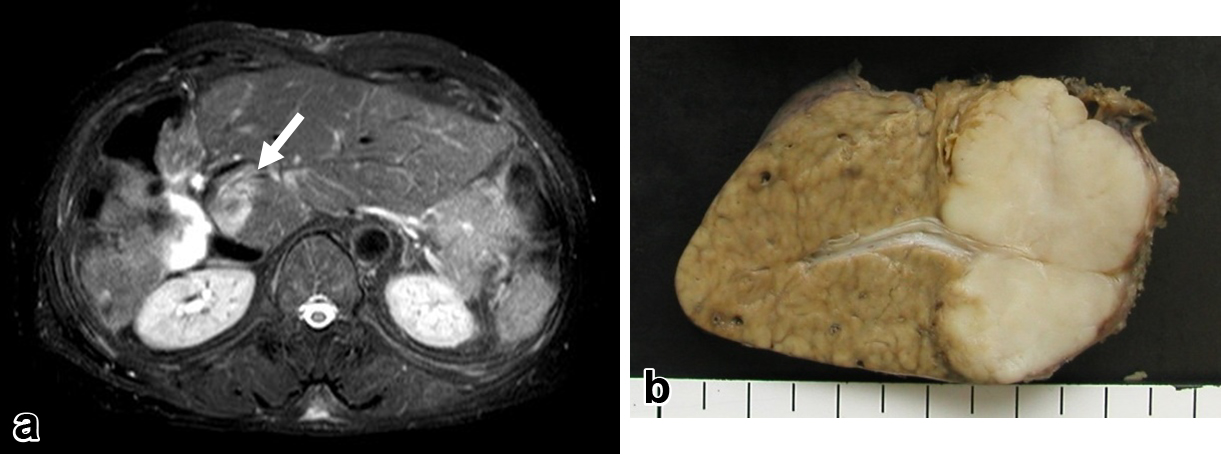
臨床経過(4):初回術後3年8か月(3回目手術後11か月),EOB造影MRIで残肝S2,左肝静脈根部近傍に1.5 cm大の単発腫瘤を認め(Fig. 4a),腫瘍を含めた肝S2部分切除術を施行した(Fig. 4b).腫瘍の主要脈管への浸潤所見はなく左肝静脈は温存した.

a) 3 years and 8 months after the initial operation, follow-up abdominal contrast MRI revealed a mass of 1.5 cm in segment 2 of the liver, near the root of the left hepatic vein (arrow). b) Macroscopic view of the resected specimen in the fourth operation showing a white solid tumor of 1.5 cm in size without invasion of the major vessels.
臨床経過(5):初回術後5年9か月(4回目手術後2年1か月),造影CTで肝S3表在に2 cm大の腫瘤を認め(Fig. 5a),腫瘍を含めた肝S3部分切除術を施行した(Fig. 5b).

a) 5 years and 9 months after the initial operation, follow-up abdominal contrast CT revealed a mass of 2 cm in segment 3 of the liver (arrow). b) Macroscopic view of the resected specimen in the fifth operation showing a yellow-white solid tumor of 2 cm in size.
臨床経過(6):初回術後6年11か月後(5回目手術後1年2か月)には造影CTで肝S2に突出して内部が均一に濃染される3 cm大の単発腫瘤を認め(Fig. 6a),肝S2部分切除術を施行した(Fig. 6b).

a) 6 years and 11 months after the initial operation, follow-up abdominal contrast CT revealed a mass of 3 cm projecting outside segment 2 of the remnant liver (arrow). b) Macroscopic view of the resected specimen in the sixth operation showing a yellow-white solid tumor of 3 cm in size.
臨床経過(3)~(6)においては臨床経過(2)と同様,画像検査と臨床経過よりICC術後肝内再発を疑った.いずれにおいても肝外病変はなく,肝予備能および全身状態は保たれており手術適応と判断した.初回手術以降,腫瘍マーカーはCEA,CA19-9のいずれも一貫して正常範囲内で推移していた.
病理組織学的検査において,2回目手術以降の再肝切除標本の腫瘍計5個はいずれも初回手術と同様,中分化型腺癌で被膜浸潤および脈管侵襲を認めなかった.全例,切除断端は癌陰性であった.また,腫瘍結節内には腫瘍細胞に取り囲まれるように門脈域を含むグリソン鞘が残存しており,正常肝組織と腫瘍領域が共存する所見がみられた.腫瘍領域に肝細胞癌成分の混入は認めなかった(Fig. 7a~e).免疫染色検査を追加したところ,いずれの腫瘍組織もcytokeratin(以下,CKと略記)7陽性(Fig. 8a),CK19陽性(Fig. 8b),CD56陰性(Fig. 8c),AFP陰性(Fig. 8d),Glypican3陰性(Fig. 8e)で,混合型肝癌および細胆管細胞癌は否定的であった.再肝切除した病変は互いに病理組織学的および免役組織学的検査所見が類似しており,臨床経過と総じていずれも腫瘤形成型ICCの異時性肝内再発として相違ないと判断した.また,背景肝は計6回の手術のいずれもA0/F0の正常肝の所見であった.
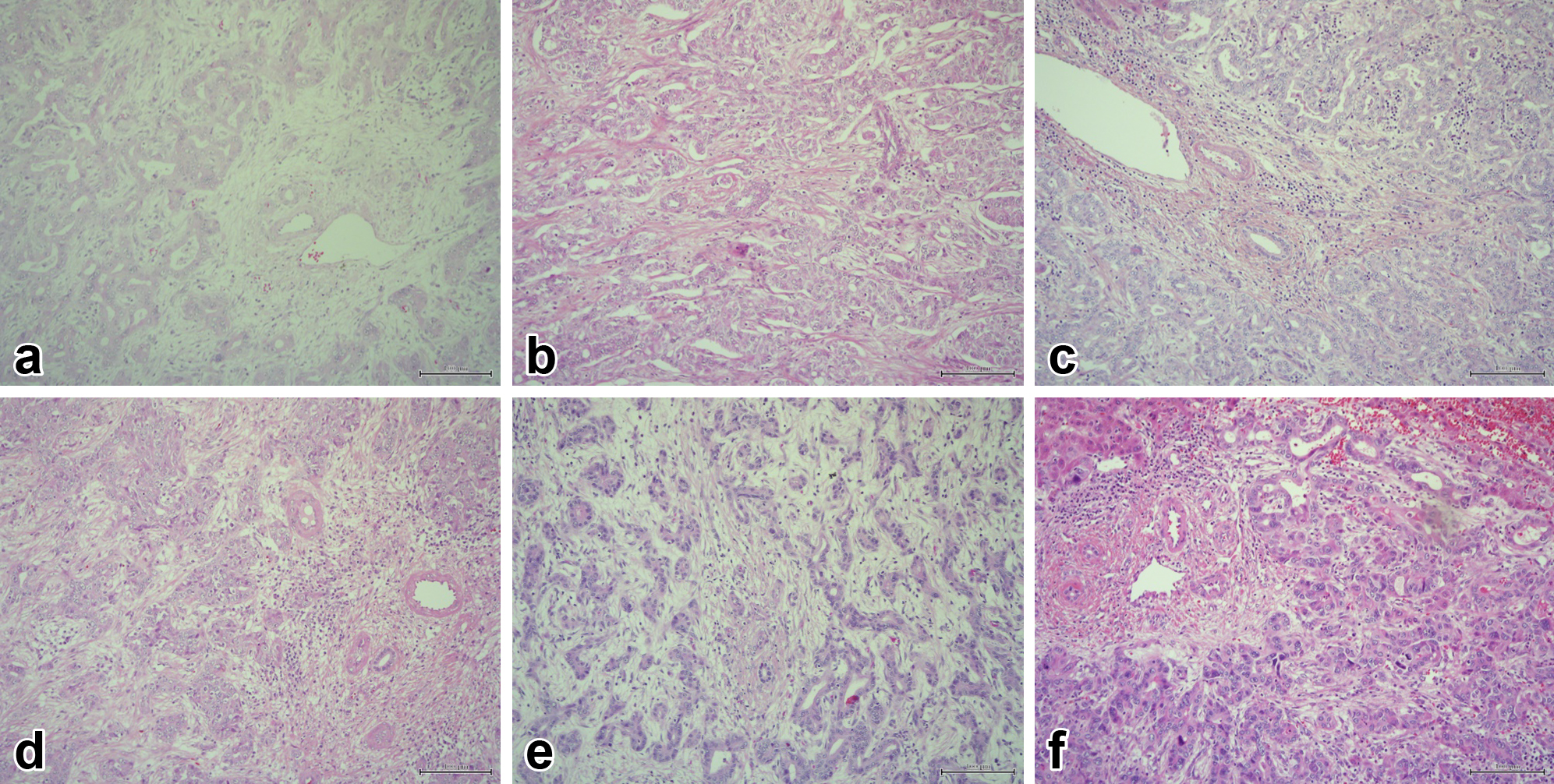
Histopathological findings of all tumors resected by repeated hepatectomy revealed moderately differentiated adenocarcinoma without capsule or vascular invasion, as in the initial operation. A Glissonean sheath including the portal vein remained in the tumor nodule so as to be surrounded by tumor cells, indicating that normal and tumor tissue coexisted (a initial, b second, c third, d fourth, e fifth, and f sixth operation, HE stain ×4).

Immunochemically, tumor cells were positive for cytokeratin 7 (a) and cytokeratin 9 (b) and negative for cytokeratin 56 (c), AFP (d) and Glypican 3 (e).
6回目の手術以降も化学療法は行わずに外来で定期検査による外来フォローを継続中である.初回手術より12年4か月(6回目手術後5年5か月)が経過したが,画像検査上も再発所見は認めていない.
ICCは原発性肝癌の約4%と頻度の少ない腫瘍であるが,全世界的に増加傾向にある6).ICCはその肉眼分類が重要であり,それにより臨床像,画像所見,浸潤形式,切除成績が異なるとされる7).いわゆる腫瘤形成型,胆管浸潤型,胆管内発育型の3型に肉眼分類されるが,全体の68.7%と最も多くを占めるのが腫瘤形成型である8).腫瘤形成型ICCでは肝内転移が重要な予後因子となるため,肝葉切除や区域切除など系統的肝切除を選択する必要があり9)10),切除症例の検討報告によれば,予後規定因子として肝内転移,リンパ節転移,神経周囲浸潤などが抽出されている5).
肉眼型にかかわらずICCに対する治療は手術切除が唯一の根治治療だが,予後は一般的に不良であり,根治切除後でも術後5年生存率は44.9%と報告されている8).再発治療は化学療法が中心であるものの切除を含めて治療方針は確立されておらず,有効な治療手段に乏しいことがその理由として挙げられる11).ICCの再発形式として最も頻度の高い残肝再発は,それが多発再発である場合や,リンパ節,肺,腹膜などの他臓器再発を伴う場合が多い.ICC切除後10~20%の症例に残肝再発を含む再発巣切除が行われているものの5)12),肝内再発に対する再肝切除の奏効例は限られる.中でも,再肝切除を複数回行った報告は極めて少ない.
PubMed(検索期間1950年~2019年12月)で,「intrahepatic cholangiocarcinoma」,「recurrence」,「repeated hepatectomy」をキーワードに検索し,また医学中央雑誌を検索(検索期間1964~2019年,会議録を除く,キーワード:「肝内胆管癌」,「再発」,「再(肝)切除」)した範囲で,ICC残肝再発に対する再肝切除について検討が行われた誌上報告は症例報告を含めて26編であった.そのうち,2回以上の再肝切除を行った症例は,検索しうるかぎり自験例を含めて8例のみであった13)~16).Bartschら13)の報告では,ICC術後肝内再発を来した13例に計18回の再肝切除が施行され,うち3例に2回,1例に3回の再肝切除が行われている.そして,再肝切除が行われた症例は化学療法や放射線療法など切除以外の治療が行われた症例に比べて生存期間中央値が有意に長かった,と報告している.臨床経過が確認できた自験例を含む4例14)~16)の内訳は,男性2例,女性2例で,初発時の平均年齢は68(57~74)歳であった.施行された再肝切除の回数は2例が3回,1例が4回で,自験例が5回と最も多かった.これら4症例での計15回の再肝切除において,1回の再肝切除につき切除された再発巣が単発であったのが11例,多発(2~3個)であったのが4例であった.初回手術から最初に肝内再発を来すまでの期間は平均47.3(15~25)か月と晩期再発であり,そして,初回手術からの生存期間は平均83.7(50~144)か月で,いずれも自験例が最長であった(Table 2).経過中に肺転移を来したものや,残肝再発に対して肝動注療法を併施したものもあるが,いずれの症例においてもICCは腫瘤形成型で,再肝切除がその都度病勢のコントロールに寄与すると判断されていた.
| No. | Author/ Year |
Age/ Sex |
Information of primary tumor | Information of recurrent tumor | Outcome after initial resection (months) | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Initial hepatectomy | Histology | Lymph node metastasis | Stage (6th) | Duration after initial resection to the first recurrence (months) | Maximum number of resected tumors per hepatectomy | Number of repeated hepatectomy | ||||
| 1 | Kurosaki14)/2005 | 74/M | Extended left bisectionectomy | tub2 | − | II | NA | 1 | 4 | 72, alive |
| 2 | Fujisaki15)/2007 | 69/M | Extended lateral sectionectomy and partial hepatectomy (S4) | NA | NA | IV A | 15 | 2 | 3 | 50, alive |
| 3 | Morise16)/2008 | 57/F | Left trisectionectomy and MCT | tub2 | + | IV B | 24 | 3 | 3 | 65, alive with lung metastases |
| 4 | Our case | 73/F | Right trisectionectomy | tub2 | − | II | 25 | 1 | 5 | 148, alive without recurrence |
ICC: intrahepatic cholangiocarcinoma, tub2: moderately differentiated tubular adenocarcinoma, NA: not available, MCT: microwave coagulation therapy
以前に我々はICC術後の異時性リンパ節再発および肺転移再発に対して各々切除を行い,長期生存が得られた症例を報告している17).肝内再発と同様,ICC術後の肝外再発に対する外科的治療のコンセンサスは得られていない.我々は,肝外再発を来した病変が限局化されており,かつ進行が緩徐な晩期再発例に対しては,切除を含めた集学的治療により長期予後が期待できる,と報告した.今回の自験例を通じて,肝内再発においても病巣が限局しており完全切除可能な状態であれば,切除回数に関係なく切除意義はあると考える.ただし,肝予備能が良好であることや心肺を含めた臓器機能が良好であることが前提となる.Fuら18)はICC術後肝内再発症例に対して経皮的ラジオ波焼灼療法(percutaneous radiofrequency ablation;以下,RFAと略記)を行い,局所無再発生存期間の中央値が21.0か月,術後合併症が5.6%であったと報告している.再発巣が3 cm以下で手技的に穿刺が可能であれば,焼灼療法は切除と比較して治療成績に有意差はないものの合併症は有意に低率であったとの報告もある19).RFAはその低侵襲性と低率な術後合併症の観点から,ICC術後肝内再発に対する治療のオプションとして排除はできないと考えられた.
自験例において5回もの再肝切除を行いえたのは,手術の度に患者の全身状態および肝予備能が良好であったことはいうまでもないが,肝外転移を有さず再発病変が限局しているという条件を満たしていたことが大きい.再発部位は同亜区域内に集中せず異なる亜区域内からも発生しており,いずれの病変も互いに同一箇所から発生したことを示唆する所見はなく,再発毎に発生部位は異なっていた.また,再発病変はいずれも肝実質側では腫瘍から1 cm以上のマージンをとって切除を行っており,全例ともに切除断端は癌陰性であったことから局所再発は否定的であった.そして,再肝切除の度に術前画像および術中所見で単発の再発巣以外に他病変は認められず,各々の再発までの期間が8か月から2年1か月と比較的長期間であり,再発病変はいずれも肝内転移ではなく異時性肝内再発として相違ないと考えられた.腫瘍自体の生物学的特性を免疫組織学的に検索したが,混合型肝癌および細胆管細胞癌は否定的であり,その他特記すべき新知見はなかった.ただし,病理組織学的に腫瘍結節内に肝正常組織と腫瘍領域が共存する所見がみられており,通常みられる腫瘤形成型ICCと比較して腫瘍内における癌の占居率が低率であった.このことが病勢をコントロールしうる要因となった可能性はある.同様の所見を有する場合は再発を来したとしても積極的な局所療法が奏効するタイプのICCである可能性がある.また,ICCの画像診断において,山本ら20)は造影CTで濃染するICCは臨床像や組織像が非濃染ICCと明らかに相違しており,切除成績は非濃染ICCと比較して明らかに良好であったと報告している.特に腫瘍内部が動脈相で均一に高吸収となる腫瘤形成型ICCは,リンパ節転移が少なく切除後の予後が極めて良好とされる21).理由として,分化度が低くなるにつれて壊死や繊維化の程度が増加し,さらに神経浸潤や血管浸潤の率が高くなるため,腫瘍非濃染例において悪性度が高くなると推測されている22)23).自験例において造影CTで評価した際の再発腫瘍も高濃染結節であった.画像所見からICCの切除成績を予測できる可能性があるとされるが20)23),再発病巣にも適用されることであり,再肝切除の治療方針に有用である.
肝細胞癌の再発でみられるように単発のICCが術後に繰り返し発生する可能性があることは念頭におくべきである.そして,ICCの残肝再発に対する治療方針はいまだ確立していないが,治療戦略の一つとして,リンパ節を含め他臓器転移を伴わない腫瘤形成型ICCの残肝再発は,切除可能であれば再肝切除の適応となりうる.そして,2回目以降の肝内再発も同条件が満たされており,肝予備能が保たれていれば,自験例の如く積極的な再肝切除により予後延長の恩恵を享受する可能性がある.
利益相反:なし