2020 年 53 巻 6 号 p. 487-495
2020 年 53 巻 6 号 p. 487-495
Perivascular epithelioid cell tumor(以下,PEComaと略記)は多分化能を有するperivascular epithelioid cell由来の腫瘍の一群を指し,比較的まれな疾患とされる.症例は45歳の女性で,スクリーニング検査で施行した腹部超音波検査で肝S2に多血性腫瘍を指摘され,肝細胞癌の診断で精査治療目的に紹介となり,腹腔鏡下肝S2部分切除術を行った.背景肝は慢性B型肝炎であり中等度の炎症は認めるものの線維化は目立たなかった.腫瘍径は2 cmで,免疫染色検査でαSMA,HMB45が陽性であったことから肝原発のPEComaと診断した.肝原発のPEComaは特にまれであり,良悪性の診断基準についてはまだ確立されていないが,術前に肝細胞癌との鑑別が困難であったことも含め示唆に富む症例と考えられた.
Perivascular epithelioid cell tumor (PEComa) is a family of rare mesenchymal tumors, derived from perivascular epithelioid cells. We report a case of laparoscopic hepatectomy for primary hepatic PEComa. A 45-year-old woman was referred to our hospital with a diagnosis of hepatocellular carcinoma because screening abdominal US revealed a hypervascular tumor in segment 2 of the liver. Laparoscopic partial hepatectomy was performed. The tumor was 2 cm in diameter and finally diagnosed as primary hepatic PEComa because it was immunohistochemically positive for both αSMA and HMB45. The background liver tissue showed moderate inflammation due to chronic hepatitis B virus infection but showed no fibrosis. The primary hepatic PEComa is extremely rare and criteria for malignancy have not yet been established. We believe this case is worth reporting because it is a rare pathology with difficulty in distinguishing from HCC.
Perivascular epithelioid cell tumor(以下,PEComaと略記)は多分化能を有するperivascular epithelioid cell(以下,PECと略記)由来の間葉系腫瘍の一群を指し1),筋原性マーカーとメラノサイトマーカーの陽性を示すまれな疾患とされる.その定義はいまだ確定的ではなく,基本的には良性腫瘍とされるが悪性化や転移の報告も散見される2)3).また,PEComaはあらゆる臓器に発生しうるが,その中でも肝原発の報告はさらにまれとされている.今回,我々は初診時に肝細胞癌と診断され腹腔鏡下肝部分切除術を行い,術後に肝原発のPEComaと判明した1切除例を報告する.
症例:45歳,女性
主訴:なし.
現病歴:検診でHBs抗原陽性が指摘され,スクリーニング目的で施行した腹部超音波検査で肝左葉に2 cm大の腫瘤を認めた.精査で行った腹部造影CTにて肝細胞癌の診断で当科紹介となった.
既往歴:特記事項なし.
家族歴:特記事項なし.
生活歴:飲酒:なし.喫煙:なし.
輸血歴:なし.
内服薬:なし.
身体所見:身長166.1 cm,体重53.1 kg,体温36.3°C,意識清明.眼瞼結膜に貧血なし.眼球黄染なし.腹部は平坦で軟.肝脾は触知せず.腹部に手術瘢痕なし.
血液検査所見:術前血液検査では炎症反応の上昇は認めず,肝胆道系酵素は正常,血小板数27.3×104/μl,PT 97.3%,ICG15分値は13.5%と軽度上昇していたがChild-Pugh A(5点),肝障害度Aと肝機能は良好であった.肝炎ウイルスマーカーではHBs抗原陽性,HBs抗体陰性,HBc抗体陽性,HBV-DNA 3.4 Log IU/ml,HCV抗体陰性であり,感染経路は不明であったが非活動性キャリアであった.腫瘍マーカーはAFP 3.8 ng/ml,PIVKAII 10 mAU/ml,CEA 1.0 ng/ml,CA19-9 15.7 U/mlといずれも正常範囲内であった(Table 1).
| 【hematology】 | 【blood biochemistry】 | |||
| WBC | 3,900/μl | AST | 27 U/l | |
| Hb | 11.0 g/dl | ALT | 25 U/l | |
| Pltatelet | 27.3×104/μl | ALP | 155 U/l | |
| 【coagulation】 | γ-GTP | 27 U/l | ||
| PT | 97.3% | T-Bil | 0.9 mg/dl | |
| PT-INR | 1.02 | Alb | 4.0 g/dl | |
| APTT | 29.6 sec | Cr | 0.62 mg/dl | |
| 【tumor marker】 | CRP | 0.04 mg/dl | ||
| AFP | 3.8 ng/dl | HbA1c | 5.6% | |
| PIVKAII | 10 mAU/ml | ICGR15 | 13.5% | |
| CEA | 1.0 ng/dl | 【serological test】 | ||
| CA19-9 | 15.7 U/ml | HCVAb | 0.06 | (−) |
| HBsAg | >250 | (+) | ||
| HBcAb | 10.27 | (+) | ||
| HBV-DNA | 3.4 | Log IU/ml | ||
腹部超音波検査所見:肝S2に2.1×1.8 cm大の低エコー腫瘤があり,境界明瞭粗造で内部不均一,後方エコーは不変であった(Fig. 1).また,カラードプラではhypervascularであった.
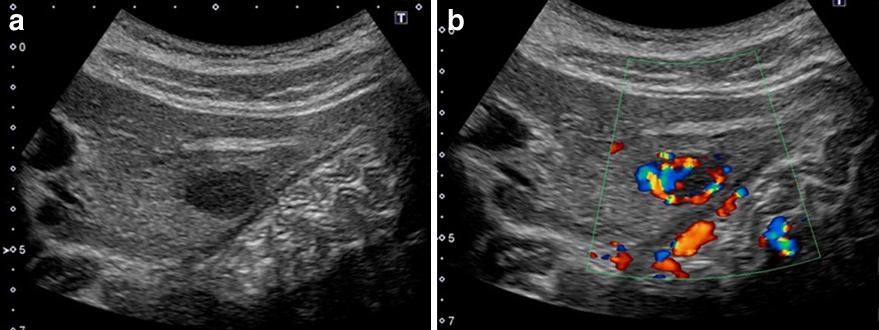
Abdominal US showed a well-demarcated hypoechoic tumor 20 mm in diameter in segment 2 of the left lobe (a). Color doppler US indicated hypervascularity of the tumor (b).
腹部ダイナミックCT所見:術前CT(Fig. 2a:動脈相,b:門脈相,c:平衡相):肝表面は整,辺縁は鋭であり腹水は認めなかった.肝S2に単発で2.0 cm大の占居性病変を認め,early enhance/delayed wash-outを示した.明らかな脈管侵襲は認めなかった.
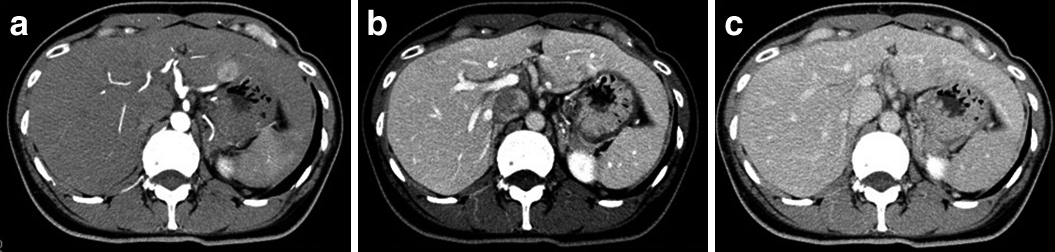
Enhanced CT demonstrated clearly a demarcated high density tumor (20×18 mm) in the arterial phase (a). Delayed wash out was revealed in the portal and late phase (b, c).
左肝動脈は胃十二指腸動脈から分岐する破格を認めた.
EOB-MRI所見:肝S2の腫瘍はT1強調像でin phase/out-of-phaseとも低信号(Fig. 3a),T2強調像で高信号(Fig. 3b),拡散強調像では高信号(Fig. 3c)を呈していた.EOB dynamic造影では動脈優位相で全体が濃染し(Fig. 3d),60,150秒後にはdelayed wash-outを伴っていた(Fig. 3e, f).肝細胞相では肝内に他の孤立性低信号は指摘されなかった(Fig. 3g).

T1-weighted MRI showed a well-marginated low intensity (a), and T2-weighted MRI and diffusion weighted image showed the same lesion with hyperintensity (b, c). Gd-EOB-DTPA enhanced MRI revealed early enhancement during the hepatic arterial phase (d). Delayed wash out was shown in 60 seconds and 150 seconds after injection (e, f). The tumor showed low intensity on hepatocyte phase (g).
以上より,背景肝や各種画像の造影パターンからは肝細胞癌が第一に考えられ,腹腔鏡下肝S2部分切除術を施行した.
手術所見:全身麻酔+硬膜外麻酔下,手術体位は砕石位とした.臍にカメラ用ポート,左右肋弓下内側にそれぞれ12 mmポート,左右肋弓下外側にそれぞれ5 mmポートを挿入し5ポートで手術を施行した.腹水や播種は認めなかった.肝臓は表面整で辺縁鋭,肝臓の線維化を示唆する所見は見られなかった.腫瘍は術前診断通りS2表面に存在した.Pringle法で出血コントロールを行いつつcrash & clamp法で肝実質を切離し標本を摘出した.手術時間7時間18分,出血20 ml,輸血なし.
切除肝重量は35 g,腫瘍は一部肝表に露出する2 cm大の腫瘍で肉眼型は原発性肝癌取扱い規約第6版に準じると多結節癒合型であった.脈管への浸潤は明らかでなかった(Fig. 4a).
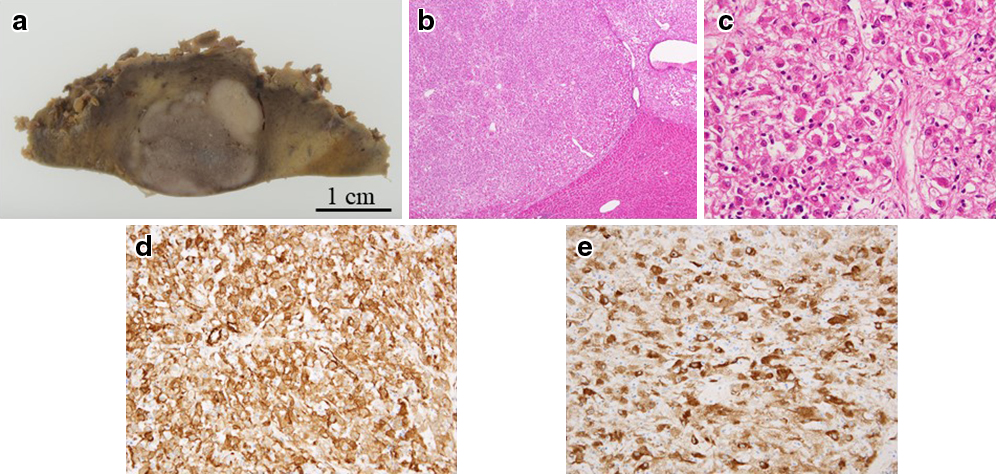
The cut surface of the resected specimen showed the pattern of confluent multinodular type. The tumor showed well-defined cell borders but had no capsule (a). The tumor cells had clear to granular, light eosinophilic cytoplasm (b: ×40 Magnification, c: ×400 Magnification). On immunostaining (×200 Magnification), the tumor cell was positive for αSMA (d) and HMB45 (e).
病理組織学的検査所見:割面では漿膜下に白色~灰白色充実性分葉状の20×13 mmの腫瘤を認めた(Fig. 4a).組織学的には,境界明瞭であるが周囲に被膜は有さず,ごく一部に浸潤性の進展を認めた.腫瘍細胞は淡明~好酸性顆粒状の胞体を有し,びまん性に増殖しており,核分裂像や壊死は認められず,異型はなかった(Fig. 4b, c).免疫染色検査では,AE1/3,hepatocyteは陰性,αSMA,HMB45がびまん陽性(Fig. 4d, e),Melan-A,HHF35,h-caldesmonは一部に陽性を示し,s-100,desmin,calponinは陰性であった.腫瘍は,組織像,免疫染色検査の結果より肝原発PEComaと診断された.
術後経過:術後経過は良好であり,第4病日にドレーン抜去,合併症なく第8病日に退院となった.
PEComaは1992年にBonettiら4)が初めて提唱した概念であり,PECの分化から生じる腫瘍と定義された.骨・軟部腫瘍におけるWHO分類2013でtumors of uncertain differentiationに分類されているまれな間葉系腫瘍の一つである1).TFE3遺伝子の変異が診断の一助となるとされている5)がその診断基準については明確なものが存在しないのが現状である.病理学的には淡明ないし淡好酸性顆粒状胞体を有する上皮様あるいは紡錘形細胞が充実蜂巣状に増殖する1).免疫染色検査ではPECを主体として,平滑筋由来のマーカーであるαSMA,actinやcalponin,そしてメラノサイト由来のマーカーであるHMB45やmelan-Aらが陽性であることから診断がなされる6).本症例においても,HE染色で腫瘍細胞は淡明~好酸性顆粒状の胞体を有しびまん性に増殖している所見からPEComaを疑い,免疫染色検査でHMB45およびαSMAの陽性から確定診断に至った.さらに,既往歴がなく病変が肝内に限局していたこと,および全身検索で他に病変を認めなかったことより肝原発と診断した.また,中年女性に多く発症するとされ,Bleekerら7)の234例の報告では年齢中央値が43歳,全体の79%が女性であった.PEComaはPEC由来の腫瘍であり,PECについてはまだ十分に明らかになっていないが,血管壁周囲に存在する1)2)7).それゆえPEComaは全身のあらゆる臓器に発生しうるが,好発する部位としては腎臓や泌尿生殖器,子宮が挙げられる8)~11).ただし他にも縦隔,上咽頭,頬粘膜,腹壁,皮膚,脊髄,十二指腸,小腸,結腸,直腸,肝円索,鎌状間膜,胆道,膵臓,乳腺,肺,副腎などさまざまな臓器から発生したPEComaが報告されており6)7),de novo腫瘍として発生する原発臓器は明らかとなっていない.PEComaは血管筋脂肪腫や肺clear cell sugar tumor,リンパ脈管筋腫症を包括する概念であるが,Martignoniら12)はPEComaを主として脂肪細胞を含まない腫瘍と定義し,従来の血管筋脂肪腫と区別して報告している.本症例のような脂肪成分やリンパ管成分を含まず,PECがモノクローナルに増殖している肝原発のPEComaの報告は特に少なく,良性あるいは悪性の少数の報告があるのみである.医学中央雑誌で1964年から2019年8月の期間で「血管周囲類上皮細胞腫」,「肝」,PubMedで1950年から2019年8月の期間で「perivascular epithelioid cell tumor」,「hepatic」または「liver」をキーワードとして検索した結果,28編の報告がみられた(Table 2)10)11)13)~38).肝原発PEComaはあらゆる年齢に発生しうるが,特に30代から50代の女性に多いとされ39),これは紡錘型のPECにはプロゲステロン受容体が発現しており,形態変化へのプロゲステロンの関与が示唆されている12).
| No. | Author | Year | Age | Sex | Tumor size (cm) | Symptom | Tumor marker | Location | Number of tumor | Early enhance | Treatment |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Fang11) (2 cases) | 2007 | 56/63 | F | 5.1/NE | discomfort/(−) | (−) | caudal lobe | single | (+) | resection |
| 2 | Della Vigna13) | 2008 | 46 | F | 3.5 | (−) | NE | left lobe | single | (+) | resection |
| 3 | Paiva14) | 2008 | 51 | F | 0.8 | pain | NE | left lobe | single | NE | resection |
| 4 | Akitake15) | 2009 | 36 | F | 3.5 | (−) | (−) | left lobe | single | NE | resection |
| 5 | Strzelczyk16) | 2009 | 57 | F | 17 | pain | (−) | right lobe | single | NE | resection |
| 6 | Tan17) (7 cases) | 2012 | 33–75 | F: 6, M: 1 | 2.5–8.5 | (−) | (−) | right: 5, left: 1, both: 1 | single: 6, multiple: 1 | (+) | resection |
| 7 | Khaja10) | 2013 | 51 | F | NE | (−) | NE | left lobe | single | (+) | resection |
| 8 | Shen18) | 2013 | 55 | M | 1.6 | (−) | (−) | right lobe | single | (+) | resection |
| 9 | Zhao19) | 2013 | 58 | M | 7.6 | pain | (−) | right lobe | single | (+) | resection |
| 10 | Patra20) | 2013 | 50 | F | 15 | pain | (−) | right lobe | multiple | (+) | resection |
| 11 | Yu21) | 2013 | 41 | F | 2.2 | pain | (−) | right lobe | single | (+) | resection |
| 12 | Ameurtesse22) | 2014 | 63 | F | 8 | pain | (−) | left lobe | single | (+) | resection |
| 13 | Liu23) | 2014 | 25 | F | 5.4 | (−) | (−) | right lobe | single | NE | resection |
| 14 | Bergamo24) | 2014 | 31 | F | NE | vomiting | NE | right lobe | single | (+) | NAC+resection |
| 15 | Abhirup25) | 2015 | 72 | F | 10 | pain | (−) | right lobe | single | (+) | resection |
| 16 | Maebayashi26) | 2015 | 58 | M | 4.5 | discomfort | NE | left lobe | single | (+) | resection |
| 17 | Liu27) (5 cases) | 2015 | 26–57 | F: 4, M: 1 | NE | discomfort: 2, (−): 3 | (−) | NE | NE | (+) | resection |
| 18 | Tang28) | 2016 | 32 | F | 7 | pain | (−) | right lobe | single | (+) | resection |
| 19 | Hao29) | 2016 | 51/30/25 | F/F/M | 8/2.5/8 | (−) | (−) | caudal/right/right | single | (+) | resection |
| 20 | Hekimoglu30) | 2017 | 79 | F | 5.2 | pain | (−) | right lobe | single | (+) | resection |
| 21 | Miyaji31) | 2017 | 45 | F | 2 | (−) | (−) | right lobe | single | (+) | resection |
| 22 | Han32) | 2017 | 36 | F | 3.7 | discomfort | AFP: 10.8 | right lobe | single | (+) | resection |
| 23 | Guan33) | 2017 | 40 | F | 7.5 | (−) | (−) | right lobe | single | (+) | TACE+RFA |
| 24 | Son34) | 2017 | 56 | F | 3.2 | (−) | (−) | right lobe | single | (+) | resection |
| 25 | Kirnap35) | 2018 | 22 | F | 14 | palpable mass | (−) | left lobe | single | (+) | resection |
| 26 | Voulgari36) | 2018 | 47 | M | 7 | (−) | (−) | left lobe | single | NE | resection |
| 27 | Dezman37) | 2018 | 24 | F | 2 | pain | NE | left lobe | single | (+) | resection |
| 28 | Ma38) (13 cases) | 2018 | 28–72 | F: 12, M: 1 | 1–19.8 | pain: 4, (−): 9 | (−) | NE | single | (+) | resection |
| 29 | Our case | 45 | F | 2 | (−) | (−) | left lobe | single | (+) | resection |
NE; not evaluated
画像所見に関してはMRIのT1強調像で低信号,T2強調像で高信号を示し,造影早期相で濃染される特徴が報告されているが信号強度は非特異的であった13)18)27).また,PEComaはdynamic studyにおいて,肝細胞癌と同様に動脈相で早期濃染をうけるものの,流出血管については肝静脈であるという知見が多くなっている40).肝細胞癌の主な流出血管は門脈系であり41),これらの流出血管に焦点をおいた精査,すなわち静脈へのドレナージがリアルタイムで描出できるソナゾイド造影下超音波検査や血管造影が,肝細胞癌との鑑別に有用であったとの報告も見られた15).しかし,他の多血性腫瘍との鑑別は必ずしも容易ではなく28)39),診断は病理検査所見によるところが大きい.
背景肝と術前画像所見からは肝細胞癌と診断し腹腔鏡下肝切除術を行ったが,PEComaは本症例のように術前診断が得られないこともしばしばあり37)38),他の悪性腫瘍との鑑別が困難である場合がある.一方で経皮的肝生検などでPEComaの診断がついていたとしても切除適応とする報告も多い(Table 2).その理由として大多数が良性であるものの,浸潤性に増大する腫瘍や早期の再発例,あるいは他臓器からの転移再発といった形式での発生も報告されており,近年ではmalignant potentialを有する腫瘍と考えられることが多いためである42)~44).PEComaの診断がついた場合には上述の理由から外科的切除が第一選択と考えられるが,総合的な判断で手術を行わずに経過観察を行う場合にもその悪性度を常に念頭に置く必要がある.
Folpeら45)は腫瘍径と病理学的組織所見からPEComaの悪性度分類を報告している.すなわち①腫瘍径5 cm以上,②浸潤発育パターン,③高度の核異型・細胞密度増加,④核分裂像(1/50 HPF以上),⑤壊死,⑥脈管侵襲の六つのhigh risk factorを挙げ,二つ以上を満たす場合をmalignant ,いずれも当てはまらない場合をbenign,そして①核多型性もしくは多核巨細胞,または②腫瘍径5 cm以上のいずれか一つのみを満たす場合をuncertain malignant potentialと分類した.術後のフォローアップ方法・期間についても標準化されたものは存在しないが,このリスク分類にそれに照らし合わせると,本症例は六つのhigh risk factorのいずれも満たさず良性に分類されたが,まれな症例であり悪性の可能性も否定はできないことから,術後は悪性肝腫瘍性疾患に準じて3か月毎の画像フォローアップを行うこととした.一方,Martignoniら12)の報告では悪性PEComaの55例について集計し,腎臓や子宮原発が多かったが,再発形式としては血行性転移やリンパ節転移,局所再発や腹膜播種などさまざまで,予後も不良な症例が多い.現在至適な治療法については確立されていないが,初発のPEComaや局所再発で切除可能な病変については手術療法が主たる治療法と考えられている2)35).一方で,PEComaの中には初診時に多発転移を有するような切除不能症例も存在し,このような症例に対しては,放射線治療と外科的切除の併用や肝動脈塞栓術とラジオ波焼灼術を併用した集学的治療の有用性が報告されている2)33).また,近年,抗腫瘍薬としてmTOR阻害剤の使用が報告されている46)~49).その背景としては,PEComaは結節性硬化症(tuberous sclerosis complex;以下,TSCと略記)と合併し,TSC遺伝子変異を認める場合がしばしばある.その遺伝子変異により,下流にあるmTOR活性が亢進し,腫瘍増殖をもたらしている可能性が考えられているため,このカスケードを阻害することで腫瘍縮小効果を期待するものである.こういった化学療法は特に多臓器転移や局所の高度進行例など切除不能例における治療の選択肢として今後効果が期待されている.
PEComaについてはさまざまな報告がされているが,その臨床病理学的特徴に関しては依然として不明な点が多い.我々の経験が今後の診断や治療の一助となることができれば幸いである.
利益相反:なし