2020 年 53 巻 8 号 p. 665-674
2020 年 53 巻 8 号 p. 665-674
症例は63歳の男性で,検診のUSで偶発的に前立腺背側に腫瘤性病変を指摘され,MRIで前立腺を圧排する直腸由来の腫瘍と診断された.腫瘍は歯状線より2 cmの直腸前壁左側に約2.5 cmの弾性硬な粘膜下腫瘍として認めた.画像所見から直腸gastrointestinal stromal tumor(以下,GISTと略記)と診断し切除の方針となった.腫瘍径が比較的小さかったため,機能温存も考慮し,transanal minimally invasive surgery(以下,TAMISと略記)に直腸局所切除術を施行した.肛門に単孔式デバイスを装着し,送気下に直腸壁を全層切除し腫瘍を摘出した.切除欠損部は鏡視下に縫合閉鎖した.直腸GISTは比較的まれな疾患であるが,下部直腸に発生した場合は侵襲の大きな術式を選択せざるをえない場合もある.近年,増加傾向である経肛門的直腸間膜全切除術(transanal total mesorectal excision;TaTME)で得られた知見も参考に,根治性と機能温存の両立を慎重に考慮したうえであれば,直腸GISTに対するはTAMISは安全かつ許容できる術式と考えられる.
We report a case of rectal gastrointestinal stromal tumor (GIST) that was treated with transanal minimally invasive surgery (TAMIS). The patient was a 63-year-old male who was found to have a tumor between the prostate and rectum on US. MRI showed a rectal tumor displacing the prostate ventrally. The submucosal tumor was approximately 2.5 cm in diameter in the left anterior wall of the lower rectum and the distal margin was 2 cm above the dentate line. Under a diagnosis of rectal GIST, local resection was performed by TAMIS, based on the relatively small size of the tumor and preservation of anal function. A transanal access device was inserted, and local resection of the tumor with full-thickness incision of the rectal wall was performed after creating a pneumorectum. The rectal wall defect was surgically closed. Rectal GIST is a relatively rare tumor of the gastrointestinal tract, and a tumor located in the lower rectum requires a conventional extended operation. TAMIS for a rectal GIST with careful consideration of both curative resection and preserving anal function seems safe and feasible using transanal total mesorectal excision (TaTME), which is progressively becoming more common.
Gastrointestinal stromal tumor(以下,GISTと略記)は全消化管に発生する間葉系腫瘍だが,直腸に発生するGISTは,消化管GISTの3~5%を占める比較的まれな疾患である1)~3).術式については腫瘍学的な根治性と機能温存の両立を考慮する必要があり,標準的な術式は存在しない.GISTにおける治療は外科的完全切除が原則であるため,直腸という解剖学的に制限された部位では,腫瘍の完全切除を優先させるために肛門機能の低下に影響する侵襲の大きな術式が選択されることもある.本症例は,下部直腸に発生したGISTに対して,肛門機能温存を考慮して,単孔式デバイスを用いてtransanal minimally invasive surgery(以下,TAMISと略記)にて直腸局所切除を行った.近年,主に直腸癌に対して施行される経肛門的直腸間膜全切除(trans anal total meseorectomy;以下,TaTMEと略記)で得られる解剖学的知見も,本症例のような直腸局所切除の際に有用であり,直腸GISTの治療方針も交えて若干の文献的考察を加えて報告する.
症例:63歳,男性
主訴:なし.
既往歴:気胸,鼠経ヘルニア
生活歴:機会飲酒.喫煙なし.
現病歴:検診目的に近医で施行された腹部超音波検査で前立腺背側に腫瘤を指摘され,前立腺由来の腫瘍が疑われたため当院泌尿器科を紹介受診となった.精査目的に施行された腹部MRI(Fig. 1a~c)にて,前立腺左葉と直腸との間に約30 mmの腫瘤性病変を認めたが,前立腺との境界は保たれており直腸壁由来の腫瘍が疑われた.

MRI of the pelvis. (a) T1-weighted MRI showed a low intensity tumor behind the left side of the prostate. (b, c) In T2-weighted and diffusion-weighted MRI, the tumor gave high intensity signals (arrows).
入院時現症:身長176 cm,体重65 kg,BMI:21.0.直腸指診にて腫瘍は可動性の乏しい弾性硬な腫瘤として触知し,また肛門縁から4 cmの部位に腫瘍の下端を触知した.
血液検査所見:血算生化学検査では特記すべき異常所見は認めず,CA19-9およびCEAともに正常範囲内であった.
下部消化管内視鏡検査所見:肛門縁から約4 cm,歯状線より約2 cmの部位に粘膜下腫瘍を疑う粘膜の膨隆を認め直腸粘膜には異常所見は認めなかった.超音波内視鏡所見で,腫瘍は直腸筋層から連続される約27 mmの腫瘍性病変として描出され,直腸粘膜下腫瘍と診断した(Fig. 2a, b).

(a) Colonoscopic examination revealed a submucosal tumor in the anterior rectal wall, and the distal tumor margin was 2 cm above the dentate line. (b) Endoscopic US showed a 27-mm hypoechoic lesion confined to the muscularis propria.
腹部MRI所見:直腸前壁左側に約27 mmのT2強調画像で比較的均一な内容の腫瘤として描出され,拡散強調画像で高信号を呈していた.直腸壁から発生した腫瘍が疑われ,腫瘍は被膜を有しており前立腺を含む周囲組織への浸潤を疑う所見は認めなかった(Fig. 1a~c).
腹部造影CT所見:直腸前壁から壁外性に発育し前立腺を背側から圧排する約27 mmの腫瘤を認め,内部は比較的均一で造影効果を認めた.腫瘤は直腸粘膜下層もしくは筋層からの発生が疑われた(Fig. 3).
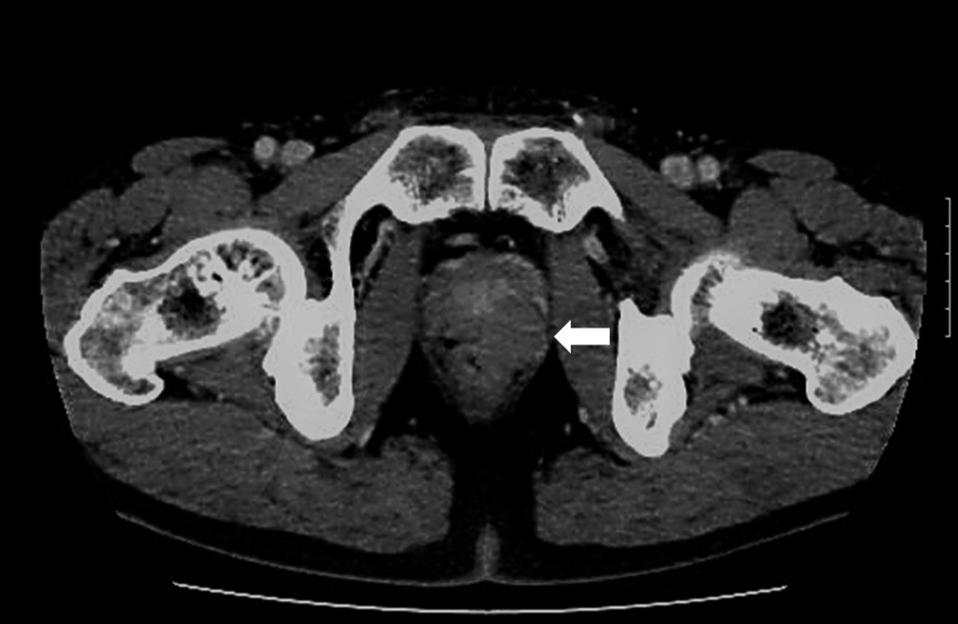
Contrast-enhanced CT showed a solid 27-mm tumor with slight enhancement located on the anterior left side of the rectal wall (arrow).
確定診断のためEUS guided fine needle aspiration biopsyも検討されたが,造影CTにおいて腫瘍から内腸骨静脈へ直接流入する血管を認めており,出血のリスクを考慮して行わなかった.以上の検査所見より,直腸筋層から発生した約27 mmの粘膜下腫瘍で,組織学的確定診断は得られなかったが直腸原発のGISTを第一に疑い切除の方針となった.腫瘍径は比較的小さく,周囲臓器との境界も保たれていたことから,術後の直腸機能温存と根治性の両立を考慮し,直腸部分切除をTAMIS下に行う方針とした.
手術所見:肛門にGELPOINT Path®を装着し,10 mmHgの送気圧で鏡視下に手術を開始した.腫瘍は直腸左側前壁に粘膜面の膨隆として確認できたため,腫瘍周囲に約1 cmのマージンを確保し全周性に粘膜にマーキングを行った.腫瘍肛門側2時の直腸壁から切開を開始し,直腸縦走筋を確認した後に直腸壁を全層切開し前立腺を確認した.直腸壁を切開し,口側へ剥離を進めるにあたり,12時の方向では直腸尿道筋および尿道の位置,1~3時の方向では口側へ剥離を進める際に骨盤神経叢(S4)および神経血管束を損傷しないようにその存在に留意した.11~12時方向では前立腺壁,1~4時方向では肛門挙筋を露出しながら,直腸壁の切開を口側へ向けて進めた.手術操作の大部分は電気メスを用いて行い,特に腫瘍の偽被膜を損傷しないように前立腺壁を露出しつつ腫瘍の口側まで直腸壁を全層に切開し,途中認めた腫瘍に交通する血管は超音波凝固切開装置を用いて切離し,腫瘍を含む直腸壁を摘出した.直腸壁欠損部は,吸収糸を用いて腸管軸に対して垂直方向に全層連続縫合で閉鎖し手術を終了した(Fig. 4a~d).手術時間は142分で,出血量は7 mlであった.
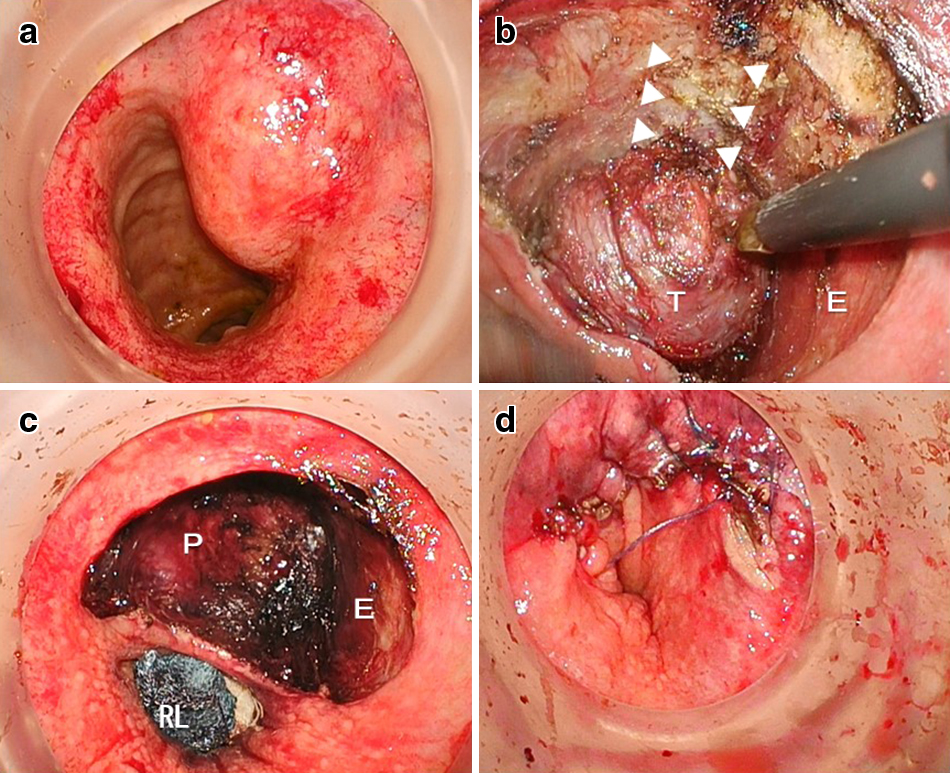
Intraoperative findings. (a) A submucosal tumor located on the left anterior rectal wall. (b) Arrowheads show the cut end of the rectourethral muscle located at the 0 o’clock position of the rectum. (c) The tumor was resected and the prostate was exposed. (d) The defect of the rectal wall was closed by suturing of the muscle layer with 3-0 V-Loc and 3-0 Vicryl. E: external sphincter, P: prostate, RL: rectal lumen.
摘出標本肉眼所見:摘出された腫瘤は偽被膜を有し,割面は白色充実性2.7×2.7×2.2 cmの腫瘍であった(Fig. 5).

Macroscopic findings. (a) The resected tumor was 27×27×22 mm in size. (b) The tumor was almost solid, whitish and partially necrotic.
病理組織学的検査所見:腫瘍は一部で出血と壊死を伴っており,直腸固有筋層を超えて浸潤を認めたが,切除断端は陰性であった.組織学的には紡錘形細胞の密な錯綜状増生から成り,免疫染色検査にてc-kit,CD34およびDOG-1が陽性,S100は陰性であり,GISTと診断された.Ki-67 labeling indexは21%で,核分裂像数は14/50 HPFと高値でFletcher分類4)でhigh risk categoryのGISTであった(Fig. 6a~d).

(a) Histological findings of the resected mass showed formation of spindle-shaped cells (HE staining, ×100). Immunohistochemical staining of the tumor cells for c-kit (b) and DOG-1 (c) gave strong positive findings (×400). (d) The MIB-1 index was 21% (×400).
術後経過:経過は良好で術後7日目に退院となった.術後は便失禁や排便回数の増加も認めず,排便機能は術前と変化なく保たれていた.昨日は退院後はadjuvant chemotherapy目的でimatinib 400 mg/日を開始し,術後16か月経過し再発なく継続中である.
GISTは食道から直腸までの平滑筋層もしくは粘膜筋板を発生母地とするcajal細胞由来の消化管間葉系腫瘍で,その発生部位頻度は胃60~70%,小腸20~30%,大腸5%,食道2~5%とされ,発症頻度としては人口10万人当たり年1~2人程度と報告されている1)~3)5).また,大腸に発生するGISTの大部分は直腸,特に下部直腸に多く発生するとされる.直腸GISTは出血などの自覚症状が出にくく,発見時には腫瘍径の大きい局所進行例として発見される場合が多いとされるが6),本症例では腹部エコーで偶発的に3 cmという比較的小さい腫瘍径で発見された.
GIST診療ガイドラインによれば5),GIST治療の第一選択は偽被膜の損傷を回避し肉眼的断端陰性を確保したR0切除である.また,GISTにおいてリンパ節転移はまれでリンパ節転移が予後因子とならないため,リンパ節郭清は推奨されておらず,GIST原発臓器の機能温存も念頭に置いた術式を選択する必要がある.直腸GISTに対する術式として,理論上は偽被膜の損傷を回避し十分な切除マージを確保したうえでの直腸壁全層局所切除が理想的な術式と考えられるが,骨盤腔の最深部に位置する直腸の解剖学的特徴もあり根治性が担保できない場合は,低位前方切除術や腹会陰式直腸切断術が選択されることとなり,その場合は手術侵襲も高度となり排尿機能や肛門機能へ影響がでる可能性も高くなる.このように直腸GISTでは,根治性と機能温存の両立を考慮する必要があるため,個々の症例に応じて過不足のない適切な術式を判断する必要がある.
直腸GISTに対する低侵襲な術式として,肛門機能を温存した局所切除が第一に挙げられるが,その到達法には経肛門,経会陰,経膣,後方アプローチなどいくつかの到達法がある.代表的な後方アプローチの方法としてKraske7)やMason8)の方法があるが,後方アプローチでは仙骨あるいは肛門挙筋の一部を切離し病変に到達するため,少なからず肛門機能の障害が懸念される.Tazawaら9)は,臀部弧状切開による後方アプローチの有用性を報告しているが,腫瘍の主座が直腸後壁に限られる問題がある.同様に経会陰および経膣アプローチは腫瘍が直腸前壁に主座を置く場合に限られるなどの問題があり,これらいずれのアプローチ法も術野が狭く視野の確保が難しく,術後合併症や周囲臓器損傷のリスクもあることなどからも標準的な術式とはいいがたい.一方,経肛門的な局所切除は肛門機能温存の点からは最も低侵襲な術式といえる.Parksら10)の方法では,開肛器を用いて直視下に腫瘍を切除する手術であるが,大きな腫瘍や口側の腫瘍では術野の確保が困難であり,手技の習熟を要するとされる.Buessら11)が開発した経肛門的内視鏡下マイクロサージャリー(transanal endoscopic microsurgery;以下,TEMと略記)は,二酸化炭素送気により拡張した直腸内腔を鏡視下に腫瘍の切除および縫合手技を行うことができる手術で,安定した視野の確保により直視下の経肛門的切除より局所再発率が低いとされる12).中木ら13)は直腸GISTに対して,TEMで局所切除を行うことにより,病理組織学的に断端陰性を確保できたと報告している.しかし,TEMのために特化した専用の器具が必要でコストがかかるうえ,手術手技の習得に時間を要することもあり一般に普及していない現状がある.一方,経肛門的鏡視下での局所切除の新たな術式として2010年にAtallahら14)が報告したTAMISは,単孔式腹腔鏡手術に用いるデバイスを肛門に装着し経肛門的に腫瘍を切除する手術であるが,通常の腹腔鏡手術に用いる器具で行うことができるためTEMと比較してコストがかからない利点がある.また,TEMのように特殊な手技を要さず技術的に単孔式手術からの応用が可能であることなどから,直腸腫瘍に対して世界的に普及しつつある術式である.
本症例は腫瘍径が約3 cmと比較的小さく,周囲組織への浸潤を疑う所見も認めなかったことから,局所切除でR0切除が可能と判断したため手術を先行する方針とした.アプローチ法として直視下での経肛門的切除も検討したが,腫瘍が壁外性に発育しており術野の確保が困難であることと直視下での欠損部の縫合閉鎖は困難であると判断し,良好な視野で切除および縫合を行うためGelPOINT pathを用いたTAMISを選択した.
直腸GISTにおける局所切除の適応については,腫瘍の局在,腫瘍径,周囲臓器への浸潤の有無など総合的に判断する必要がある.腫瘍の肛門縁からの距離に言及した報告は少ないが,Liuら15)は直腸GIST 21例の検討で,肛門縁より5 cm以内の腫瘍は局所切除が妥当で,拡大切除は局所進行もしくは再発腫瘍に限定すべきとしている.しかし,TEMやTAMISであれば,腫瘍が肛門縁から離れている場合でも良好な視野で切除することは技術的に可能であることから,肛門縁からの距離で局所切除を適応の可否を判断とする必要はないと考える.腫瘍径について,Hawkinsら16)の333例の直腸GISTの検討では,5 cm以下の腫瘍径では局所切除と拡大切除において5年生存率および断端陽性率に差は認めなかったとしている.また,Yasuiら17)の24例の直腸GISTの検討においても,腫瘍径が小さければ局所切除と拡大切除に局所再発の差はなく,2.8 cm以下のGISTに対しては局所切除の適応と結論づけている.一方,Jakobら18)は,36例の直腸GIST切除例の検討で,腫瘍径10~80 mm(中央値:40 mm)の直腸GISTに対して局所切除を行った21例中10例と高率に断端陽性であったことを報告している.以上より,周囲臓器への浸潤を認めずR0切除が可能な5 cm以下の直腸GISTに対しては,機能温存の面からは局所切除をまず第一に考慮するが,腫瘍の部位や局所切除の技術的な難度など腫瘍学的に安全性が担保されているかも含めて慎重に術式を検討する必要がある.局所切除を行う場合は,前述の通り,肛門機能温存の観点からは経肛門的アプローチによる切除が望ましい術式と考えられる.
医学中央雑誌(1964~2018年)で「直腸」,「GIST」,「経肛門」をキーワードに検索すると,14例の経肛門的切除の報告を認めたが,いずれも直視下経肛門的切除もしくはTEMによる切除で,TAMISもしくはTaTMEによる直腸GIST切除の報告例は認めなかった(会議録を除く).
直腸腫瘍に対するTAMISの検討では直腸癌が大多数を占めており,直腸GISTは直腸腫瘍の一部として含まれて検討されているに過ぎない19)20)ため,対象を直腸GISTに限ったTAMISの報告は少なく,その有用性や手技に関して定まった見解は存在しない.直腸GISTに対するTAMISの利点として,腫瘍の局在に影響されにくく,良好な視野において切除マージンを視認しながら局所切除を行うことが可能な点が挙げられる.本症例でも,腫瘍は前立腺と接していたことから,腫瘍肛門側で確実に直腸を全層切除し,前立腺を露出する層で剥離することが必要であったが,TAMISで行うことで良好な視野のもとにR0切除が可能であった.TAMISを行ううえで,直腸周囲の解剖の理解は極めて重要である.直腸癌に対するTaTMEにおいて,直腸周囲の解剖と手技の定型化についてはいまだ議論はあるが,TaTMEでは直腸壁を全周に渡って切開するため,腸管外の比較的わかりやすい解剖学的構造物から順に確認していくことが可能である.一方,直腸GISTでは腫瘍周囲の直腸壁のみを全層で切開するため,腸管外に確認できる解剖学的構造物は腫瘍の局在によって限られることに留意する必要がある.本症例では,腫瘍肛門側は歯状線すぐ口側に位置していたため,肛門側の直腸壁は肛門管内より切開し肛門挙筋を露出し確実にTMEの層を露出してから剥離を開始した.また,腫瘍は左側腹側に位置していたが,直腸腹側2時および10時方向は前立腺との間隙が比較的疎であることから,直腸2時方向で前立腺を露出させて,正中では尿道を損傷しないよう直腸尿道筋を認識したうえで切離を進めた.左側壁では仙骨神経S4を損傷しないことに留意して腫瘍を切除した.このように,腫瘍の局在により直腸壁を切開する部位は異なるため,TaTMEで得られる解剖学的知見を参考に,切離部位によって視認できる解剖学的構造物を常に留意して手技を進めることが肝要である.TAMISでは,切除後の直腸壁欠損部の縫合閉鎖が比較的容易に行えることも利点の一つとして挙げられる.本症例でも吸収糸による連続縫合で欠損部を縫合閉鎖したが,欠損部の縫合閉鎖は必ずしも必要ないとの報告もあり21),今後も検討が必要である.
また,TAMISは,器械吻合を必要とする通常の腹腔鏡手術や特殊な機器を要するTEMと比較して,医療経済的な面においても利点があると考えられる.本症例でも,単回使用の診材であるGELPOINT Path®を用いた以外は,電気メスと複数回使用可能な超音波凝固切開装置を使用し,直腸切除欠損部も吸収糸による縫合が可能であり,吻合器を用いる必要性もなく,医療コストの面からもTAMISは検討すべき術式の一つと考えられる.
GISTは,外科的切除とリスク分類に応じたimatinibによる術後補助療法を組み合わせた集学的治療を行うことが重要である.Fletcher分類の高リスクGIST症例に対して,術後imatinib治療1年間と3年間を比較した第III相ランダム化臨床試験では,imatinibの3年間内服により無再発生存期間および全生存期間の延長が認められ22),ガイドライン上も3年間のimatinib投与が推奨されている5).一方で,切除可能局所進行GISTに対するimatinibによる術前補助療法については,安全性と治療効果に関して良好な成績が報告されており23)~25),直腸GISTに限った術前imatinib療法においてもR0切除率および肛門機能温存率の向上,予後の改善が報告されているが26)27),術前療法の有用性については十分には確認されておらず,本邦のガイドラインでは臨床試験段階と位置づけている5).高度侵襲を伴う手術を要する症例や切除により術後のQOLが損なわれる可能性のある症例に対しては,術前補助療法も治療選択肢の一つとなることが期待されるが,本症例のように他臓器浸潤を伴わないR0切除が可能な5 cm以下の直腸GISTに対しては,腫瘍学的な安全性が確保できるか十分に検討したうえで,肛門機能温存を考慮したTAMISのような低侵襲手術も考慮すべきである.
直腸GISTは比較的まれな腫瘍であるため,腫瘍の局在,腫瘍径,切除範囲などを考慮し,根治性と手術侵襲の低減および機能温存の両立を目指した過不足のない術式および治療方針を症例毎に慎重に検討することが肝要であると考える.
利益相反:なし