Abstract
症例は56歳の女性で,2013年に他院で下行結腸の0-Isp病変に対して内視鏡的粘膜切除術が施行された.病理診断は腺腫内腺癌で,分割切除のため断端不明であった.4か月後に再検査を施行し,粘膜切除瘢痕部に腺腫病変の再発が確認された.手術を勧められたが,自己判断で通院中断となっていた.2017年に施行された大腸内視鏡検査で,前回瘢痕部に1型腫瘍が確認され生検で高分化腺癌と診断された.当科に紹介初診され,腹腔鏡下結腸左半切除術(D3)を施行した.病理検査ではadenosquamous carcinoma with adenoma component,T1b(SM massive),n0,ly0,v0であり,stage Iの最終診断となった.術後補助化学療法は施行せず術後4年1か月再発は認めていない.大腸癌における腺腫成分を伴う腺扁平上皮癌の症例は非常にまれであり自験例について報告する.
Translated Abstract
A 56-year-old woman underwent total colonoscopy (TCF) at another hospital in 2013. A 0-Isp polyp was found in the descending colon and resected by endoscopic mucosal resection (EMR). The polyp was diagnosed as adenoma histopathologically, but it was difficult to evaluate the resection margin because of split excision. Four months later, TCF revealed recurrence of adenoma at the scar from EMR. Although additional treatment was recommended, the patient stopped going to the hospital. In 2017, she underwent another TCF and a type 1 lesion was found in the recurrence region. She was referred to our hospital and underwent left hemicolectomy with D3 lymph node dissection. The tumor was diagnosed as adenosquamous carcinoma with an adenoma component (T1b (SM massive), N0, ly0, v0, fStage I). The patient did not receive postoperative adjuvant chemotherapy and survived without recurrence for 49 months. Adenosquamous carcinoma of the colon with an adenoma component is very rare. We report this case with a review of the literature.
はじめに
大腸悪性腫瘍は腺癌が大多数を占め,腺扁平上皮癌はまれである1).また,腺扁平上皮癌は進行癌での報告例がほとんどであり早期癌の報告は少ない.今回,我々は腺腫成分を伴う早期腺扁平上皮癌を経験したので若干の考察を加えて報告する.
症例
患者:56歳,女性
主訴:なし.
既往歴:なし.
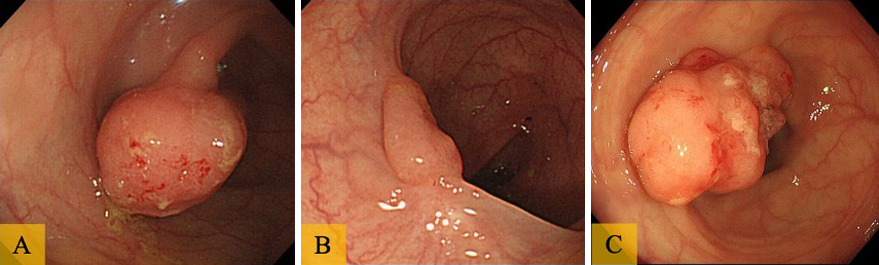
現病歴:2013年3月に近医で下行結腸の0-Isp病変に対して内視鏡的粘膜切除術(endoscopic mucosal resection;以下,EMRと略記)を施行され,病理結果はadenocarcinoma(tub1)in adenomaであった(Fig. 1A).分割切除であり水平断端・垂直断端は不明であり,再発が懸念され4か月後に下部消化管内視鏡検査(total colonoscopy;以下,TCFと略記)のフォローを施行したところ,瘢痕部より腺腫病変の再発を認めた(Fig. 1B).手術を勧められたが,自己判断により治療は中断されていた.2017年8月に精査を希望され近医でTCFを施行されたところ,前回の病変部に1型腫瘍を認め(Fig. 1C),手術希望のため当科紹介となった.
入院時現症:身長155 cm,体重48 kg,BMI 20.0,眼瞼結膜蒼白なし,腹部に異常所見なし.
入院時血液検査所見:血液検査は異常なく,腫瘍マーカーはCEA 1.0 ng/ml,CA19-9 3.5 U/ml,と正常範囲内であった.
TCF所見(EMR時:2013年3月):下行結腸に20 mm大の0-Isp病変を認めEMRを施行した(Fig. 1A).病理結果はadenocarcinoma(tub1)with adenoma,m,ly0,v0で病変は粘膜内に限局していた.分割切除のため断端の評価は困難であった.
TCF所見(EMR後再検査:2013年7月):FollowのCFでは,瘢痕部の中央に0-IIa型病変を認め,生検で高度異型度の腺腫病変の再発(tubular adenoma with moderate to severe atypia,group 3)を認めた(Fig. 1B).
TCF所見(術前:2017年8月):前回病変部に25 mm大の1型腫瘍を認め生検でadenocarcinoma(tub1),group 5)を認めた(Fig. 1C).
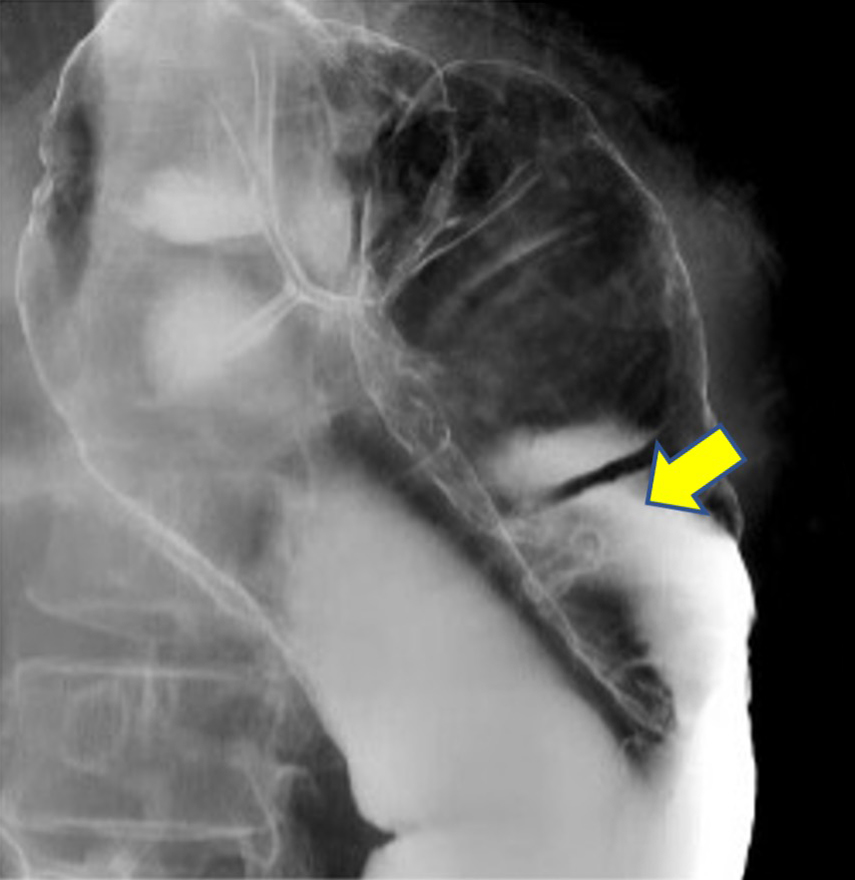
注腸造影検査所見(術前):下行結腸に角状変形を伴う病変を認めた(Fig. 2).
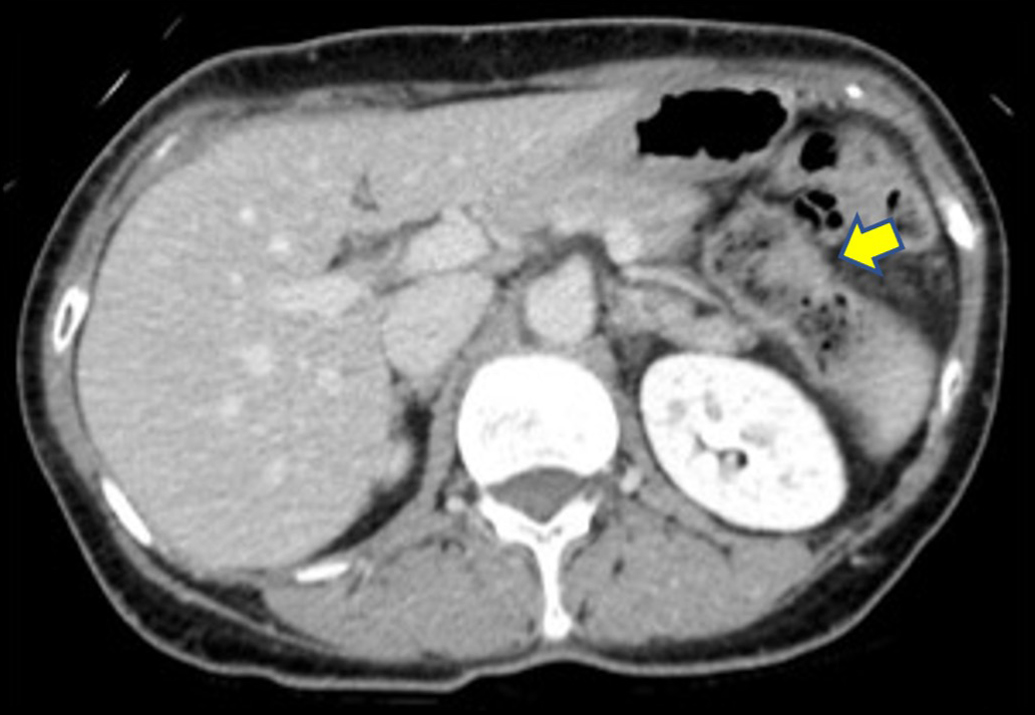
胸腹部造影CT所見(術前):下行結腸の脾彎曲近傍に管内に隆起する病変を認め,周囲への浸潤,リンパ節転移・遠隔転移は認めなかった(Fig. 3).
以上より,下行結腸癌cT2(MP)N0M0 Stage Iと診断した.
手術所見:腹腔鏡下結腸左半切除術(D3)を施行した.明らかなリンパ節転移や腹膜播種,肝転移は認めなかった.
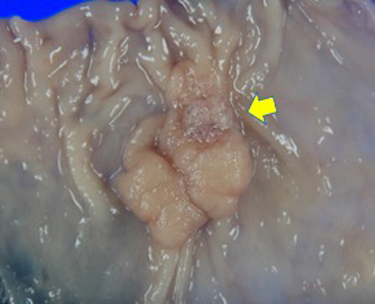
切除標本所見:下行結腸に17×15 mm大の0-Is型病変を認め(Fig. 4),病変部の一部にやや陥凹し白色調の領域を認めた(Fig. 5黄色矢印).
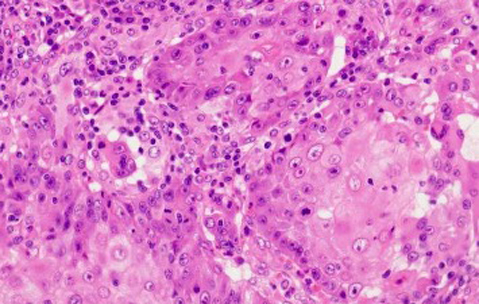
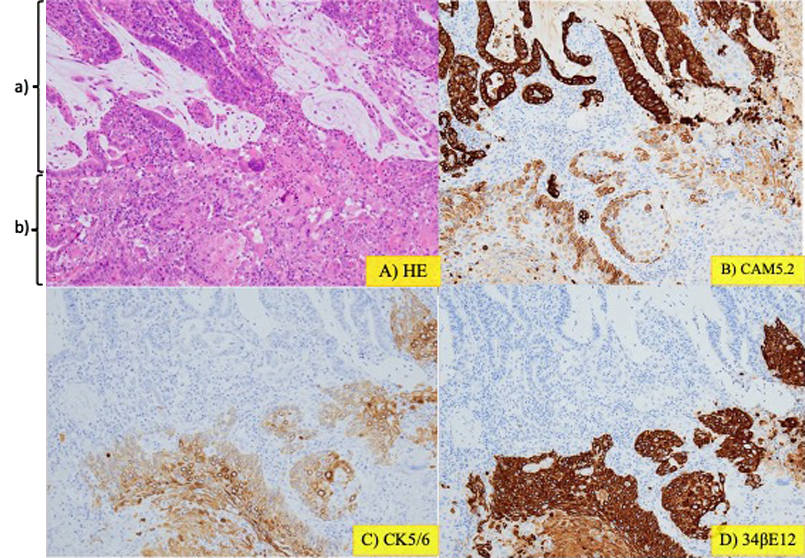
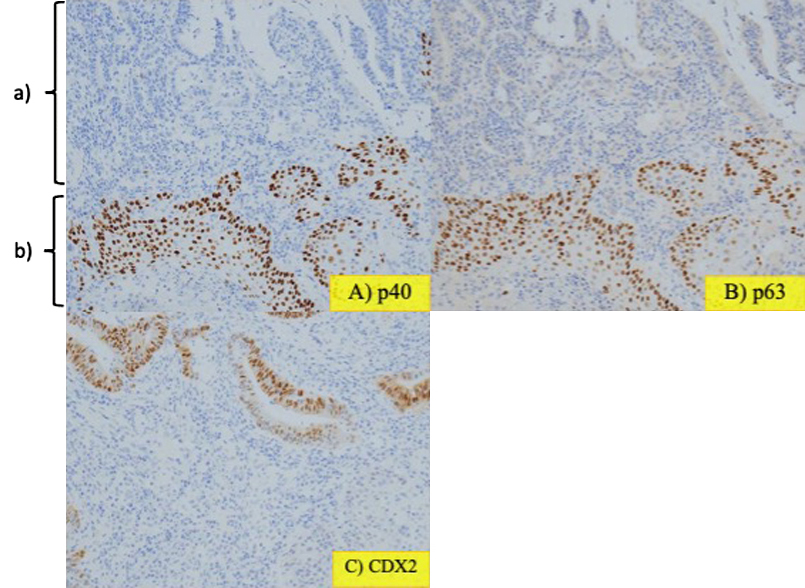
病理組織学的検査所見:白色調の部分を含めて切り出した標本には,高分化腺癌の一部に扁平上皮癌の領域を認めた(Fig. 6, 7).また,病変の他の部位では,細胞極性の保たれた腺管が増生する腺腫領域も認めた(Fig. 8).組織型の分布割合は,腺癌80%,扁平上皮癌10%,腺腫10%であった.免疫染色検査を行うと,扁平上皮癌の領域において扁平上皮癌のマーカーであるCK5/6,34βE12,p40,p63が各々陽性を示した(Fig. 9, 10).また,大腸腺癌のマーカーであるCK20,CDX2は腺癌領域のみ陽性であった.低分子ケラチンCAM5.2染色では,腺癌領域で陽性と示したのに加え,扁平上皮癌領域でも弱陽性を示した(Fig. 9, 10).腺癌および扁平上皮癌領域ではp53は陽性であったが,腺腫領域ではp53は陰性であった.
以上のより最終病理学的診断は,Desecending colon cancer,type 0-Is,17×15 mm,tub1>>tub2 with squamous differentiation and adenoma component(adenosquamous carcinoma with adenoma component),pT1b(SM massive, 1,800 μm),ly0,v0,pN0(0/22),pPM0,pDM0,pRM0であった.
術後経過:最終診断はcolon cancer,D,type0-Is,T1bN0M0 Stage Iと診断した.術後4年1か月無再発で生存中である.
考察
大腸癌取扱い規約第9版2)では,大腸腺扁平上皮癌は同一の組織内に腺癌と扁平上皮癌が共存しているものと定義される.本邦において,その割合は全大腸癌の0.1%とまれである1).
組織発生として,①異所性迷入扁平上皮由来,②未分化基底細胞由来,③粘膜の扁平上皮化生由来,④腺癌細胞の扁平上皮化生由来などの説がある.④が有力な説とされており,その根拠として1)腺癌領域と扁平上皮癌の移行帯の存在,2)扁平上皮癌領域でもCEA,CA19-9,CAM5.2染色で陽性を示す症例があることなどが挙げられている3)~5).自験例の免疫染色検査でも,腺癌の特徴を有する扁平上皮癌領域を認めた.また,扁平上皮化生細胞の発癌ポテンシャルは極めて低いと結論づけている報告6)もあり,本症例においては発症からの経過を踏まえると,adenoma-carcinoma sequenceから発生した腺癌が機械的刺激などにより扁平上皮化生を起こしたと推察する.
Yokoiら7)が,本邦での1989年から2007年までの70例の大腸腺扁平上皮癌の検討を行っている.占居部位は盲腸・上行結腸など右側結腸に多く(28%),SS以深の進行癌が多くを占めている.生存期間の中央値は13か月,5年生存率47.2%と予後が悪いと報告している.また,大腸腺扁平上皮癌の1年生存率52.9%と5年生存率47.2%は互いに近接した値であることから,多くの症例で1年以内に急速に増悪しうることを示唆している.
これまでの報告より,大腸腺扁平上皮癌は進行癌が多く予後不良で,本症例のような早期癌症例は少ないとされている.医学中央雑誌において,「腺扁平上皮癌」,「大腸」で検索すると,1964年から2021年の期間で82例(会議録を除く)の報告を認めた.82例のうち早期癌症例は自験例を含めて2例8)認めた.自験例のような腺腫成分を伴う早期腺扁平上皮癌の症例は検索しうるかぎり認めなかった.また,PubMedにおいて1950年から2021年の期間で「adenosquamous carcinoma」,「adenoma」,「colon」で検索を行ったが,海外での腺腫成分を伴う腺扁平上皮癌の報告は認めなかった.
早期癌の症例は,八木ら8)と自験例の2例でありいずれもEMR後に追加切除を施行した.八木ら8)の報告では,EMR後SM癌にて追加切除し治癒切除であったにもかかわらず,術後1年半で肝転移再発を認めた.また,術後1年目のCTで再発は認められず,半年という短い期間で病状が進行していることが示唆された.再発リスク因子としては,低分化癌(por)・リンパ管侵襲を認めた.早期癌であり術後補助化学療法は施行しなかったが,未分化癌・短期間での病状の進行を踏まえて,より慎重な経過観察,術後補助化学療法の適応も考慮されると報告している.
大腸癌腺扁平上皮癌の治療は外科的切除例が第一選択であり,化学療法・放射線療法については明確な指針はない5).扁平上皮成分は腺癌より2倍の増殖速度を示すという報告もあり6)扁平上皮癌への効果を考慮したレジメン選択を行う症例も認めた.松下ら5)は,上行結腸癌Stage IIIbに対して,術後補助化学療法として腺癌成分に対してFOLFOX4を施行したのち,扁平上皮成分に対してS-1+CDDPを施行し術後無再発で経過している.また,八木ら8)は,早期癌術後肝転移再発対してS-1+CDDPによる化学療法を施行し,肝転移の増悪はなく経過していると報告している.その他,術後補助化学療法として,5-FU単剤9),5-FU+LV10)にて無再発を維持している症例も認めた.
自験例は高分化腺癌(tub1)で脈管侵襲を認めなかったため術後補助化学療法を施行せずに無再発の状態を維持しているが,急速な進行を来しうる点を考慮し,慎重な経過観察が必要と考えられる.
利益相反:なし