2022 年 33 巻 5 号 p. 526-534
2022 年 33 巻 5 号 p. 526-534
敗血症性播種性血管内凝固(disseminated intravascular coagulation: DIC)は組織因子の放出を起点とする凝固カスケードの亢進と好中球―血小板―血管内皮の相互作用が複雑に関与したメカニズムで発症し,頻度,重症度ともに高い重要臨床課題の一つである.敗血症性DICに対して適切なタイミングで治療適応を検討するためには,日々繰り返し診断基準を用いてスクリーニングを行うことが重要であり,また血栓性微小血管障害症(thrombotic microangiopathy: TMA)などの類似の臨床像をきたす疾患と適切に鑑別を行う必要がある.敗血症における抗凝固療法の有効性はDICの有無,重症度によって異なる可能性があり,治療対象を適切に選定することが重要である.抗凝固療法を適切な時期に開始することも,その有効性に関与する重要な要素であり,最適な治療戦略を確立するためには,今後も研究を進めていく必要がある.
近年の医療水準の向上にも関わらず,全世界で年間約5,000万人が敗血症を発症し,うち1,100万人が死亡すると推定されている1).敗血症の病態を増悪させる重要な因子として全身性炎症反応と凝固線溶障害の相互作用が挙げられ,その最重症の形態が敗血症性播種性血管内凝固(disseminated intravascular coagulation: DIC)である2).敗血症性DICの本態は全身性の著しい凝固活性化状態であり,進行すると血管内皮障害と微小血栓形成によって,微小循環障害から多臓器障害が引き起こされ,転機に重大な影響を与える.近年の我が国の大規模観察研究では,敗血症の約51%がDICを併発し,またその死亡率はDICを併発していない症例と比較して有意に高いことが報告された3).したがって敗血症性DICは,その頻度,重症度共に敗血症診療における最重要課題の一つであり,迅速に診断し,適切な治療戦略を検討することが重要である.本稿では,敗血症性DICの病態,診断,および抗凝固療法の有効性に関して,国内外のエビデンスに基づいて概説する.
敗血症や重症外傷,熱中症など全身性炎症反応をともなう病態では急性炎症反応と凝固線溶反応のクロストークが病態の進行に大きく関与している.感染症によって生体に侵襲が加わると,病原微生物由来の病原体関連分子パターン(pathogen-associated molecular patterns: PAMPs)や損傷組織から細胞外へ逸脱した組織損傷関連分子パターン(damage-associated molecular patterns: DAMPs)が,単球や好中球などの免疫担当細胞上に存在するパターン認識受容体(pattern-recognition receptors: PRRs)にリガンドとして認識され,自然免疫応答が惹起される.敗血症における凝固線溶障害は,種々のPAMPsが組織因子の放出を誘導することで凝固カスケードが全身性に活性化されることが引き金となる.またこうした凝固カスケードによる病態進行のモデルに加えて,近年ではさらに好中球,血小板,血管内皮の活性化や細胞間相互作用によって凝固障害が進行するCell-Basedモデルが提唱されている4).この病態モデルでは最初期に血管内皮,単球などの組織因子が発現した細胞上で外因系凝固経路を介した少量のトロンビン生成を引き金として,血小板および第VIII因子あるいは第IX因子を含む凝固因子が活性化され,最終的には活性化血小板上における第Xa因子産生,Xa/Va複合体による大量のトロンビン生成(トロンビンバースト)が引き起こされることで,著しい凝固の活性化が引きこされるメカニズムを説明している.
また活性化した好中球によってNETs形成が進むことも凝固線溶障害と関連している.NETsは好中球核内のDNAやヒストン,好中球顆粒内の好中球エラスターゼ,ミエロペルオキシダーゼといった抗菌タンパクで構成され,活性化した好中球より能動的に放出される.細胞外に放出されたNETsは繊維状の構造物を形成することで病原体を捕獲して排除するとともに,凝固因子を含む様々な生理活性物質を放出し局所血栓の形成を促進する.形成された血栓は,病原体の他臓器への血行性播種を抑制し,局所免疫を活性化するとされ,この仕組みは免疫血栓と呼ばれる宿主防御的な仕組みである5).しかし炎症の遷延によって過剰なNETsが産生された場合は,免疫血栓が局所にとどまらずに全身に播種され微小循環障害を引き起こす.さらにNETsとともに放出されたヒストンH3などのDAMPsによって血管内皮障害が進行することも凝固線溶障害を進行に関与する.このように敗血症では凝固カスケードの活性化と好中球―血小板―血管内皮の相互作用の結果,全身性に著しい凝固活性化が引き起こされることで,最終的には敗血症性DICと呼ばれる最重症な病態へと進行する.
DICを引き起こす主要な基礎疾患として,敗血症,固形癌,血液悪性腫瘍が知られているが,特に敗血症に起因するDICの比率は高い.2010~2017年にかけての我が国のDIC患者325,327症例のDPCデータを元にした研究では,敗血症を基礎疾患するDIC症例の比率は47~49%であり,全ての基礎疾患の中で最も頻度が高かったことが報告された6).またこれらの基礎疾患以外にも,胎盤早期剝離などの産科疾患,外傷や熱中症に代表される全身性組織障害,大動脈解離などの大血管異常,ショックの遷延,毒蛇咬傷などがDIC基礎疾患として知られている.集中治療領域では全ての生体侵襲がDICを引き起こし得ることを念頭に置きつつ病態の鑑別を適切に行う必要がある.
またDICの臨床像は基礎疾患によって大きく異なる.著しい凝固活性化は全てのDICに共通する特徴だが,線溶活性化の程度は基礎疾患によって異なり,このため臨床上の特徴も異なったものとなる.たとえば急性骨髄球性白血病など血液悪性腫瘍を基礎疾患とするDICでは著明な線溶活性化が起こるため,出血症状を主体とした線溶亢進型DICをきたす.一方,敗血症性DICでは線溶抑制因子であるplasminogen activator inhibitor-1(PAI-1)が過剰産生されることによって,線溶活性化が凝固活性化と比較して軽度にとどまる.こうした線溶抑制型DICでは出血症状よりも微小血栓による末梢循環障害が問題となる.さらに基礎疾患である敗血症によって循環障害や血管内皮障害が引き起こされるため,敗血症性DICでは虚血性の多臓器障害が引き起こされ,その転帰に重大な悪影響を与える.
現在国内外で一般的に使用されているDIC診断基準として,改訂版厚生省DIC診断基準,ISTH overt-DIC診断基準,急性期DIC診断基準,日本血栓止血学会DIC診断基準がある.DICは20世紀半ばには病態の概念が提唱されていたが,その診断は長らく病理学的検査によっており,臨床上実用性があるものとは言えなかった.1979年に本邦の旧厚生省DIC診断基準が発表された.この診断基準は臨床症状と止血機能検査を組み合わせたスコアリングシステムによってDIC診断を行うというもので,一般的な臨床施設においても簡便かつ迅速にDICを診断することが可能となった.旧厚生省DIC診断基準は1988年に改訂され,さらにこれを基にして2001年に国際血栓止血学会よりISTH overt-DIC診断基準が発表された7).ISTH overt-DIC診断基準が定められたことで,広く国際的にDICの概念が浸透し,研究が推進されるきっかけとなった.一方,改訂版旧厚生省DIC診断基準,ISTH overt-DIC基準のカットオフ値は高く設定されており,敗血症性DICを発症早期に検出できないことが問題視されていた.こうした問題に対し2005年に日本救急医学会DIC特別委員会は,全身炎症に伴う凝固線溶異常を鋭敏に感知する新しいDIC診断基準として急性期DIC診断基準を提唱した.この診断基準は(i)診断項目にSIRSスコアを含める,(ii)血小板項目に経日的な減少率を含めことで,DICを早期に検出し治療の開始基準となるようデザインされたものである8).
さらに近年ではDIC診断において,アンチトロンビン(antithrombin: AT)活性,thrombin AT complex(TAT),plasmin–plasmin inhibitor complex(PIC),PAI-1,プロテインCなどの凝固止血系の分子マーカーが一般血液検査に比べて有用である可能性が示されている.2017年に日本血栓止血学会は,こうした分子マーカーを組み込むことで詳細に病態を評価することを目指した新たなDIC診断基準を提唱した9).この基準は,第一段階として症例を臨床所見から造血障害型,感染型,基本型の3つの型に分け,第二段階としてAT活性やTATなどの分子マーカーを含めたスコアリングシステムによって診断を行うものである.診断過程や基準の項目が増えることによる煩雑さ,分子マーカーが現時点で多くの施設で測定可能な検査項目ではないことなど,臨床面の課題は多いが,広範囲の基礎疾患に対して高精度にDIC症例を検出する点で期待されている.
敗血症診療におけるDIC診断基準は「予後予測指標」,「抗凝固治療開始の指標」という2つの役割を持っている.これまでDIC診断基準に関する研究の多くは,DIC診断の有用性を評価するにあたって生命転帰に対する予測精度,すなわち「予後予測指標」としての正確性を指標としてきた.しかし臨床的により重要であるのは,治療方針を左右し患者予後に直接影響を与える可能性のある「抗凝固治療開始の指標」としての役割である.
治療開始基準の有用性は,その判定に従って治療介入を行った場合に,最終的な患者転帰が改善するか否かによって評価すべきである.筆者らは本邦の大規模レジストリーデータベース(J-Septic DIC registry)を用いて,敗血症患者に対して急性期DIC診断基準,ISTH overt-DIC診断基準を用いてDIC診断を行うことが,死亡率の改善に影響を与えるか評価した10).本邦の42施設から敗血症2,663症例を対象として,DIC診断を受けた群とDIC診断を受けていない群に分類し,院内死亡率を比較した.結果,急性期DIC診断基準,ISTH overt-DIC診断基準のいずれを用いた場合でも,DIC診断を受けた患者は,受けなかった患者と比較して院内死亡率が低い傾向が示された(ISTH-overt DIC;ハザード比[HR]=0.836,95%信頼区間[CI]=0.711~0.984,JAAM DIC;HR=0.862,95%CI=0.701~1.06).また,この死亡率の改善傾向はDIC診断を初日と来院3日目に経時的に繰り返し行われていた場合に,さらに顕著になることが示された.(ISTH-overt DIC;HR=0.733,95%CI=0.611~0.878,JAAM DIC;HR=0.727,95%CI=0.597~0.884).この結果からDIC診断を行うこと自体が,治療対象とタイミングの最適化を通して,患者の生命転帰の改善に影響すること,さらにDIC診断を繰り返し行うことが患者転帰の改善に影響する可能性が示された.
敗血症を含む生体侵襲の多くがDICを引き起こし得る一方で,慢性肝障害に伴う凝固因子の低下や,薬剤誘発性の血小板減少症,血栓性微小血管障害症(thrombotic microangiopathy: TMA)など類似の血液検査異常をきたしながらもDICとは一線を画す病態が存在する.この中には敗血症性DICとは異なる特異的な治療アルゴリズムが必要な病態も含まれており,そうした疾患の中には抗凝固療法を行っても効果が期待できないばかりか有害事象のリスクが高まる可能性があるものも存在する11).したがって敗血症性DICを疑う症例に対する類似病態の鑑別では単に鑑別疾患を羅列するのではなく,その鑑別の順序をどのように考えるかということが重要である.
わが国の診療指針である日本版敗血症診療ガイドライン(J-SSCG)では最新版のJSSCG2020では,DIC早期鑑別診断を念頭にした鑑別のアルゴリズムが提唱された(図1)12).このアルゴリズムの最大の特徴は,敗血症患者において血小板減少を認めた場合に,最初に凝固線溶異常の有無を評価する点である.凝固障害をきたしている場合は敗血症性DICの治療適応を検討し,逆に凝固線溶異常を認めない場合は溶血性貧血の有無などによってTMAやその他の病態を適切に鑑別する.これは我が国において敗血症性DICが特異的な治療対象であることを念頭に,その頻度と重症度を考慮したうえで提唱された鑑別順序である.また当初は敗血症性DICと診断したものの,その治療に反応性が乏しい場合,あるいは臨床徴候がDICとしては非典型的な場合には,その背景に潜むDIC類似疾患を念頭におき,迅速な鑑別に基づき血漿治療,あるいは分子標的治療などの特異的治療へ速やかに切り替える必要がある.

敗血症性DICの類似病態とその鑑別アルゴリズム(文献12より引用)
前述のように敗血症における凝固線溶障害の発症には,好中球‐血小板‐血管内皮の相互作用,組織因子の過剰産生,生理的凝固経路の抑制,線溶抑制因子の産生亢進など複数の因子が関与しており,病態が進行した場合には血管内皮傷害と微小循環障害によって多臓器障害をきたす13).こうした病態理解を背景として,敗血症に対して抗凝固療法を行うことで転帰の改善につながることが期待され,実際に我が国では過去数十年に渡って臨床現場で使用されてきた.しかし歴史的に諸外国と我が国では敗血症性DIC治療に対する考え方は大きく異なっている.我が国では敗血症における抗凝固療法は抗DIC治療としての行われてきたのに対して,諸外国ではそもそもDICの疾患概念が希薄であり,抗凝固療法は主に深部静脈血栓症の予防や,炎症の制御を目的とした補助治療薬として臨床使用,研究が進められてきた.
こうした考え方の違いは,敗血症の国際的な診療指針であるSurviving Sepsis Campaign(SSC)ガイドラインと,わが国の診療指針であるJ-SSCGの間における推奨内容の相違にも反映されている.SSCガイドラインは2004年に公表された初版以降2回目の改訂版まで約12年間にわたり敗血症性DICの診断,治療に関して全く触れてこなかった.2016年に公表された3回目の改訂版は,初めて敗血症性DICの病態について言及したが,抗凝固療法に関しては行わないことが推奨され,さらに2021年の最新版では再びDICに関する記載はなくなった14, 15).一方,J-SSCGでは2012年の初版以降,一貫して敗血症性DICに対して抗凝固療法の投与が推奨され,最新版であるJ-SSCG2020でもアンチトロンビン製剤,リコンビナント・トロンボモジュリン製剤の2剤に関して,投与を行うことが弱く推奨された16).このような診療指針間での推奨内容の乖離はしばしば我が国の臨床家を困惑させる原因となっている.
敗血症における抗凝固療法に関して,我が国と諸外国の考え方に乖離が生じた理由の一つに,治療対象と考えている病態の相違があげられる.すなわち諸外国では前述のとおりDICという疾患概念が希薄であるため,敗血症症例全般に対して抗凝固療法の有効性を評価するためのランダム化比較試験(randomized controlled trial: RCT)が行われてきた.しかし現時点では敗血症に対して生命転帰の改善を質の高いエビデンスをもって示したRCTはなく,これが諸外国の多くの臨床家が,敗血症に対して抗凝固療法は有効ではないと考える根拠となっている.実際,SSCガイドラインの2016年度版では,敗血症に対してアンチトロンビン製剤の使用を推奨しない根拠の一つとして,アンチトロンビン製剤に関する最大規模のRCT(KyberSept試験)において,アンチトロンビン製剤の投与が敗血症の死亡率の改善に寄与しなかったことを挙げている14, 17).
一方,我が国における抗凝固療法は,敗血症全般に対する治療ではなく敗血症性DICに対する治療として行われてきたため,診療指針の根拠となる研究も敗血症性DICを対象としたものが採用されている.例えば先ほどのKyberSept試験において,敗血症性DICをきたした症例のみを対象としたpost hoc解析では,アンチトロンビン投与が死亡率の改善に寄与したことが報告された18).こうした研究結果からJ-SSCG2020では「抗凝固療法が敗血症の中でも敗血症性DICなどの特定の患者群のみに有効性を発揮するのではないか」,という仮説に基づいて,敗血症性DICに限定したRCTの結果に基づいた推奨を提示したため,SSCガイドラインと異なった推奨が提示されたものと思われる.
では敗血症の中でも,どのような症例に対して抗凝固療法は有効なのであろうか?筆者らは2015年に敗血症を3つの病態,すなわち1)敗血症全般,2)単一の凝固指標異常を伴う敗血症,3)DIC診断基準を満たした敗血症に分類し,それぞれの病態に対する抗凝固薬の有用性を評価したRCTを対象としてメタ解析を行った19).その結果,抗凝固薬の投与は敗血症全般,および単一の凝固指標異常を伴う敗血症では死亡率を改善させず,むしろ出血性合併症の発症率を有意に増加させる可能性が示された.一方,敗血症性DICに対しては死亡率を有意に改善させる可能性が示された(リスク比:0.72,95%信頼区間:0.62~0.85)(図2).筆者らはさらに我が国における最大規模の敗血症レジストリー(J-Septic DIC)に登録された敗血症のデータを用いた多施設共同観察研究を行った20).この研究では敗血症2,663症例を「DIC群」と「非DIC群」に分類し,各群に対する抗凝固療法の生存転帰に対する影響を,傾向スコアによって背景因子を調整して解析した.結果,DIC群では抗凝固療法による有意な生存率の改善を認めたが(調整HR:0.609,95%CI:0.456~0.814),非DIC群では抗凝固療法は生存率の改善には影響していなかった.

抗凝固療法に関するRCTのメタ解析の結果(文献19より引用,一部改変)
これら一連の研究から「敗血症性DIC」を発症していることは,抗凝固療法が有効性を発揮し得る重要な因子の一つであることが示唆されたが,全ての敗血症性DIC患者に対して抗凝固療法が有効ということが示されたわけではない.実際,これまでに敗血症性DIC,またはそれに相当する病態のみを対象として抗凝固療法の有効性を評価した大規模RCTは複数存在するが,いずれも有意な死亡率の改善を示すに至ってはいない21, 22).
それでは敗血症患者に対する抗凝固療法の最適なターゲットは,「DIC」に加えて,どのような条件を満たす必要があるのだろうか?前述のJ-Septic DIC registry databaseを用いた多施設共同観察研究において,抗凝固療法による生存率の改善効果は「重症度の高い」患者群でも認められており(SOFA:13~17の患者群,HR:0.601,95%CI:0.451~0.800),この結果は症例の「重症度が高いこと」もまた抗凝固療法の最適なターゲット選定のために重要な条件であることを示唆している20).2015年に行われた我が国の多施設観察研究では,敗血症性DIC162症例をさらに重症度(APACHE IIスコアによる)毎に患者を階層化して,それぞれの群におけるリコンビナント・トロンボモジュリン製剤の死亡転帰への影響を評価した23).結果としてリコンビナント・トロンボモジュリン製剤投与による生存率の改善効果は,敗血症性DICの中でも重症度が高い群でのみ認められた(APACHE II:24~29の群で調整HR:0.281,95% CI:0.093~0.850).これらの研究の結果は,抗凝固療法の有効性が敗血症性DIC患者の中でも差があり,症例の重症度が高くなるに伴って効果が大きくなる可能性を示している.
以上の知見をまとめると,抗凝固療法の最適なターゲットは,「敗血症」に加えて「DIC」を合併し,さらに「重症度の高い」症例と考えられ,患者選定を十分に行わずに抗凝固療法を行うことは,むしろ出血性合併症を増大させる可能性があると考えられる(図3)24).
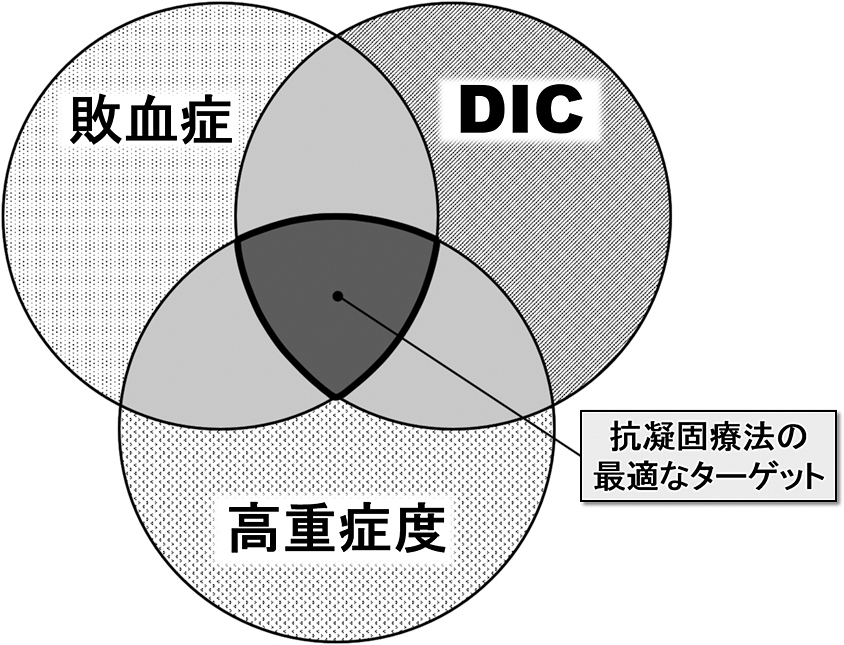
抗凝固療法の最適な対象(文献24より引用,一部改変)
実臨床における実践的な抗凝固療法の使用方法とはどう考えるべきであろうか?前述のように抗凝固療法が有効な症例は重症度の高いDIC症例など一部に限られることが示されてきたが,一方で抗凝固療法を開始するタイミングもその有効性に大きな影響を与えると考えられる.DICが顕在化し,病態が重症化した時期は,既に凝固線溶障害から遠隔臓器障害が進行してしまった状態であり,それを待ってからの治療は遅きに失している可能性が高い.敗血症性DICの本態は血小板が低下した状態ではなく,その前段階である全身性の凝固活性化である.抗凝固療法はこのpre DICと呼ばれる状態において最も有効性が高く,その開始が遅れることによって有効性が減弱する可能性がある.例えば2018年に結果が公表されたSCARLET試験は敗血症性DICに相当する病態を対象としていたが生存率の改善を示されなかった25).その原因として患者割り付けから薬剤投与までに最大40時間を要したことが挙げられており,この間に病態が抗凝固療法によって代償困難な状態まで進行してしまっていた可能性があると指摘されている.
これらの研究結果より抗凝固療法の有効性を最大限発揮させるために,理想的には「重症度の高い敗血症性DIC症例」に対して,「DICが顕在化し重症化する前に抗凝固療法を開始」することが求められる(図4).実際に敗血症診断時にはDICをきたしていない症例の中でも15~20%が経過中にDICを発症することが報告されており,敗血症に伴う凝固線溶障害の病勢は経時的に大きく変化するものと考えられる10).しかし重症化やDICの顕在化を,早期に適切に予測して治療を開始するための手段は現時点では確立されていない.したがって現時点での実臨床上の対応としては若干の過剰診断を許容し治療対象を広く捉える戦略も許容されるべきである.将来的に「DICが顕在化する」症例に対して「DICが顕在化する前に」予測する手段が確立されれば,より早期により適切な治療対象を選定し,全ての治療対象で抗凝固療法の有効性を十分に発揮させることが可能となる.そのためには病態進行の根底にあるメカニズムを解明するための基礎研究と,大規模臨床データから病態の変化を予測するための臨床研究を組み合わせて信頼性の高い病態予測戦略の確立を目指していく必要がある.

敗血症性DICに対する従来の治療戦略と理想的な治療戦略
本論文発表内容に関連して開示すべき企業等との利益相反なし