2019 年 40 巻 2 号 p. 159-166
2019 年 40 巻 2 号 p. 159-166
下肢静脈瘤に対する血管内レーザー焼灼術(endovenous laser ablation: EVLA)における焼灼メカニズムは,ファイバー先端の高温の炭化した血液による焼灼とレーザーが光ファイバーから静脈壁へ直接照射されることによる焼灼であり,実臨床では両者のメカニズムが混在している.現在,波長1,470 nmレーザーと全周照射型ファイバーが主流となり,最近の動向は全周照射型ファイバーの細径化と新しいファイバー牽引装置の開発である.
In endovenous laser ablation, the vein is ablated by exceedingly hot layer of carbonized blood on the fiber tip and direct application of laser energy through the fiber. Both mechanisms coexist in actual clinical ablation. Combination of 1,470 nm laser and radial emitted fiber came into wide use recently. Recent developments are radial emitted slim fibers and a new pull-back device.
血管内レーザー焼灼術(endovenous laser ablation: EVLA)は2011年にわが国で保険収載されて以来,症例数は年々増加し,現在は下肢静脈瘤の標準治療となっている(Fig.1).しかし,初期のEVLAでは,焼灼部の疼痛,皮下出血や焼灼静脈の再疎通に悩まされることが多かった.これらの問題を解決するために静脈焼灼のメカニズムが解明され,新しいレーザー治療機器の開発が進んできた.本稿ではEVLAにおける静脈焼灼メカニズムとレーザー治療機器の最近の動向について解説する.
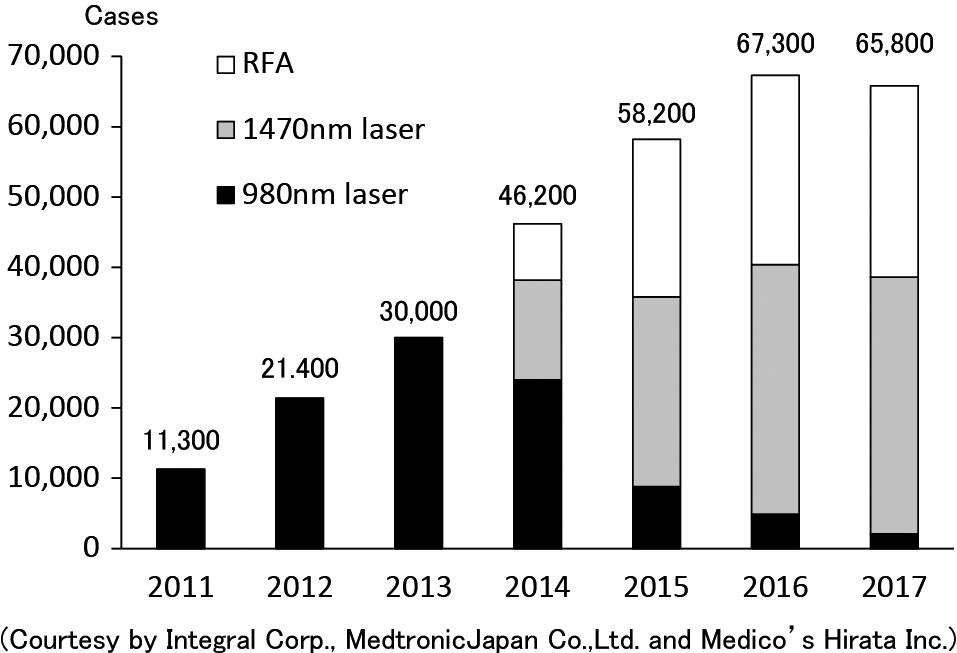
Change of number of endovenous ablation cases in Japan
After coverage of national health insurance in 2011, a number of endovenous ablation cases has increased rapidly during this seven years.
RFA: radiofreqency ablation
下肢静脈瘤に対するEVLAでは,他領域のレーザー治療と異なり血液が存在する静脈内でレーザーを照射するため,静脈内の血液の多寡やファイバー先端が静脈壁に接触しているかどうか,などの条件によって焼灼メカニズムが大きく変わってくる.
2.1 Steam bubble theoryEVLAにおける焼灼メカニズムとして最初に提唱されたのが,Proebstleら1)の“steam bubble theory”である.Steam bubble theoryは,レーザー照射によって血液が沸騰して発生した蒸気の泡(steam bubble)によって静脈内皮が広範囲に損傷して血栓性閉塞を起こすというもので,当時のEVLA後の閉塞状況と一致していたため広く受け入れられた.蒸気の泡は静脈壁に熱エネルギーを移動しながらファイバー先端から20 mm以上の長さを100°Cの温度を保ちながら拡がっていく(heat pipe theory)2).実際にEVLA中にはファイバー先端から高エコー輝度の蒸気の泡が深部静脈に流れていくのが観察される(Fig.2).しかし,現在のEVLAはレーザーの照射条件が当時と大きく異なり,TLA麻酔によって十分に静脈内の血液を排除した状態で連続照射によって大きなエネルギーを加えている.従って,後述するように1,000°C以上に達するファイバー先端による焼灼の影響が大きく,現在ではsteam bubble theoryが静脈焼灼に果たす役割は少ないと考えられている.

Ultrasound image of steam bubble during laser ablation
Steam bubbles are visible distal from the 2ring fiber tip at the saphenofemoral junction during endovenous laser ablation.
現在考えられているEVLAの焼灼メカニズムは,血液が介在するdirect contact theoryと血液を介さずに光ファイバーから直接静脈壁へレーザーが作用するメカニズムの2つである3)(Fig.3).これらのメカニズムがレーザーの波長,発振方法,出力,照射時間,光ファイバーの種類,治療静脈の状態(径,壁の厚さ,TLA麻酔による圧迫等)などの様々な条件によって種々の割合で作用して焼灼が起こる.
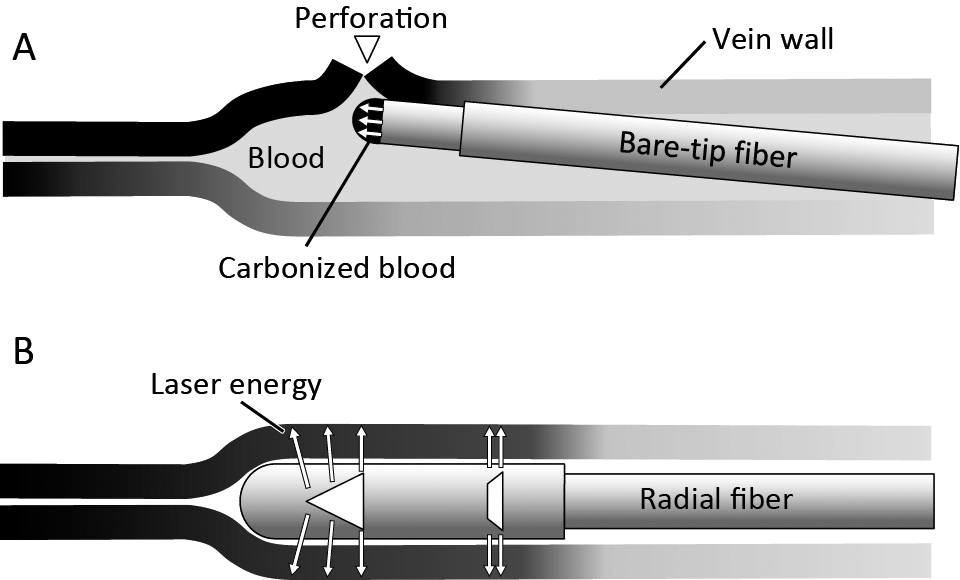
Mechanism of action of endovenous laser ablation
A. When a bare-tip fiber is used for EVLA, exceedingly hot layer of carbonized blood on the fiber tip cause destruction and perforation of the vein. B. Radial emitted fiber emits the laser light from the side and directly applies laser energy to the vein wall.
Direct contact theoryは光ファイバー先端の高熱の炭化物質(carbon cap)が静脈壁に直接接触して静脈を焼灼・閉鎖するメカニズムである4).レーザーを吸収した血液は70~80°Cで凝血塊となり,100°Cで血液が沸騰して蒸気が発生,300°Cで血液が炭素とガスに分離して光ファイバー先端に炭化物質が形成され,最終的に温度は1,000~2,000°Cに達する.実際にEVLA後の光ファイバーの先端には薄い炭化血液の層と高温によるファイバー先端の損傷が認められる5).Direct contact theoryは焼灼に血液が必要であり,一度焼灼が始まると制御が難しく,不十分な焼灼や静脈壁の穿孔の原因となる6,7).初期のEVLAでは静脈内の血液を十分に排除しないで焼灼を行っていたが,現在では適切なTLA麻酔によって静脈は虚脱し,静脈内の血液は十分に排除された状態で焼灼が行われるようになっている(Fig.4).そのため,光ファイバー先端と静脈壁は直接接触した状態でレーザーが照射され,レーザーは血液を介さずに静脈壁に直接作用している.直接照射による焼灼の場合はレーザーの波長による吸収特性の違いが重要となる.

Ultrasound image of the vein after injection of tumescent local anesthesia
The vein is collapsed and in close contact with the optical fiber by the tumescent fluid and Trendelenburg position. A. transvers image, B. longitudinal image.
EVLAで使用される波長700~2,500 nmの近赤外レーザーは吸収特性によって主に水に吸収される水特異性波長(water-specific laser wavelength: WSLW)と,ヘモグロビンに吸収されるヘモグロビン特異性波長(hemoglobin-specific laser wavelength: HSLW)に分類される8).皮膚科,形成外科領域では血管病変に対するレーザー治療にHSLWのレーザーが使用されていたため,初期のEVLAでもHSLWである波長810 nmレーザーが使用されていた.その後,血管壁のコラーゲンに含まれる水分に直接作用して強い血管収縮を起こすWSLWレーザーが注目される様になった9).
水によるレーザーの吸収は波長1,000 nm以下では極めて少ないが,波長1,000 nm以上では強く吸収され,近赤外域では波長1,454 nmと1,940 nmに吸収のピークがある10)(Fig.5).ヘモグロビンによるレーザーの吸収は波長1,000 nmに小さなピークがあるが,波長1,200~1,740 nm,特に波長1,200~1,350 nmでは極めて少ない11).しかし,生体内ではヘモグロビンは水を含む赤血球内に存在するため,血液による吸収は波長1,200 nm以上では水の吸収曲線とほぼ同じ特性を示す12).WSLWレーザーは水と吸収特性は同じでも吸収量は同じではなく,波長1,170~1,350 nmでは血液は水の約2倍,波長1,350~2,500 nmでは水の120~130%レーザーが吸収される.生体内ではWSLWレーザーはHSLWレーザーと異なり血液と水の両方に吸収され,血液が存在しなくても組織に含まれる水に吸収されて静脈が焼灼される.

The absorption spectrum of oxygenated and deoxygenated diluted blood in the wavelength range 400–2,500 nm.
Above 1,200 nm the absorption spectra of oxygenated and deoxygenated blood were followed the water absorption. Water has prominent absorption bands at 1,454 nm and at 1,940 nm in the near infrared region.
WSLWレーザーは少ないエネルギーで組織を焼灼できるが,波長が長くなると組織に対する光消失係数は高くなり光侵達度は浅くなる.波長1,470 nmレーザーは,波長980 nmレーザーと較べ光吸収係数(μa)は血液で約11倍(3.0 vs. 0.28 mm−1),静脈壁で24倍(2.4 vs. 0.1 mm−1)と,水を含む組織でより強く吸収される3)(Table 1).ヒト大伏在静脈組織において波長980 nmおよび1,470 nmレーザーの光侵達度はそれぞれ1.26 mm,0.22 mmであり,波長1,470 nmレーザーは波長980 nmレーザーに比べより小さい平均エネルギー密度で組織の収縮を誘起できる13).この特性は,血液が存在しない場合は穿孔を起こさずに強い組織収縮を起こすためEVLAでは有利に働く.しかし,血液が存在するとエネルギーのほとんどが血液に吸収され血液の炭化から過剰な焼灼を起こす恐れがある.実際にbare-tip fiber(以下ベアファイバー)を用いたWSLWレーザーによるEVLAでは従来のHSLWレーザーと比べて術後の皮下出血や疼痛の発生率に差は認められなかった14).つまり,EVLAにWSLWレーザーを使用する場合は,できるだけ血液を介さずにレーザーエネルギーを静脈壁に届けなければいけない.その為に,臨床的にはTLA麻酔,頭低位による血液排除が十分に行われるようになり,さらに光ファイバーの改良が行われている.特殊なアプローチとしてパルス幅がマイクロ秒単位の短パルス発振レーザーを使用してキャビテーションによる血液排除が試みられているが,未だ普及には至っていない15).
| Biological tissues | 810 nm | 940 nm | 980 nm | 1,320 nm | 1,470 nm | |
|---|---|---|---|---|---|---|
| Blood | μa (mm−1) | 0.16 | 0.25 | 0.28 | 0.38 | 3.0 |
| μ's (mm−1) | 0.73 | 0.64 | 0.6 | 0.54 | 0.52 | |
| μeff (mm−1) | 0.65 | 0.82 | 0.86 | 1.02 | 5.63 | |
| Vessel wall | μa (mm−1) | 0.2 | 0.12 | 0.1 | 0.3 | 2.4 |
| μ's (mm−1) | 2.4 | 2.13 | 2.0 | 1.8 | 1.7 | |
| μeff (mm−1) | 1.25 | 0.9 | 0.79 | 1.37 | 5.43 | |
| Perivenous tissue | μa (mm−1) | 0.017 | 0.027 | 0.030 | 0.045 | 0.35 |
| μ's (mm−1) | 1.2 | 1.1 | 1.0 | 0.9 | 0.84 | |
| μeff (mm−1) | 0.25 | 0.3 | 0.3 | 0.36 | 1.12 |
μa: absorption coefficient in tissue, μ's: reduced scattering coefficient, μeff: optical extinction (Vuylsteke ME, Ann Vasc Surg. 2012; 26:424-433.)
従来EVLAで使用されてきた光ファイバーは先端を平らにカットしたベアファイバーである.ベアファイバーはレーザーの照射面積が小さく,先端に高いエネルギーが集中して炭化物質を形成しやすい.高温のファイバー先端が静脈壁に接触するのを防ぐために先端を金でカバーしたNeverTouch®ファイバー(AngioDynamics® Inc., USA)や先端にチューリップ状に開くbladeを持つTulip-tip fiber(Tobrix, Nederlands)などが開発されているが普及はしていない.逆に照射面を静脈壁に接触させるために2008年に開発されたのが,全周照射型ファイバーであるELVeS Radial fiberTM(Biolitec AG, Germany)である.全周照射型ファイバーは先端に内包するプリズムによってファイバーの軸から70度に偏光されたレーザー光が360度全周性に照射される16).照射面が静脈壁と密着して血液を排除し,照射面積が広くエネルギーが集中しないため,過焼灼による炭化物質が形成されず静脈穿孔が起こりにくい.榊原は全周照射型ファイバーでも凝血塊が形成されると報告しているが,これは血液内にファイバーを浸した状態での照射で実臨床とは大きくかけ離れている17).実際のEVLAではTLA麻酔によって血液はほとんど存在せず,全周照射型ファイバーの照射面は滑らかであるため,ファイバーを牽引する際に凝血塊は静脈壁との摩擦で剥げ落ちてしまう.実際にEVLA直後の全周照射型ファイバーの表面に炭化物質の付着はなく,照射光も均一に保たれている(Fig.6).WSLWレーザーである波長1,470 nmレーザーと全周照射型ファイバーの組み合わせによって術後の皮下出血,疼痛は激減した14).ELVeS Radial fiberTMの改良型である ELVeS Radial 2ringTM fiber(Biolitec AG, Germany,以下radial 2ring fiber)は2個のプリズムを持ち,より低いエネルギー密度で静脈壁を2回焼灼できるため,血管壁とファイバーの接着であるstickingを減らして確実な焼灼を行う事ができる(Fig.4).山本ら18)はradial 2ring fiberは波長1,470 nmレーザーと組み合わせると,波長980 nmレーザーと比べて静脈内皮の炭化が少なく,静脈収縮率が有意に大きかったと報告している.日本で行われたradial 2ring fiberと波長1,470 nmレーザーのベアファイバーと波長980 nmレーザーを対照群としたランダム化比較試験では,疼痛・皮下出血発生率および疼痛のvisual analogue scale最高値は被験群で有意に低値であった19).この臨床試験の結果を元に,2014年にradial 2ring fiberと波長1,470 nmレーザーはわが国で医療機器として認可され,保険適用となっている.

The tip of radial emitting fiber after ablation of the great saphenous vein
There are no carbonation at the tip of fiber and the fiber maintains the light emitting pattern even after a 40 cm ablation of the GSV with 6,092 J of energy using 1,470 nm laser at 10 w of power.
下肢静脈瘤に対するEVLAはイタリアのPuglisiらが1989年にND:YAGレーザーによるEVLAを初めて報告しているが,照射条件は10~20 Wで6~12秒間照射し,それを2~5 cmごとに繰り返すものであった20).その後,2001年にNavarroら21)が波長810 nm半導体レーザーによる現在のスタイルのEVLAを報告しているが,焼灼条件は10~14 Wの出力で1~2秒間照射し,3~5 mmずつファイバーを牽引するというものであり,局所的に静脈内皮~外膜を焼灼する事を目的としていた.しかし,この焼灼条件では静脈壁の焼灼が不充分なため静脈は血栓性閉塞を起こす.血栓性閉塞はEVLA術後の血栓性静脈炎による疼痛,それに引き続く血栓溶解による再疎通の原因となり,事実,初期のEVLAではこれらの合併症が高頻度に認められた22).そのため焼灼条件が見直され,現在ではレーザーを連続照射しながらファイバーを連続的に牽引するのが主流となっている.その際,静脈壁を十分に焼灼し血栓性閉塞を防ぐために適切なエネルギーによる照射が必要となる.皮膚科領域のレーザー治療ではレーザー光を垂直に照射するため,レーザー出力,照射面積と時間から適切なエネルギー量としてfluence(J/cm2)が計算できる.EVLAでは照射面積を正確に算定するのは困難なため,単位長さ当たりのエネルギー量である linear endovenous energy density(LEED)を用いるのが一般的であり,静脈の再疎通による再発を防ぐために60~80 J/cm以上のLEEDが推奨されている23-25).静脈の直径から内腔面積を計算した疑似的なfluenceであるendovenous fluence equivalent(EFE)で20 J/cm2以上のEFE(LEED 40~60 J/cm相当)が必要であるとする報告もある26,27).照射エネルギー(J)はレーザー出力と照射時間の積で決まるが,出力を高くすると静脈閉塞率は高くなるが静脈穿孔が多くなるため28,29),通常は8~15 Wの出力が用いられる.実際のEVLAでは静脈径が部位によって異なるため,Maurinは10~15 cmおきに静脈径を計測し,静脈径の7~10倍のLEEDを与えるようにファイバーを牽引することを推奨している30).
レーザー機器そのものにはあまり大きな変化はなく,現在は波長1,470 nmの半導体レーザーが主流である.EVLA用の波長1,470 nmレーザーは2006年にドイツのbiolitec社によって初めて開発され,全周照射型ファイバーと組み合わせで世界的に広く普及している.日本では2014年にドイツbiolitec社のCeralas E 1470 nm Diode laserと2016年にフランスLSO Medical社のEndothermeTM 1470の2機種が製造販売承認を取得し保険認可されている(Fig.7).

1,470 nm diode laser and radial emitted fibers covered by national health insurance in Japan
A. Ceralas E 1470 nm Diode laser and ELVeS Radial 2ringTM fiber (Biolitec AG, Germany).
B. Endotherme TM 1470 and RinglightTM radial fiber (LSO Medical, France).
波長1,470 nmより長波長のレーザーは水への吸収がより高く効率的な焼灼が期待される.近赤外域では水への吸収のピークは波長1,454 nmと1,940 nmにあり,我々は波長2000 nm DPSSレーザー(Revolix Jr.®, LISA Laser Products GmbH, Germany)とベアファイバーでEVLAを施行したが,その治療成績は満足のいくものではなかった31).波長2,000 nm付近では水への吸収が強く光侵達度が浅いため,ベアファイバーではエネルギーのほとんどは血液に吸収され高温の炭化物質になってしまうためと考えられた.Mendes-Pintoらは全周照射型ファイバーを用いて波長1,920 nmと1,470 nm半導体レーザーによるランダム化比較試験を行っている32).その結果,術後の皮下出血,硬結および鎮痛剤の使用日数は波長1,920 nmレーザーで有意に少なかったが,1年後の焼灼静脈閉塞率は波長1,470 nmレーザーで有意に良好であったと報告している.この報告ではレーザー出力は波長1,920 nmレーザーで5 W,波長1,470 nmレーザーで10 W,LEEDも波長1,920 nmレーザーで有意に低く,この結果は波長の違いというよりも照射エネルギーの違いと考えられ,いずれにせよ波長1,470 nmよりもより長波長のレーザーを使用する明らかな利点は認められなかった.少なくとも連続波発振であれば,波長2,000 nmレーザーよりも安価で長寿命の波長1,470 nm半導体レーザーの方が現実的に有用である.
3.2 ファイバーEVLAに使用される光ファイバーは2008年にドイツのCeramOptec社が開発した全周照射型ファイバー(ELVeS Radial fiberTM)がベアファイバーに比べ圧倒的に臨床成績が優れており14,33),現在は各社から全周照射型ファイバーが販売されている.しかし,全周照射型ファイバーの径は1.80~1.85 mmとベアファイバー(1.1 mm)に較べて太いため,静脈内挿入には5~6 Frのイントロデューサーシースが必要である.そのため,術後の再発症例や不全穿通枝に対するEVLAではシースを挿入することが困難な場合があり,細径の全周照射型ファイバーが開発された.わが国では2018年にbiolitec社のELVeS® Radial® 2ring slim fiberとLSO medical社のRinglightTM slim fiberが認可されている(Fig.8).いずれも各社の全周照射型ファイバーを細径化したもので,ELVeS® Radial® 2ring slim fiberは外径1.27 mm,RinglightTM slim fiberは外径1.0 mm,それぞれ16Gと17Gの静脈留置針から挿入可能である.

Radial emitted slim fibers for endovenous laser ablation
From left, a regular radial emitted fiber, ELVeS® Radial® 2ring slim fiber (Biolitec AG, Germany) and RinglightTM slim fiber (LSO Medical, France) with a 1.85 mm, 1.27 mm and 1.0 mm of outer diameter.
細径ファイバーは穿刺部からの出血のリスクが少なくなり,整容的にも良好な結果が期待できる.しかし,細径化による最大の利点はEVLAの適応範囲の拡大である.通常の全周照射型ファイバーが挿入困難であった不全穿通枝,小伏在静脈,副伏在静脈や術後再発など解剖が複雑で複数の穿刺が必要な症例に細径ファイバーが最も適している(Fig.9).細径ファイバーを使用する際に注意しなければいけないのは,細径化によってレーザーの照射面積が小さいため従来のレーザー出力(10 W)ではエネルギー密度が高くなり炭化物質が形成されやすい.そのためレーザー出力を低め(6~7 W)に設定する必要がある.

Endovenous laser ablation for branch varicose veins using radial emitted slim fiber
A radial emitted slim fiber can pass the 16G or 17G needle instead of introducer sheath. This fiber is easy to puncture multiple veins, even in complicated varicose veins.
EVLAでは適切なエネルギーを静脈に照射するために,ファイバーを一定の速度で牽引する.適切なLEEDは60~80 J/cmと言われており,出力10 Wで1.25~1.66 mm/秒の速度で牽引する必要がある.一般的には光ファイバーの一定の間隔の印や,レーザー装置本体のメトロノーム機能で牽引速度を調節している.しかし,用手的に牽引している限り適切な速度で一定に光ファイバーを牽引するのは困難であり,以前から様々なファイバー牽引装置が開発されてきた.今までの牽引装置の基本的構造は内蔵するローラーによって体外からファイバーを牽引するものであり,牽引装置を穿刺部位と直線位置に置き,常にファイバーに張力をかける必要があった.そのためファイバーの装着が難しく,牽引装置の位置に制限があった.新しい牽引装置であるSnakeBack®(LSO medical, France)は,光ファイバーが柔軟性のあるシースで覆われカセット内に収められている(Fig.10).牽引機能の内蔵されたレーザー装置にカセットを装着するだけで牽引を開始する事ができ,光ファイバーはシースの中を滑るので光ファイバーの体外部分を真っ直ぐにして張力をかける必要がない.レーザー装置の位置に制限がないため,ファイバーが誤って引き抜かれる事がなく安全にEVLAを施行することができる.

Remote optical fiber pull-back device
A. The conventional pull-back devices need a leg-fiber-device alignment and fiber tension, so these devices have a restriction of an installation place.
B. SnakeBack® system (LSO Medical, France) has a long fitted sheath which can slide the optical fiber inside it. A sheath is flexible, so this system doesn’t need for catheter tension and device alignment with the leg to be treated.
欧米ではTLA麻酔を用いず焼灼をしないで静脈を閉鎖するnon thermal, non tumescent(NTNT)治療が開発されており,今後,下肢静脈瘤の治療法はNTNT治療へ大きくシフトしていくと考えられている.しかし,波長1,470 nmレーザーと全周照射型ファイバーによるEVLAは,疼痛,皮下出血は少なく,治療成績は安定している.さらに細径ファイバーの登場により,複雑な症例や穿通枝などEVLAの適応範囲は拡がっており,当分の間はEVLAを含む血管内焼灼術が下肢静脈瘤の治療の基本である.
利益相反あり.インテグラル株式会社:顧問料,日本コヴィディエン株式会社:講演料