Abstract
正確かつ安全に悪性神経膠腫を最大限に摘出することは容易ではなく,(5-aminolevulinic acid: 5-ALA)を用いた光線力学的診断(Photodynamic diagnosis: PDD)を始め多くのモダリティが応用される.5-ALAは腫瘍内に選択的に集積し,その代謝産物である(Protoporphyrin IX: PpIX)の蛍光によって,腫瘍の存在を非常に簡便かつリアルタイムに示すことができ,本手術の遂行に有用である.最近ではPpIXの集積メカニズムの解明も進み,その集積効率を高めることで,PDDのみならず光線力学的療法(Photodynamic therapy: PDT)の効果増強に関する研究も期待されている.一方,本方法論には低悪性度神経膠腫での有用性が低い点,偽陽性や偽陰性の問題などがあり,その遂行には十分な知識と経験を要する.これら諸問題の克服のため,スペクトル解析を用いたPpIX蛍光の定量化技術の開発が進んでいる.また最近,本邦において悪性脳腫瘍のPDT治療剤として承認されているtalaporfin sodiumが,PDDにも応用可能であることが示され,今後は本薬剤を用いたPDDとPDTの併用が実現することが期待される.
Translated Abstract
Maximum and safe removal of malignant gliomas is no easy, and various modalities are used, including photodynamic diagnosis (PDD) using 5-aminolevulinic acid (5-ALA). Fluorescence guided surgery (Fluorescence Guided Surgery: FGS) using 5-ALA is highly useful for malignant gliomas, because it selectively accumulates in the tumor cells and the presence of the tumor cells can be demonstrated in a very simple and real-time manner by the assessment of emitting fluorescence of its metabolite Protoporphyrin IX (PpIX). Recently, the mechanism of PpIX accumulation has been elucidated, and in the future, research to increase the effects of PDD and PDT by increasing the efficiency of accumulation is expected. On the other hand, 5-ALA PDD is not useful in lower-grade gliomas due to problems including false positives and false negatives, and its use requires sufficient knowledge and experience. In order to overcome these problems, PpIX fluorescence quantification using spectral analysis have been developed, and further development of these techniques is expected. Recently, it was shown that PDD is possible using talaporfin sodium, which has been approved as a photodynamic therapy (PDT) treatment in Japan, and more effective surgical treatment will be developed by combining PDD and PDT using talaporfin sodium in the future.
1. 背景
1.1 悪性神経膠腫の治療戦略
原発性悪性脳腫瘍の中で特に神経膠腫は,周囲脳に浸潤しながら発育するため,手術による腫瘍の完全摘出は不可能であるものの,近年手術での摘出率と予後が相関する報告が多く1-3),神経膠腫の治療において手術で可能な限り腫瘍を摘出することが重要と考えられている.特に(World Health Organization: WHO)グレード4である膠芽腫では,高い摘出率が予後を改善するという報告が多数なされ4-7),現在では腫瘍の最大限摘出は標準的治療となっている6).しかしながら,腫瘍と正常脳との境界領域には重要な機能領野が存在することが多く,また腫瘍と周囲脳の境界は肉眼的には不明瞭な場合が多いため,腫瘍の最大限摘出と機能温存を両立することは容易ではない.したがって,神経膠腫の手術では様々な治療モダリティが用いられる.代表的なものは,神経生理モニタリング,ナビゲーションや,術中MRI8),術中迅速病理診断,および光線力学的診断(Photodynamic diagnosis: PDD)などであり,これらのモダリティを駆使して腫瘍の「安全な最大限の摘出」をめざす.術中MRIは,手術中にMRIを撮影して残存腫瘍を正確に評価できるため,非常に有用であるが,高額かつ設置されている医療機関は限られている.また,撮影には30分から1時間程度の時間を要する.術中迅速病理診断は,病理診断医の常駐と協力が必要で,結果を得るために少なくとも30分程度の時間がかかる.またその評価は主観的であり客観的な残存腫瘍の評価はしばしば困難である.その点,PDDはリアルタイムかつ簡便に残存腫瘍の有無を評価できるため,非常に有用である.したがって,悪性神経膠腫を安全に最大限摘出するには,神経生理モニタリング,PDDや術中MRI及びその組み合わせが有用であると言える9).一方,PDDによる評価は主観的であり,偽陽性や偽陰性の問題もあるため,PDDのみに頼った手術を行う場合はそのメリットとリスクを十分に理解する必要がある.
2. 5-ALAを用いたPDD
2.1 5-ALAの細胞内集積の分子機構
PDDは,光感受性物質(Photosensitizer: PS)を標的細胞に選択的に集積させ,特定の波長の光を当てることで励起した蛍光を観察することで標的細胞と正常細胞を見分ける方法である.現在主に使用されている薬物は5-aminolevulinic acid(5-ALA)である.Hematoporphyrin誘導体である5-ALAは,体内に元々存在する内因性物質でミトコンドリアで生成される.したがって安全に投与可能で自身は蛍光を発しない.5-ALAはヘムの原料であり,ミトコンドリア内でのヘム合成過程でProtoporphyrin IX(PpIX)になる.PpIXに鉄が結合してヘムになるが,腫瘍細胞内では酸化的リン酸化の効率が悪いために,またその他様々な理由で効果的にヘムが合成されず,ヘム前駆体であるPpIXが蓄積する.PpIXは青色励起光によって635 nmの赤色光を発することで,腫瘍選択的な蛍光を得ることができる.
PpIXが効率よく腫瘍細胞内に蓄積されるメカニズムについては様々な研究が行われており,まだ完全に解明されていないが,①5-ALAの細胞内取り込み,②ヘム合成経路,③PpIX代謝,④PpIX排出などが関わっている事が知られている10).5-ALAは通常血液脳関門(Blood brain barrier: BBB)を通過しないが,BBBが破綻した腫瘍血管からは細胞内に流入する11).また,腫瘍細胞選択的な細胞膜からの5-ALA流入に,(Peptide transporter 1: PEPT1),(Peptide transporter 2: PEPT2)や(ATP-binding cassette super-family G member 2: ABCG2)などの分子が関わっているという12,13).また,(Delta-aminolevulinic acid dehydratase: ALAD)や(Porphobilinogen deaminase: PBGD)といったヘム合成経路の活性化や14,15),鉄付加酵素であるferrochelataseの不活性化16,17),ミトコンドリアからの排出,細胞膜から細胞外への排出経路の不活性化もPpIX集積に関わっている18-20).しかしながらこれらの研究はいずれもin vitroの知見であり,実臨床での腫瘍細胞におけるPpIX集積のメカニズムは未知な部分が多い.
その中で,PpIX排出に関して,最近いくつかの重要な発見がなされた.PpIXの細胞膜からの排出は,従来ABCG2や(ATP-binding cassette super-family B member 6: ABCB6)といったABCトランスポーターを介して行われていると考えられ18-20),その阻害剤でPpIX蓄積を高める試みが行われてきた.Palasuberniamらは,PpIXの細胞外排出に関わるABCG2阻害剤を用いることで,5-ALAを投与した細胞内の蛍光強度が増加することを報告した21).
最近,Kitajimaらは,PpIXの細胞外排出に細胞のエンドサイトーシスおよびエキソサイトーシスに関わるダイナミンが関わっていることを示した22.ダイナミン2の阻害剤でPpIXの細胞内蓄積が著明に上昇したことから,ダイナミン2阻害剤が,5-ALAを用いたPDDの効率を高める可能性が示された22).したがってPpIX排出機構にはABCトランスポーターに加え,エキソサイトーシスが関わっている事が示唆される.これらの知見は神経膠腫においては証明されてはいないが,これらの阻害剤でPpIX細胞内集積を高めることで5-ALA PDDや光線力学的療法(Photodynamic therapy: PDT)の効率を高める研究が今後も期待される.
2.2 5-ALAを用いたPDDによるFluorescence Guided Surgery(FGS)
2000年にStummerらが膠芽腫摘出術における5-ALAの有用性を報告し23),続いて2006年には悪性神経膠腫(88%が膠芽腫)手術における5-ALA使用の有無でのランダム化研究を報告,5ALA使用で全摘出率が向上し(65% vs 36%),(progression free survival: PFS)が延長する(6ヶ月PFS;41ヶ月vs 21.1ヶ月)ことを示し24),European Medical Agency(European Medical Agency: EMA)により2007年に悪性神経膠腫手術における5-ALA使用が認可された.ただ,本試験では,腫瘍全摘出群と非全摘出群を比較すると(overall survival: OS)の差は見られたものの,5-ALA群と非使用群でOSには有意差を認めなかった25,26).その理由として,5-ALA群における全摘出群が65%とあまり高くなかった事,現在の標準治療であるStuppレジメンが多くの患者で行われていなかった事などが考えられる.当時に比べて現在の手術技術はさらに向上しているため,5-ALAを用いた造影病変の全摘出率は現在ではより高くなっていると思われ,膠芽腫手術における5-ALAを用いたPDDの有用性は確立されたものと考えられる.実際,その後,5-ALAを用いたFGSにおいて,蛍光と腫瘍組織の相関に関して多くの報告があり,いずれも高い感度,特異度および陽性適中率を得ている9,27-29).悪性神経膠腫手術における術中診断薬として,5-ALAは国内では2013年に神経膠腫手術における術中診断薬として保険収載され,また米国FDAでも2017年に承認された30).国内における他の腫瘍では経尿道的膀胱腫瘍切除における術中PDD薬剤として2017年11月に保険収載されている.今後,これらの癌腫以外でも5-ALAを用いた手術が広まっていくと予想される.
3. 5-ALAを用いたPDDの問題点と対策
5-ALAを用いたPDDは膠芽腫を中心とした悪性神経膠腫手術において高い摘出率を達成するのに有用であるが,以下の様な問題点が存在する.
3.1 蛍光を肉眼で確認する主観的な判定になること
現在のところ,PpIX蛍光強度を客観的に数値化する技術が臨床応用されておらず,蛍光強度の判定は,一般的に腫瘍本体における強い蛍光,境界部や浸潤部における淡い蛍光,および周囲の正常脳組織における無蛍光,の3段階で,術者がその蛍光強度を肉眼で観察して評価している23).したがって,明らかに赤いとか,淡く光っているといった評価で腫瘍かどうかを評価しているのであり,主観的と言わざるを得ない.特に非常に淡い蛍光を示した病変をどのように評価するのか,そこを摘出するか残すかの判断は非常に難しい.Kisselらは,77例の初発膠芽腫患者で5-ALAを用いたFGSにおいてサンプルの蛍光強度と腫瘍細胞の相関を検討,蛍光が観察されなかったサンプルの49%に浸潤腫瘍細胞を認めたと報告した31).その他,顕微鏡と病変の距離によって蛍光強度が変化する事や,フォトブリーチングなどの影響も問題であろう32).もちろん術中PDDの経験を積むことで,術後(あるいは術中)MRIでの残存腫瘍と肉眼での蛍光強度を関連づけたり,判断に迷った組織の病理所見との関連性を検討することで,次第により正確なPDDを行えるようになるものと思われるが,やはり蛍光強度の数値化などのより客観的指標がある方が望ましいと思われる.これらの問題を克服すべく,PPIX蛍光強度の客観的評価・定量化を目指して,様々な手法が開発されてきている33).主なものはスペクトル解析を用いた定量化で,腫瘍組織におけるPPIX蛍光強度を数値化することで,手術用顕微鏡での肉眼的蛍光評価と比較してより高い感度,特異度が得られる事が示されている34-36).Corneliusらは,術中にハンディタイプの分光器を用いてPPIX蛍光を定量するシステムを開発し,実臨床で有用であることを報告した37).今後これらのシステムが標準化され実臨床に導入されることを期待したい.
3.2 低悪性度神経膠腫におけるPDDの信頼度
悪性度が高い膠芽腫に関しては,腫瘍組織における蛍光強度は明瞭であることが多いが,WHOグレード2や3の腫瘍においては蛍光強度が弱い症例も多く,PDDはより困難である.Widhalmらは,5-ALA PDDを行なった33例のグレード2神経膠腫の中で,蛍光を認めたのはわずか4例(9%)だったと報告した38).Jaberらの報告では,82例のグレード2神経膠腫で,蛍光を認めたのは13例(16%),グレード3では76例中59例(77.6%)であった39).最も割合が高かったGoryaynovらの報告では,5-ALA PDDを行った27例の低悪性度神経膠腫のうち,蛍光を認めたのは14例(52%)であった40).低悪性度神経膠腫でも蛍光が得られれば,摘出の指標として有用であるが,多くの症例で蛍光が得られない可能性があることを留意すべきである.一方,腫瘍全体に蛍光がないものの,悪性化したと考えられる部分がスポットとして蛍光を示す場合があり41,42),悪性化した病変を確実に摘出するのに有用な可能性はある.
この問題を解決するため,上述の分光計を用いて可視化できない弱いPpIX蛍光を数値化することで,lower-grade gliomaのPDDを行う研究が進んでいる33).Valedsらは12例のlower grade gliomaに対して5-ALAを用いたFGSを行い,従来の肉眼でのPpIX蛍光と分光計を用いたPpIX蛍光強度を比較,肉眼では38%であったのに対し,分光計では67%とより高い精度で診断可能であることを示した43).Widhalmらは,同様に分光計プローブを用いてPpIX蛍光を定量化して肉眼での蛍光と比較,lower-grade gliomaにおいて分光計による定量が有用だったと報告している44).また,Sanaiらは,lower-grade gliomaのFGSにおいて,肉眼的に確認できないlPpIX蛍光を,術中confocal microscopyを用いて検出することに成功している45).これらの定量化技術は,lower-grade gliomaにおけるFGSの正確性を改善するだけでなく,下記の断端診断にも貢献すると考えられ,今後のさらなる研究が期待できる.
3.3 偽陽性・偽陰性の問題
膠芽腫はしばしば脳室壁に浸潤するが,正常脳室壁自体が蛍光を発するため,腫瘍か正常脳室壁かをPDDで判断するのは難しい.Moonらの報告では25例の膠芽腫手術症例で,脳室壁に蛍光を認めた11ヶ所で実際に腫瘍細胞を認めたのは5ヶ所のみであった46).最近Mutherらは,5-ALAを用いたFGSにおける脳室壁の蛍光を評価した論文のmeta analysisを報告,6 studyにおける198症例の解析にて,悪性神経膠腫手術で脳室壁の蛍光を示したのは61.4%で,蛍光を示した脳室壁組織で腫瘍細胞が存在したのは54.5%であった47).現時点で脳室壁の蛍光の意義は不明であり,腫瘍細胞の存在を特徴付けるとは言えない.したがって,脳室に浸潤した腫瘍を摘出する場合には,PDDだけに頼ることはリスクが高く,術中迅速病理診断や術中MRIなどのモダリティを組み合わせて評価することが重要である.
また,腫瘍本体を摘出した後に,摘出断端部や周囲脳との境界部に残存腫瘍や浸潤腫瘍細胞が存在するかの評価はかなり難しい.またその難しさは,どの様な摘出を目標とするかで変わってくる.すなわち,画像上の境界までの摘出を目標とするのか,いわゆる浸潤腫瘍細胞の拡大摘出を行うのか,でPDDの有用性は異なる.
腫瘍摘出後の断端における弱い蛍光を示す部位に腫瘍細胞が存在するかの報告は多数なされている.この断端部は,浸潤腫瘍細胞,炎症細胞やreactive astrocyteなどが存在し,これらが淡い蛍光を示すために,摘出すべきかの判断は容易ではない.実際,Miyatakeらは腫瘍周囲や脱髄病変におけるreactive astrocyteにおいてPPIX蛍光が観察される事を報告している48).またUtsukiらの報告では,42例の悪性神経膠腫手術症例で,腫瘍および周辺組織の蛍光強度と病理所見の比較を行い,強い蛍光部位では1.3%(2/152),弱い蛍光部位では17.2%(25/145)で腫瘍細胞が存在しなかった49).偽陽性だった部位の病理所見は好中球の浸潤やreactive astrocyteであった49).Stummerらも最近,33例の悪性神経膠腫手術症例での摘出断端の組織所見と蛍光強度との関係を報告28),弱い蛍光部位で偽陽性を示したのは15.2%(5/33)で,陽性適中率は82.8%であった28).一方,強い蛍光を示した部位は全て腫瘍細胞が存在したと述べた.以上より,摘出断端において強い蛍光を示した部位は脳室壁を除いて概ね安全に摘出可能と判断できるが,弱い蛍光部位を追加摘出する場合は,偽陽性の可能性が否定できないため,術中迅速診断などを組み合わせるべきで,eloquentな部位ではモニタリングや覚醒下手術などを併用しながら慎重に意思決定を行うべきである.
4. グリオーマ以外の腫瘍におけるPDDの役割
4.1 転移性脳腫瘍
転移性脳腫瘍における5-ALA PDDに関して多くの報告があるが,概ね悪性神経膠腫に比較して感度が低くその有用性には疑問がある.最近のKampらの報告では,84例中蛍光を示したのは34例(40.5%)であった50).また蛍光を示した腫瘍に比べ蛍光を示さなかった腫瘍の方が局所再発率が高かった(p = 0.0456)50).両群に生存期間の差はなかったが,腫瘍が蛍光を示す場合は微小な取り残しを避けることができるかもしれない.Yagiらは,16例の転移性脳腫瘍を検討し,蛍光を示したのは5例のみ(31.3%)であったが51),14例で周囲に淡い蛍光を示し,それらの組織の多く(75%, 12/16)には浸潤腫瘍細胞を認めたと報告した51).したがって,転移性脳腫瘍におけるPDDは感度は低いが,蛍光を示した場合にはより効果的な腫瘍摘出に有用であると思われる50).
4.2 髄膜腫
髄膜腫における5-ALA PDDに関しては,腫瘍本体の蛍光というよりは,摘出断端やdural tail部での浸潤を評価が主体になると思われる52).また,5-ALAは保険適用されておらず,施設内臨床研究の範囲での使用に留まっている.Millesiらは,204例の手術症例での5-ALAの蛍光解析を報告,91%の症例で腫瘍での蛍光が観察されたが,dural tailには蛍光は見られなかった.一方,サテライト病変,骨浸潤部位および脳への浸潤部位にも蛍光が観察され,これらの同定に有用であったとしている53).Knippsらは13例の髄膜腫のdural tailの104病変での蛍光を肉眼とスペクトル解析で評価したところ,腫瘍細胞が存在したdural tail部位で手術顕微鏡下では半数近く(47%)が蛍光を確認できなかったが,スペクトル解析ではほとんど(95%)で蛍光を認めた54).したがって,dural tail部の浸潤細胞評価には5-ALAのスペクトル解析が有用であるとしている54).また,悪性度の高い髄膜腫での骨浸潤や脳浸潤などの評価に有効との報告もある55,56).
5. 5-ALA以外の光感受性物質やその他の技術を用いたPDD
5.1 Talaporfin sodium(NPe6,レザフィリン)によるPDD
レザフィリンは,第2世代の光感受性物質と言われ第1世代のフォトフィリンに比較して,体外への排出速度が速いため光線過敏期間が短く,患者の遮光期間を短縮することができる.東京女子医科大学と東京医科大学にて,原発性悪性脳腫瘍に対するPDTの医師主導治験が施行され,非常に良好な成績を得たため57),2013年に原発性悪性脳腫瘍に対するレザフィリンを用いたPDTが保険収載された.承認後の臨床研究においても,膠芽腫の治療成績が従来の治療法に比べて改善している58).レザフィリンを用いたPDTは早期肺がんや食道癌でも保険収載されており59,60),最近では子宮頸癌においてもフォトフィリンと同様の良好な治療成績が得られている.
レザフィリンを用いてPDTを行う際に,同時にPDDを行うことができれば,PDDを用いた腫瘍の最大限摘出を行いながら効果的なPDTを行うことが可能になる.レザフィリンは5-ALAと同様ポルフィリン誘導体であるが,5-ALAのように細胞内で代謝を受けて蛍光を発する物質に変換されるのではなく,レザフィリンそのものが蛍光を発する.実験的にはレザフィリンが脳腫瘍細胞内に選択的に集積することは示されていた61,62).
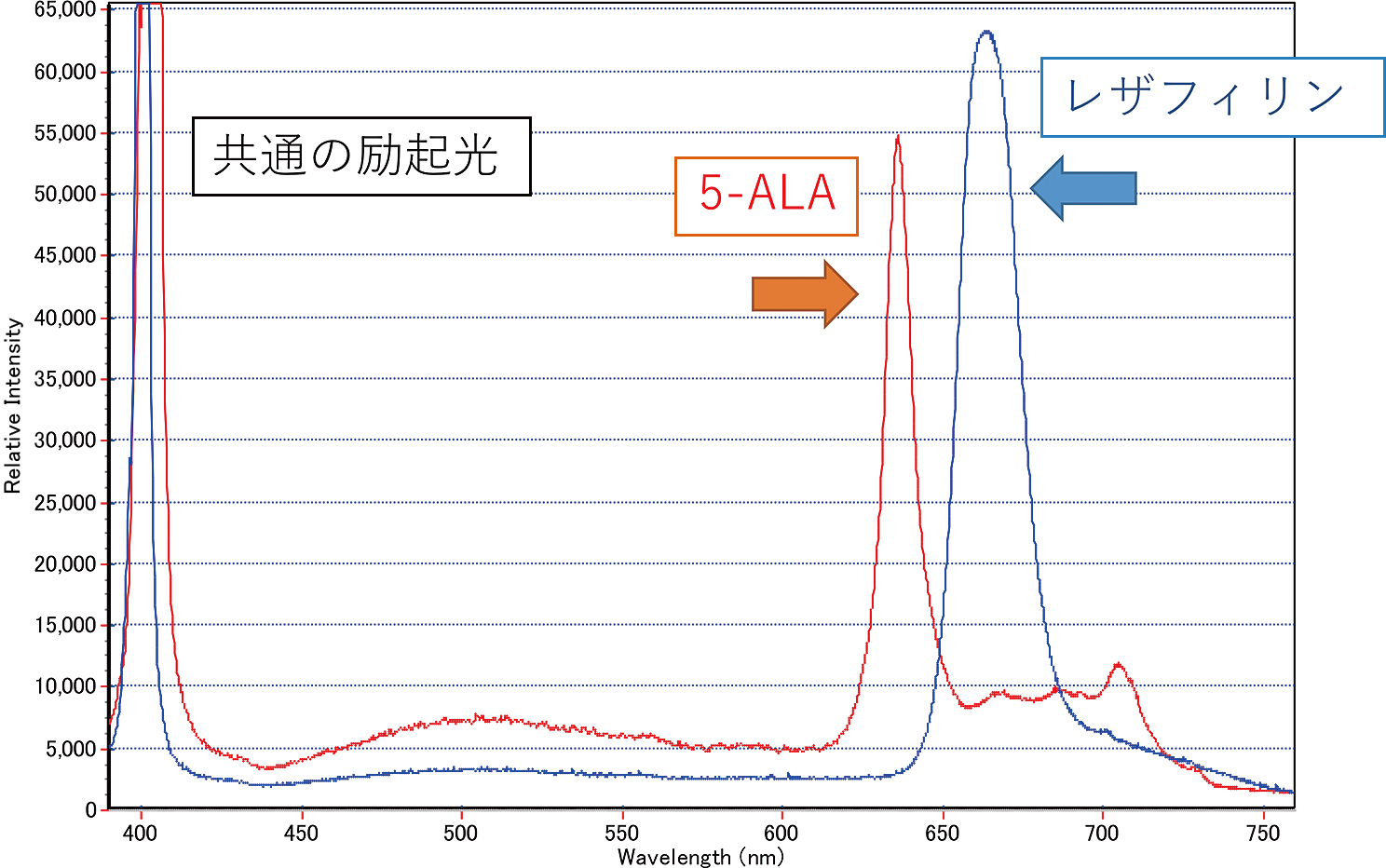
最近我々は,膠芽腫の手術においてレザフィリンを用いたPDDが可能かどうかを,手術検体を用いて検討し,5-ALA PDDと比較してほぼ同等の蛍光が得られることを発表した63).手術中に摘出した膠芽腫に400 nmの励起光を当てることで,664 nmの蛍光ピークを観察でき(Fig.1),肉眼でも赤い蛍光を観察できた.また腫瘍本体と境界部で明らかな蛍光強度の差を認めた63).膠芽腫手術でPDDが可能であることを示したとともに,レザフィリンを用いたPDTのproof of conceptとなった.5-ALA PDD用の青色蛍光ユニットを有する手術用顕微鏡を用いることで,レザフィリンを用いたPDDとPDTを同時に行うことは可能と考えられる.しかしながら,PDDを多用することで,photobleaching(褪色)効果によってPDTの効果が減弱する可能性は否定できない.
6. まとめ
光感受性物質5-ALAを用いた悪性神経膠腫に対するFGSは,腫瘍の摘出率向上とPFS延長に貢献しているが,現在多くの研究者が,本方法論のさらなる有効性向上をめざして,術中蛍光の客観的評価法,偽陽性,偽陰性の問題の克服などに取り組んでいる.また,PDTで承認を受けているTalaporfin sodiumを用いたPDDの基礎的・臨床的研究も報告されている.今後,PDDが脳腫瘍の標準的治療の一助としてさらなる発展を遂げ,OS改善のエビデンスが得られることを期待したい.
引用文献
- 1) Nitta M, Muragaki Y, Maruyama T, Iseki H, Ikuta S, Konishi Y, Saito T, Tamura M, Chernov M, Watanabe A, Okamoto S, Maebayashi K, Mitsuhashi N, Okada Y. Updated therapeutic strategy for adult low-grade glioma stratified by resection and tumor subtype. Neurol Med Chir (Tokyo). 2013; 53: 447-454.
- 2) Nitta M, Muragaki Y, Maruyama T, Ikuta S, Komori T, Maebayashi K, Iseki H, Tamura M, Saito T, Okamoto S, Chernov M, Hayashi M, Okada Y. Proposed therapeutic strategy for adult low-grade glioma based on aggressive tumor resection. Neurosurg Focus. 2015; 38: E7.
- 3) Fujii Y, Muragaki Y, Maruyama T, Nitta M, Saito T, Ikuta S, Iseki H, Hongo K, Kawamata T. Threshold of the extent of resection for WHO Grade III gliomas: Retrospective volumetric analysis of 122 cases using intraoperative MRI. J Neurosurg. 2018; 129: 1-9.
- 4) Sanai N, Berger MS. Glioma extent of resection and its impact on patient outcome. Neurosurgery. 2008; 62: 753-764; discussion 264-756.
- 5) Li YM, Suki D, Hess K, Sawaya R. The influence of maximum safe resection of glioblastoma on survival in 1229 patients: Can we do better than gross-total resection? J Neurosurg. 2016; 124: 977-988.
- 6) Brown TJ, Brennan MC, Li M, Church EW, Brandmeir NJ, Rakszawski KL, Patel AS, Rizk EB, Suki D, Sawaya R, Glantz M. Association of the extent of resection with survival in glioblastoma: A systematic review and meta-analysis. JAMA Oncol. 2016; 2: 1460-1469.
- 7) Fukui A, Muragaki Y, Saito T, Maruyama T, Nitta M, Ikuta S, Kawamata T. Volumetric analysis using low-field intraoperative magnetic resonance imaging for 168 newly diagnosed supratentorial glioblastomas: Effects of extent of resection and residual tumor volume on survival and recurrence. World Neurosurg. 2017; 98: 73-80.
- 8) Muragaki Y, Iseki H, Maruyama T, Tanaka M, Shinohara C, Suzuki T, Yoshimitsu K, Ikuta S, Hayashi M, Chernov M, Hori T, Okada Y, Takakura K. Information-guided surgical management of gliomas using low-field-strength intraoperative MRI. Acta Neurochir Suppl. 2011; 109: 67-72.
- 9) Yamada S, Muragaki Y, Maruyama T, Komori T, Okada Y. Role of neurochemical navigation with 5-aminolevulinic acid during intraoperative MRI-guided resection of intracranial malignant gliomas. Clin Neurol Neurosurg. 2015; 130: 134-139.
- 10) Stepp H, Stummer W. 5-ALA in the management of malignant glioma. Lasers Surg Med. 2018; 50: 399-419.
- 11) Ennis SR, Novotny A, Xiang J, Shakuia P, Masada T, Stummer W, Smith DE, Keep RF. Transport of 5-aminolevulinic acid between blood and brain. Brain Res. 2003; 959: 226-234.
- 12) Hagiya Y, Fukuhara H, Matsumoto K, Endo Y, Nakajima M, Tanaka T, Okura I, Kurabayashi A, Furihata M, Inoue K, Shuin T, Ogura S. Expression levels of PEPT1 and ABCG2 play key roles in 5-aminolevulinic acid (ALA)-induced tumor-specific protoporphyrin IX (PpIX) accumulation in bladder cancer. Photodiagnosis Photodyn Ther. 2013; 10: 288-295.
- 13) Zimmermann M, Stan AC. PepT2 transporter protein expression in human neoplastic glial cells and mediation of fluorescently tagged dipeptide derivative beta-Ala-Lys-Nepsilon-7-amino-4-methyl-coumarin-3-acetic acid accumulation. J Neurosurg. 2010; 112: 1005-1014.
- 14) Navone NM, Polo CF, Frisardi AL, Andrade NE, Battle AM. Heme biosynthesis in human breast cancer—mimetic “in vitro” studies and some heme enzymic activity levels. Int J Biochem. 1990; 22: 1407-1411.
- 15) Hinnen P, de Rooij FW, van Velthuysen ML, Edixhoven A, van Hillegersberg R, Tilanus HW, Wilson JH, Siersema PD. Biochemical basis of 5-aminolaevulinic acid-induced protoporphyrin IX accumulation: A study in patients with (pre)malignant lesions of the oesophagus. Br J Cancer. 1998; 78: 679-682.
- 16) Ohgari Y, Nakayasu Y, Kitajima S, Sawamoto M, Mori H, Shimokawa O, Matsui H, Taketani S. Mechanisms involved in delta-aminolevulinic acid (ALA)-induced photosensitivity of tumor cells: Relation of ferrochelatase and uptake of ALA to the accumulation of protoporphyrin. Biochem Pharmacol. 2005; 71: 42-49.
- 17) Teng L, Nakada M, Zhao SG, Endo Y, Furuyama N, Nambu E, Pyko IV, Hayashi Y, Hamada J. Silencing of ferrochelatase enhances 5-aminolevulinic acid-based fluorescence and photodynamic therapy efficacy. Br J Cancer. 2011; 104: 798-807.
- 18) Zhao SG, Chen XF, Wang LG, Yang G, Han DY, Teng L, Yang MC, Wang DY, Shi C, Liu YH, Zheng BJ, Shi CB, Gao X, Rainov NG. Increased expression of ABCB6 enhances protoporphyrin IX accumulation and photodynamic effect in human glioma. Ann Surg Oncol. 2013; 20: 4379-4388.
- 19) Matsumoto K, Hagiya Y, Endo Y, Nakajima M, Ishizuka M, Tanaka T, Ogura S. Effects of plasma membrane ABCB6 on 5-aminolevulinic acid (ALA)-induced porphyrin accumulation in vitro: Tumor cell response to hypoxia. Photodiagnosis Photodyn Ther. 2015; 12: 45-51.
- 20) Kawai N, Hirohashi Y, Ebihara Y, Saito T, Murai A, Saito T, Shirosaki T, Kubo T, Nakatsugawa M, Kanaseki T, Tsukahara T, Shichinohe T, Li L, Hirano S, Torigoe T. ABCG2 expression is related to low 5-ALA photodynamic diagnosis (PDD) efficacy and cancer stem cell phenotype, and suppression of ABCG2 improves the efficacy of PDD. PLoS One. 2019; 14: e0216503.
- 21) Palasuberniam P, Yang X, Kraus D, Jones P, Myers KA, Chen B. ABCG2 transporter inhibitor restores the sensitivity of triple negative breast cancer cells to aminolevulinic acid-mediated photodynamic therapy. Sci Rep. 2015; 5: 13298.
- 22) Kitajima Y, Ishii T, Kohda T, Ishizuka M, Yamazaki K, Nishimura Y, Tanaka T, Dan S, Nakajima M. Mechanistic study of PpIX accumulation using the JFCR39 cell panel revealed a role for dynamin 2-mediated exocytosis. Sci Rep. 2019; 9: 8666.
- 23) Stummer W, Novotny A, Stepp H, Goetz C, Bise K, Reulen HJ. Fluorescence-guided resection of glioblastoma multiforme by using 5-aminolevulinic acid-induced porphyrins: A prospective study in 52 consecutive patients. J Neurosurg. 2000; 93: 1003-1013.
- 24) Stummer W, Pichlmeier U, Meinel T, Otmar Dieter Wiestler, Zanella F, Reulen HJ, for the ALA-Glioma Study Group. Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: A randomised controlled multicentre phase III trial. Lancet Oncol. 2006; 7: 392-401.
- 25) Pichlmeier U, Bink A, Schackert G, Stummer W, Group ALAGS. Resection and survival in glioblastoma multiforme: An RTOG recursive partitioning analysis of ALA study patients. Neuro Oncol. 2008; 10: 1025-1034.
- 26) ALA-Glioma Study Group, Stummer W, Reulen HJ, Meinel T, Pichlmeier U, Schumacher W, Tonn JC, Rohde V, Oppel F, Turowski B, Woiciechowsky C, Franz K, Pietsch T. Extent of resection and survival in glioblastoma multiforme: Identification of and adjustment for bias. Neurosurgery. 2008; 62: 564-576.
- 27) Coburger J, Engelke J, Scheuerle A, Thal DR, Hlavac M, Wirtz CR, König R. Tumor detection with 5-aminolevulinic acid fluorescence and Gd-DTPA-enhanced intraoperative MRI at the border of contrast-enhancing lesions: A prospective study based on histopathological assessment. Neurosurg Focus. 2014; 36: E3.
- 28) Stummer W, Tonn JC, Goetz C, Ullrich W, Stepp H, Bink A, Pietsch T, Pichlmeier U. 5-Aminolevulinic acid-derived tumor fluorescence: The diagnostic accuracy of visible fluorescence qualities as corroborated by spectrometry and histology and postoperative imaging. Neurosurgery. 2014; 74: 310-319; discussion 319-320.
- 29) Hadjipanayis CG, Widhalm G, Stummer W. What is the surgical benefit of utilizing 5-aminolevulinic acid for fluorescence-guided surgery of malignant gliomas? Neurosurgery. 2015; 77: 663-673.
- 30) Hadjipanayis CG, Stummer W. 5-ALA and FDA approval for glioma surgery. J Neurooncol. 2019; 141: 479-486.
- 31) Kiesel B, Mischkulnig M, Woehrer A, Martinez-Moreno M, Millesi M, Mallouhi A, Czech T, Preusser M, Hainfellner JA, Wolfsberger S, Knosp E, Widhalm G. Systematic histopathological analysis of different 5-aminolevulinic acid-induced fluorescence levels in newly diagnosed glioblastomas. J Neurosurg. 2018; 129: 341-353.
- 32) Tonn JC, Stummer W. Fluorescence-guided resection of malignant gliomas using 5-aminolevulinic acid: Practical use, risks, and pitfalls. Clin Neurosurg. 2008; 55: 20-26.
- 33) Valdes PA, Juvekar P, Agar NYR, Gioux S, Golby AJ. Quantitative wide-field imaging techniques for fluorescence guided neurosurgery. Front Surg. 2019; 6: 31.
- 34) Valdes PA, Leblond F, Paulsen KD, Kim A, Wilson BC, Conde OM, Harris BT, Roberts DW. Combined fluorescence and reflectance spectroscopy for in vivo quantification of cancer biomarkers in low- and high-grade glioma surgery. J Biomed Opt. 2011; 16: 116007.
- 35) Haj-Hosseini N, Richter JC, Hallbeck M, Wardell K. Low dose 5-aminolevulinic acid: Implications in spectroscopic measurements during brain tumor surgery. Photodiagnosis Photodyn Ther. 2015; 12: 209-214.
- 36) Kairdolf BA, Bouras A, Kaluzova M, Sharma AK, Wang MD, Hadjipanayis CG, Nie S. Intraoperative spectroscopy with ultrahigh sensitivity for image-guided surgery of malignant brain tumors. Anal Chem. 2016; 88: 858-867.
- 37) Cornelius JF, Placke JM, Knipps J, Fischer I, Kamp M, Steiger HJ. Minispectrometer with handheld probe for 5-ALA based fluorescence-guided surgery of brain tumors: Preliminary study for clinical applications. Photodiagnosis Photodyn Ther. 2017; 17: 147-153.
- 38) Widhalm G, Kiesel B, Woehrer A, Traub-Weidinger T, Preusser M, Marosi C, Prayer D, Hainfellner JA, Knosp E, Wolfsberger S. 5-Aminolevulinic acid induced fluorescence is a powerful intraoperative marker for precise histopathological grading of gliomas with non-significant contrast-enhancement. PLoS One. 2013; 8: e76988.
- 39) Jaber M, Wolfer J, Ewelt C, Holling M, Hasselblatt M, Niederstadt T, Zoubi T, Weckesser M, Stummer W. The value of 5-aminolevulinic acid in low-grade gliomas and high-grade gliomas lacking glioblastoma imaging features: An analysis based on fluorescence, magnetic resonance imaging, 18F-Fluoroethyl tyrosine positron emission tomography, and tumor molecular factors. Neurosurgery. 2016; 78: 401-411.
- 40) Goryaynov SA, Widhalm G, Goldberg MF, Chelushkin D, Spallone A, Chernyshov KA, Ryzhova M, Pavlova G, Revischin A, Shishkina L, Jukov V, Savelieva T, Victor L, Potapov A. The role of 5-ALA in low-grade gliomas and the influence of antiepileptic drugs on intraoperative fluorescence. Front Oncol. 2019; 9: 423.
- 41) Widhalm G, Wolfsberger S, Minchev G, Woehrer A, Krssak M, Czech T, Prayer D, Asenbaum S, Hainfellner JA, Knosp E. 5-aminolevulinic acid is a promising marker for detection of anaplastic foci in diffusely infiltrating gliomas with nonsignificant contrast enhancement. Cancer. 2010; 116: 1545-1552.
- 42) Ewelt C, Floeth FW, Felsberg J, Steiger HJ, Sabel M, Langen KJ, Stoffels G, Stummer W. Finding the anaplastic focus in diffuse gliomas: The value of Gd-DTPA enhanced MRI, FET-PET, and intraoperative, ALA-derived tissue fluorescence. Clin Neurol Neurosurg. 2011; 113: 541-547.
- 43) Valdes PA, Jacobs V, Harris BT, Wilson BC, Leblond F, Paulsen KD, Roberts DW. Quantitative fluorescence using 5-aminolevulinic acid-induced protoporphyrin IX biomarker as a surgical adjunct in low-grade glioma surgery. J Neurosurg. 2015; 123: 771-780.
- 44) Widhalm G, Olson J, Weller J, Bravo J, Han SJ, Phillips J, Hervey-Jumper SL, Chang SM, Roberts DW, Berger MS. The value of visible 5-ALA fluorescence and quantitative protoporphyrin IX analysis for improved surgery of suspected low-grade gliomas. J Neurosurg. 2019; 10: 1-10.
- 45) Sanai N, Snyder LA, Honea NJ, Coons SW, Eschbacher JM, Smith KA, Spetzler RF. Intraoperative confocal microscopy in the visualization of 5-aminolevulinic acid fluorescence in low-grade gliomas. J Neurosurg. 2011; 115: 740-748.
- 46) Moon JH, Kim SH, Shim JK, Roh TH, Sung KS, Lee JH, Park J, Choi J, Kim EH, Kim SH, Kang SG, Chang JH. Histopathological implications of ventricle wall 5-aminolevulinic acid-induced fluorescence in the absence of tumor involvement on magnetic resonance images. Oncol Rep. 2016; 36: 837-844.
- 47) Muther M, Stummer W. Ependymal fluorescence in fluorescence-guided resection of malignant glioma: A systematic review. Acta Neurochir (Wien). 2019.
- 48) Miyatake S, Kuroiwa T, Kajimoto Y, Miyashita M, Tanaka H, Tsuji M. Fluorescence of non-neoplastic, magnetic resonance imaging-enhancing tissue by 5-aminolevulinic acid: Case report. Neurosurgery. 2007; 61: E1101-1103; discussion E1103-1104.
- 49) Utsuki S, Oka H, Sato S, Shimizu S, Suzuki S, Tanizaki Y, Kondo K, Miyajima Y, Fujii K. Histological examination of false positive tissue resection using 5-aminolevulinic acid-induced fluorescence guidance. Neurol Med Chir (Tokyo). 2007; 47: 210-213; discussion 213-214.
- 50) Kamp MA, Fischer I, Buhner J, Turowski B, Cornelius JF, Steiger HJ, Rapp M, Slotty PJ, Sabel M. 5-ALA fluorescence of cerebral metastases and its impact for the local-in-brain progression. Oncotarget. 2016; 7: 66776-66789.
- 51) Yagi R, Kawabata S, Ikeda N, Nonoguchi N, Furuse M, Katayama Y, Kajimoto Y, Kuroiwa T. Intraoperative 5-aminolevulinic acid-induced photodynamic diagnosis of metastatic brain tumors with histopathological analysis. World J Surg Oncol. 2017; 15: 179.
- 52) Motekallemi A, Jeltema HR, Metzemaekers JD, van Dam GM, Crane LM, Groen RJ. The current status of 5-ALA fluorescence-guided resection of intracranial meningiomas—A critical review. Neurosurg Rev. 2015; 38: 619-628.
- 53) Millesi M, Kiesel B, Mischkulnig M, Martínez-Moreno M, Wöhrer A, Wolfsberger S, Knosp E, Widhalm G. Analysis of the surgical benefits of 5-ALA-induced fluorescence in intracranial meningiomas: Experience in 204 meningiomas. J Neurosurg. 2016; 125: 1408-1419.
- 54) Knipps J, Beseoglu K, Kamp M, Fischer I, Felsberg J, Neumann LM, Steiger HJ, Cornelius JF. Fluorescence behavior and dural infiltration of meningioma analyzed by 5-aminolevulinic acid-based fluorescence: Operating microscope versus mini-spectrometer. World Neurosurg. 2017; 108: 118-127.
- 55) Morofuji Y, Matsuo T, Hayashi Y, Suyama K, Nagata I. Usefulness of intraoperative photodynamic diagnosis using 5-aminolevulinic acid for meningiomas with cranial invasion: Technical case report. Neurosurgery. 2008; 62: 102-103; discussion 103-104.
- 56) Della Puppa A, Rustemi O, Gioffre G, Troncon I, Lombardi G, Rolma G, Sergi M, Munari M, Cecchin D, Gardiman MP, Scienza R. Predictive value of intraoperative 5-aminolevulinic acid-induced fluorescence for detecting bone invasion in meningioma surgery. J Neurosurg. 2014; 120: 840-845.
- 57) Muragaki Y, Akimoto J, Maruyama T, Iseki H, Ikuta S, Nitta M, Maebayashi K, Saito T, Okada Y, Kaneko S, Matsumura A, Kuroiwa T, Karasawa K, Nakazato Y, Kayama T. Phase II clinical study on intraoperative photodynamic therapy with talaporfin sodium and semiconductor laser in patients with malignant brain tumors. J Neurosurg. 2013; 119: 845-852.
- 58) Nitta M, Muragaki Y, Maruyama T, Iseki H, Komori T, Ikuta S, Saito T, Yasuda T, Hosono J, Okamoto S, Koriyama S, Kawamata T. Role of photodynamic therapy using talaporfin sodium and a semiconductor laser in patients with newly diagnosed glioblastoma. J Neurosurg. 2018; 131: 1361-1368.
- 59) Kato H, Furukawa K, Sato M, Okunaka T, Kusunoki Y, Kawahara M, Fukuoka M, Miyazawa T, Yana T, Matsui K, Shiraishi T, Horinouchi H. Phase II clinical study of photodynamic therapy using mono-L-aspartyl chlorin e6 and diode laser for early superficial squamous cell carcinoma of the lung. Lung Cancer. 2003; 42: 103-111.
- 60) Yano T, Kasai H, Horimatsu T, Yoshimura K, Teramukai S, Morita S, Tada H, Yamamoto Y, Kataoka H, Kakushima N, Ishihara R, Isomoto H, Muto M. A multicenter phase II study of salvage photodynamic therapy using talaporfin sodium (ME2906) and a diode laser (PNL6405EPG) for local failure after chemoradiotherapy or radiotherapy for esophageal cancer. Oncotarget. 2017; 8: 22135-22144.
- 61) Matsumura H, Akimoto J, Haraoka J, Aizawa K. Uptake and retention of the photosensitizer mono-L-asparthyl chlorine e6 in experimental malignant glioma. Lasers Med Sci. 2008; 23: 237-245.
- 62) Tsurubuchi T, Zaboronok A, Yamamoto T, Nakai K, Yoshida F, Shirakawa M, Matsuda M, Matsumura A. The optimization of fluorescence imaging of brain tumor tissue differentiated from brain edema—In vivo kinetic study of 5-aminolevulinic acid and talaporfin sodium. Photodiagnosis Photodyn Ther. 2009; 6: 19-27.
- 63) Shimizu K, Nitta M, Komori T, Maruyama T, Yasuda T, Fujii Y, Masamune K, Kawamata T, Maehara T, Muragaki Y. Intraoperative photodynamic diagnosis using talaporfin sodium simultaneously applied for photodynamic therapy against malignant glioma: A prospective clinical study. Front Neurol. 2018; 9: 24.