Abstract
【目的】ナルデメジンは消化管のµオピオイド受容体に拮抗してオピオイド誘発性便秘(opioid-induced constipation: OIC)を改善するが,副作用として下痢が知られている.ナルデメジン導入後の下痢発現の予測因子についてオピオイド鎮痛薬投与期間に着目して解析した.【方法】2017年6月1日から2019年3月31日の期間に長崎大学病院においてナルデメジンをはじめて導入した患者を対象に後方視的調査を行った.【結果】調査対象は132名であり,下痢は33名(25.0%)に発現した.多変量ロジスティック回帰分析の結果,ナルデメジン導入前のオピオイド鎮痛薬投与日数8日以上は下痢発現と有意に関連した(オッズ比:3.76, 95%信頼区間:1.53-9.20, p=0.004).【考察】OICに対してナルデメジンを使用する場合,オピオイド開始後7日以内に使用することで,下痢の発現を回避できる可能性が示唆された.
緒言
オピオイド鎮痛薬はがん性疼痛,あるいは慢性疼痛に対して優れた鎮痛効果を示すが,便秘,悪心・嘔吐,眠気といった副作用が知られている.中でもオピオイド誘発性便秘(opioid-induced constipation: OIC)はオピオイド鎮痛薬を投与した患者の40%から100%に発症することが報告されており1〜5),オピオイド鎮痛薬の継続が困難となる場合もしばしばある6).
本邦のがん疼痛の薬物治療に関するガイドライン 2014年版では,OICの治療薬として主に便が硬い場合は浸透圧性下剤を,主に腸蠕動が低下している場合は大腸刺激性下剤を用い,効果が不十分の場合は両者を併用することを推奨している7).OIC治療薬である末梢性µオピオイド受容体拮抗薬(peripheral µ-opioid receptor antagonist: PAMORA)は,ガイドライン発刊時点で未発売であったため推奨に関する記載はない.一方,European Association for Palliative Care(EAPC)8),European Society for Medical Oncology(ESMO)9),National Comprehensive Cancer Network(NCCN)10)のガイドラインでは,浸透圧性下剤や大腸刺激性下剤などの緩下剤に治療抵抗性のOICの場合,PAMORAを検討することと記載されている.PAMORAはOICに対する有効性が示されているが,下痢,腹痛,悪心・嘔吐といった消化器毒性があることが知られており,メタアナリシスの結果より下痢のリスク比は2.07であることが示されている11).
ナルデメジンは本邦ではじめて承認されたPAMORAである.OICを有するがん患者あるいは非がん慢性疼痛患者を対象とした国内第III相試験において,ナルデメジンは自発排便(レスキュー緩下薬投与後24時間以内の排便を除く排便)をプラセボと比較して有意に増加させたことが報告されている12〜14).一方で,国内第II相試験(V9222),第III相試験(V9236,V9237)における安全性解析では21.9%(49名/224名)に下痢が発現している.また,下痢発現後の転帰についてV9222試験およびV9236試験(V9237試験非移行例)において解析されているが,17.6%(6名/34名)の患者においてナルデメジンが中止に至ったことが報告されている.V9222試験およびV9236試験(V9237試験非移行例)ではナルデメジン投与後の下痢発現時期についても解析されており,投与1日目に50.0%(17名/34名)が,投与後3日目までに64.8%(22名/34名)が下痢を発現していたことが示されている15).非がん患者を対象とした臨床試験においても,ナルデメジンによる下痢発現の頻度は投与1日目が最も多く,2日目以降は徐々に低下することが報告されている16).下痢発現を予測することができれば,ナルデメジンをより安全に使用できる可能性があるが,これまでにナルデメジンによる下痢発現の予測因子に関する報告は見当たらない.また,国内第III相試験では,登録基準としてオピオイド鎮痛薬を2週間以上投与している患者が設けられているため,ナルデメジン導入前のオピオイド鎮痛薬の投与期間が安全性に与える影響に関する情報は不足している.以上のことから,実臨床におけるナルデメジンの使用実態を調査し,ナルデメジン導入後の下痢発現要因を明らかにすることは,OIC管理において有益な情報になると考えた.
そこで,われわれは長崎大学病院(以下,当院)においてナルデメジンが導入された患者を対象に,ナルデメジン導入後の下痢発現の実態調査を行った.次いで,下痢発現の予測因子について検討する目的で,とくにナルデメジン導入前のオピオイド鎮痛薬の投与期間に着目した解析を行った.
方法
調査対象
2017年6月1日から2019年3月31日の期間に,当院においてナルデメジンがはじめて導入された入院患者を調査対象とした.
除外基準
ナルデメジンによる下痢発現は投与初期に多くみられることが知られていることから,本調査におけるナルデメジン導入後の下痢発現に関する評価期間はナルデメジン導入後3日間と設定した.そのため,ナルデメジン導入後3日間の評価が困難な以下の①②の患者を除外基準とした.
①ナルデメジン導入後3日以内に退院,外泊した患者.
②ナルデメジン導入後3日以内に中止された患者.ただし,下痢が理由で中止の場合は本調査の対象とした.
また,下痢の評価に影響を与える可能性を考慮して,③の患者を除外基準とした.
③ナルデメジン導入後3日以内に経腸栄養剤が開始された患者.
また,調査項目の評価が不可能であるため,④の患者を除外した.
④調査項目についてカルテ記載がない患者.
調査項目
すべての調査項目は電子カルテを用いて,後方視的に調査した.調査項目は性別,年齢,体重,ナルデメジン投与前の検査値(血清クレアチニン値,血清アスパラギン酸アミノトランスフェラーゼ値(aspartate aminotransferase: AST),血清アラニンアミノトランスフェラーゼ値(alanine aminotransferase: ALT)),主病名,血液脳関門の機能不全が疑われる疾患の有無,便秘治療薬併用の有無および併用している場合の薬剤名称,併用したオピオイド鎮痛薬の種類と投与量,ナルデメジン導入までのオピオイド鎮痛薬の使用日数,抗がん薬併用の有無,Cytochrome P450(CYP)3A4阻害薬,CYP3A4誘導薬,P糖タンパク阻害薬併用の有無と併用している場合の薬剤名称,経腸栄養剤併用の有無,ナルデメジン導入後3日間の下痢の有無とした.なお,下痢は有害事象共通用語規準(Common Terminology Criteria for Adverse Events: CTCAE)version 5.0日本語訳Japan Clinical Oncology Group(JCOG)版を用いて評価し,Grade 1以上の下痢がみられた場合を,下痢ありと定義した.血液脳関門の機能不全が疑われる疾患として,スインプロイク®錠のインタビューフォームに記載されている転移性を含む脳腫瘍,エイズに伴う認知症,多発性硬化症,アルツハイマー型認知症を調査した17).オピオイド鎮痛薬の投与量は経口モルヒネ換算で計算した.換算はがん疼痛の薬物療法に関するガイドライン(2014年版)18)および各オピオイド鎮痛薬の添付文書より,経口モルヒネ30 mg=経口オキシコドン20 mg=静注オキシコドン15 mg=フェンタニル0.3 mg=経口タペンタドール100 mg=経口ヒドロモルフォン6 mg=経口トラマドール 150 mg=経口リン酸コデイン 180 mg=経口メサドン3.5 mgとした.本調査におけるCYP3A4阻害薬/誘導薬,およびP糖タンパク阻害薬はFood and Drug Administration(FDA)のDrug Development and Drug Interactions: Table of Substrates, Inhibitors and Inducers19)に記載がある薬剤とした.また,便秘治療薬はがん患者の消化器症状の緩和に関するガイドライン(2017年版)に記載されている薬剤20)に加え,ガイドライン発刊以降に本邦で使用可能となったエロビキシバット,リナクロチド,ラクツロース,マグコロール4000とした.
解析方法
統計解析には,JMP® Pro 14(SAS Institute Japan,東京)を用いた.危険率5%を有意水準とした.
1.患者背景および併用薬の比較
ナルデメジン導入までのオピオイド鎮痛薬の使用日数を1~7日(以下,S群),8~14日(以下,M群),15日以上(以下,L群)に分類し,それぞれの患者背景および併用薬を比較した.連続尺度データについてはKruskal-Wallis検定を,名義尺度データはFisherの正確確率検定を行った.
2.ナルデメジン導入前のオピオイド鎮痛薬投与日数別における下痢発現の比較
S群,M群,L群におけるそれぞれの下痢発現の割合をGrade別に算出し,Fisherの正確確率検定を用いて比較した.また,S群とM+L群とのGrade 1以上の下痢発現をFisherの正確確率検定を用いて同様に比較した.
3.ナルデメジン導入後の下痢発現に関する多変量ロジスティック回帰分析
非巡回有向グラフ(Directed acyclic graph: DAG)21)を用いてナルデメジン導入前のオピオイド鎮痛薬使用日数と下痢発現に関わる要因を図式化した.DAGは今回調査した項目に加え,未測定ではあるが下痢発現に影響を及ぼすと考えられる身体活動量およびナルデメジン導入前の便秘の有無と重症度を用いて作成した(図).なお,ナルデメジンの第II相試験において,0.4 mg/日を投与した患者群では,承認用量である0.2 mg/日を投与した患者群と比較して下痢の発現頻度が高くなったことが報告されている22)ことから,ナルデメジンの曝露量と下痢発現との間には関連があると考えDAGに反映した.バックドア基準23)に基づき,ナルデメジン導入前のオピオイド鎮痛薬使用日数と下痢発現との間の交絡因子として便秘治療薬併用ありを選定した.下痢発現に対するナルデメジン投与前のオピオイド鎮痛薬使用日数 8日以上(以下,オピオイド投与8日以上)の影響について,単変量ロジスティック回帰分析を用いて解析した.次いで,オピオイド投与8日以上と,交絡因子と考えられる便秘治療薬併用ありを説明変数とした多変量ロジスティック回帰分析を実施した.さらに結果の信頼性を検討するため,オピオイド投与8日以上と便秘治療薬併用ありに加えて,未測定因子であるナルデメジン導入前の便秘の有無と重症度の上流に位置すると考えられる年齢,性別,消化管がん,経腸栄養剤の併用をそれぞれ説明変数とし,多変量ロジスティック回帰分析を行った.

図
ナルデメジン導入前のオピオイド鎮痛薬の投与期間と下痢発現との関連を中心とした非巡回有向グラフ(Directed acyclic graph: DAG)
本調査は当院倫理委員会の承認を得て実施した(承認番号:19111807).
結果
対象患者
調査対象は132名であり,男性は92名(69.7%)であった.主病名は肝胆膵がん25名(18.9%),頭頸部がん23名(17.4%),消化管がん22名(16.7%),肺がん20名(15.2%),婦人科がん10名(7.6%),泌尿器がん8名(6.1%),血液がん6名(4.5%),乳がん5名(3.8%),悪性軟部組織腫瘍5名(3.8%),皮膚がん2名(1.5%),原発不明がん2名(1.5%),その他(非がん含む)4名(3.0%)であった.血液脳関門の機能不全が疑われる疾患は5名(3.8%)であった.年齢,体重の中央値はそれぞれ66歳,57.5 kgであった.臨床検査値の中央値はいずれも基準値の範囲内であった(表1).
表1
対象患者の背景

ナルデメジン導入時に併用していたオピオイド鎮痛薬の投与量の中央値は,経口モルヒネ換算20 mgであった.また,ナルデメジン導入前のオピオイド鎮痛薬の投与日数の中央値は6日であった.オピオイド鎮痛薬以外の併用薬の使用状況は,便秘治療薬76名(57.6%),CYP3A4阻害薬12名(9.1%),CYP3A4誘導薬1名(0.8%),P糖タンパク阻害薬5名(3.8%),抗がん薬70名(53.0%)であった.経腸栄養剤を使用していたのは7名(5.3%)であった(表2).
表2
併用薬・経腸栄養剤の使用状況

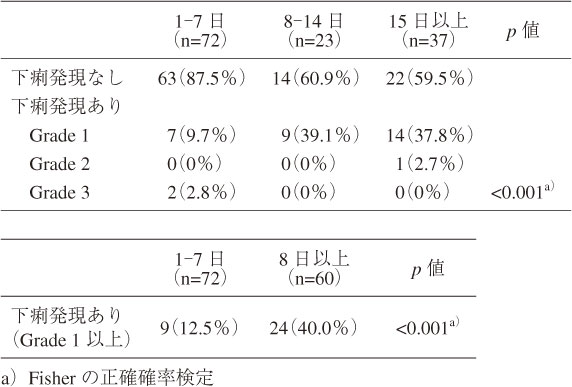
S群72名,M群23名,L群37名であった.血液がんはS群3名(4.2%),M群3名(13.0%),L群0名(0%)と偏りがあった(p=0.049).併用したオピオイド鎮痛薬の投与量(経口モルヒネ換算)の中央値は,S群16 mg, M群30 mg, L群30 mgであり有意差がみられた(p<0.001).便秘治療薬の併用はS群32名(44.4%),M群16名(69.6%),L群28名(75.7%)と有意差を認めた(p=0.003).性別,年齢,体重,ナルデメジン導入前の検査値,血液がん以外の主病名,抗がん薬の有無,CYP3A4阻害薬,CYP3A4誘導薬,P糖タンパク阻害薬,経腸栄養剤併用の有無において有意差がみられた項目はなかった(表3).下痢の発現は,S群でGrade 1が7名(9.7%),Grade 3が2名(2.8%),M群でGrade 1が9名(39.1%),L群でGrade 1が14名(37.8%),Grade 2が1名(2.7%)と偏りを認めた(p<0.001).また,Grade 1以上の下痢発現はM+L群で24名(40.0%),S群で9名(12.5%)であり,M+L群で有意に多かった(p<0.001)(表4).なお,ナルデメジン導入前から下痢を認めた症例はなかった.
表3
ナルデメジン投与前のオピオイド鎮痛薬投与日数別の群間比較

表4
ナルデメジン投与前のオピオイド鎮痛薬投与日数別における下痢発現の比較
ナルデメジン導入後3日間の下痢発現とオピオイド投与8日以上との関連を単変量ロジスティック回帰分析にて解析したところ,正の相関を認めた(オッズ比(OR): 4.67,95%信頼区間(95%CI): 1.96-11.12,p<0.001).便秘治療薬併用ありで調整した結果,同様に正の相関が認められた(OR: 3.76, 95%CI: 1.53-9.20, p=0.004).便秘治療薬併用ありに加え,性別,年齢(10歳上昇するごと),消化管がん,経腸栄養剤の併用ありをそれぞれ調整因子とした場合も同様に正の相関が見られた(表5).
表5
下痢発現(Grade 1以上)に対するロジスティック回帰分析

考察
本調査の結果,ナルデメジン導入前のオピオイド鎮痛薬の投与期間が8日以上の場合,7日以下と比較してナルデメジン導入後の下痢発現の割合が高かった(表4).われわれはこの結果についてより詳細に検討するため,DAG21)とバックドア基準23)を用いて交絡因子として便秘治療薬併用ありを選定した.便秘治療薬併用がある場合,ナルデメジン導入前のオピオイド鎮痛薬の投与期間に影響を与える可能性があると予想され,今回の結果でもオピオイド鎮痛薬の投与期間が長い場合は便秘治療薬を併用している患者の割合が高かった(表3).さらに,便秘治療薬の併用はアウトカムである下痢発現に影響を及ぼす可能性があると推察される.しかしながら,オピオイド投与8日以上と便秘治療薬併用とを説明変数とした多変量ロジスティック回帰分析の結果において,オピオイド投与8日以上は下痢発現と有意に関連した(表5).この結果から,ナルデメジン導入前のオピオイド鎮痛薬の投与期間は,併用している便秘治療薬とは独立して下痢発現に寄与する可能性が示唆される.オピオイド鎮痛薬の使用期間と下痢発現との間に関連が見られた理由として,オピオイド鎮痛薬を長期に使用した患者に対してナルデメジンを投与すると,消化管においてµオピオイド受容体が拮抗され,オピオイド鎮痛薬の退薬症候の一つである下痢が発現した可能性があると考える.なお,ナルデメジン導入時のオピオイド鎮痛薬の投与量は退薬症候に影響を与えることが推察され24),オピオイド鎮痛薬の投与期間別の比較であるS群,M群,L群との比較において偏りを認めた(表3).しかし,今回の解析においては中間因子になると考え,多変量ロジスティック回帰分析の説明変数としては選択しなかった.
血液がんはS群,M群,L群の間に偏りを認めた(表3).しかし,M+L群(8日以上)とS群(7日以下)で比較した場合,血液がんはM+L群5.0%(3名/60名),S群4.2%(3名/72名)と有意差はみられない(p=1.000).このことから,下痢発現とオピオイド投与8日以上との関連に影響を及ぼす可能性は少ないと考えている.
DAGとバックドア基準からは,便秘治療薬併用ありだけではなく,ナルデメジン導入前の便秘の有無と重症度は交絡因子になりうる要因であると考えられる.そこで,われわれはナルデメジン導入前の便秘の有無と重症度の上流に位置すると考えられる年齢,性別,消化管がん,経腸栄養剤の併用について,それぞれの因子を便秘治療薬併用ありに加えたロジスティック回帰分析を行い,いずれの因子で調整してもオピオイド投与8日以上は下痢発現と正の関連を認めることを確認した(表5).これより,ナルデメジン導入前の便秘の有無と重症度を直接調査できなかった限界は残るものの,あらゆる背景因子で調整してもオピオイド投与8日以上が下痢発現に関連する可能性が示された.今後は,ナルデメジン導入前の便秘の有無と重症度を前向きに調査し,検証する必要がある.なお,本調査の対象患者は132名であり,そのうち下痢発現例は33名であることから,多変量ロジスティック回帰分析に用いる説明変数は三つまでが妥当と考え25),オピオイド投与8日以上,便秘治療薬併用あり,年齢,性別,消化管がん,経腸栄養剤の併用の6因子を説明変数とした多変量ロジスティック回帰分析は実施しなかった.
本調査における下痢の発現頻度は,25.0%(33名/132名)であった.一方,国内の第III相試験における下痢の発現頻度は21.0%であった.国内第III相臨床試験ではナルデメジン導入前にオピオイド鎮痛薬を14日以上投与している患者を対象としていたのに対して,本調査では14日以下の患者が95名(72.0%),7日以下の患者が72名(54.5%)存在していた.そのため,国内第III相臨床試験よりも本調査における下痢の発現頻度は少ないのではないかと予想したが,ほぼ同等の発現頻度であった.本調査における下痢はCTCAE version 5.0を用いたが,国内臨床試験ではCTCAE version 4.0と評価方法が異なる12)ことが一因であると推察される.下痢は,CTCAE version 4.0では頻回で水様の排便と記載されているのに対して,CTCAE version 5.0では排便頻度の増加や軟便または水様便の排便と記載されている.また,国内第III相臨床試験では肺がん45.1%,乳がん20.2%,大腸がん3.1%であったのに対して,われわれの調査では肝胆膵がん,消化管がんといった消化器系のがんの割合が高く,患者背景の違いが影響した可能性もある.
本調査の限界として,第一に外来患者や調査項目のカルテ記載がない患者は調査対象外としていること,単施設での調査であることから選択バイアスの存在が考えられる.入院患者は外来患者よりも排便状況を観察しやすく,OIC治療を開始しやすいことが予想される.そのため,本調査はナルデメジン導入前のオピオイド鎮痛薬の投与期間が短くなりやすい集団を対象とした可能性がある.第二にカルテ記載に基づく後方視的解析であることが挙げられる.とくに,CTCAEによる下痢の評価は医師・看護師のカルテ記載をもとに調査しており,記載もれの可能性が否定できない.第三に,身体活動量やナルデメジン導入前の便秘の有無と重症度といった未測定の因子がある.以上のことから,身体活動量やナルデメジン導入前の便秘の有無と重症度を調査項目に加えた多施設での前方視的な調査を行い,今回の結果を検証する必要があると考える.
結論
ナルデメジンを導入する場合,オピオイド鎮痛薬の使用期間が8日以上の場合は,7日以下と比較して下痢が発現しやすい可能性が示された.OICに対してナルデメジンを使用する場合,オピオイド鎮痛薬開始後から7日以内に使用することで,下痢の発現を回避できる可能性がある.今後は症例数を増やした多施設での前方視的調査が望まれる.
謝辞
統計解析についてご助言をいただきました長崎大学病院臨床研究センターの佐藤俊太朗先生に心からの謝意を表します.また,本研究の実施にあたり,ご協力いただきました皆様に厚く御礼申し上げます.
著者貢献
橋詰および龍は研究の構想およびデザイン,研究データの収集,分析,研究データの解釈,原稿の起草,原稿の重要な知的内容に関わる批判的な推敲に貢献;能勢は研究の構想およびデザイン,研究データの解釈,原稿の起草,原稿の重要な知的内容に関わる批判的な推敲に貢献;宮永および岸川は研究の構想およびデザイン,研究データの収集,分析,研究データの解釈,原稿の重要な知的内容に関わる批判的な推敲に貢献;中村,室,兒玉,山下,石井および佐々木は研究の構想およびデザイン,研究データの解釈,原稿の重要な知的内容に関わる批判的な推敲に貢献した.すべての著者は投稿論文ならびに出版原稿の最終承認,および研究の説明責任に同意した.
References
- 1) McMillan SC. Assessing and managing opiate-induced constipation in adults with cancer. Cancer Control 2004; 11(suppl 1): 3-9.
- 2) Kalso E, Edwards JE, Moore RA, et al. Opioids in chronic non-cancer pain: systematic review of efficacy and safety. Pain 2004; 112: 372-80.
- 3) Moore RA, McQuay HJ. Prevalence of opioid adverse events in chronic non-malignant pain: systematic review of randomised trials of oral opioids. Arthritis Res Ther 2005; 7: R1046-51.
- 4) Bell TJ, Panchal SJ, Miaskowski C, et al. The prevalence, severity, and impact of opioid-induced bowel dysfunction: results of a US and European Patient Survey (PROBE 1). Pain Med 2009; 10: 35-42.
- 5) Ishihara M, Ikesue H, Matsunaga H, et al. A multi-institutional study analyzing effect of prophylactic medication for prevention of opioid-induced gastrointestinal dysfunction. Clin J Pain 2012; 28: 373-81.
- 6) Abramowitz L, Béziaud N, Labreze L, et al. Prevalence and impact of constipation and bowel dysfunction induced by strong opioids: a cross-sectional survey of 520 patients with cancer pain: DYONISOS study. J Med Econ 2013; 16: 1423-33.
- 7) 日本緩和医療学会緩和医療ガイドライン作成委員会.オピオイドによる副作用.がん疼痛の薬物療法に関するガイドライン(2014年版).金原出版,東京,192-4.
- 8) Caraceni A, Hanks G, Kaasa S, et al. Use of opioid analgesics in the treatment of cancer pain: evidence-based recommendations from the EAPC. Lancet Oncol 2012; 13: e58-68.
- 9) Larkin PJ, Cherny NI, La Carpia D, et al. Diagnosis, assessment and management of constipation in advanced cancer: ESMO Clinical Practice Guidelines. Ann Oncol 2018; 29(suppl 4): iv111-25.
- 10) National Comprehensive Cancer Network. Adult cancer pain, ver.3 2019, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw 2019; 17: 977-1007.
- 11) Nishie K, Yamamoto S, Yamaga T, et al. Peripherally acting μ-opioid antagonist for the treatment of opioid-induced constipation: systematic review and meta-analysis. J Gastroenterol Hepatol 2019; 34: 818-29.
- 12) Katakami N, Harada T, Murata T, et al. Randomized Phase III and extension studies of naldemedine in patients with opioid-induced constipation and cancer. J Clin Oncol 2017; 35: 3859-66.
- 13) Katakami N, Harada T, Murata T, et al. Randomized phase III and extension studies: Efficacy and impacts on quality of life of naldemedine in subjects with opioid-induced constipation and cancer. Ann Oncol 2018; 29: 1461-7. doi: 10.1093/annonc/mdy118.
- 14) Saito Y, Yokota T, Arai M, et al. Naldemedine in Japanese patients with opioid-induced constipation and chronic noncancer pain: open-label Phase III studies. J Pain Res 2019; 12: 127-38.
- 15) 塩野義製薬株式会社,スインプロイク社内資料.下痢(副作用)の治験薬処置別の回復までの日数(がん患者対象国内Ph2b, Ph3).
- 16) Wild J, Yamada T, Arjona Ferreira JC, et al. Onset of action of naldemedine in the treatment of opioid-induced constipation in patients with chronic noncancer pain: results from 2 randomized, placebo-controlled, phase 3 trials. Pain 2019; 160: 2358-64.
- 17) 塩野義製薬株式会社,スインプロイク®錠0.2 mgインタビューフォーム 2017年6月改定(第3版).
- 18) 日本緩和医療学会緩和医療ガイドライン作成委員会.薬理学的知識 換算表.がん疼痛の薬物療法に関するガイドライン(2014年版).金原出版,東京,50-1.
- 19) Food and Drug Administration. Drug Development and Drug Interactions: Table of Substrates, Inhibitors and Inducers. https://www.fda.gov/drugs/drug-interactions-labeling/drug-development-and-drug-interactions-table-substrates-inhibitors-and-inducers (2019年11月10日アクセス).
- 20) 日本緩和医療学会緩和医療ガイドライン作成委員会.薬剤の解説.がん患者の消化器症状の緩和に関するガイドライン(2017年版).金原出版,東京,39-43.
- 21) Greenland S, Pearl J, Robins JM. Causal diagrams for epidemiologic research. Epidemiology 1999; 10: 37-48.
- 22) Katakami N, Oda K, Tauchi K, et al. Phase IIb, randomized, double-blind, placebo-controlled study of naldemedine for the treatment of opioid-induced constipation in patients with cancer. J Clin Oncol 2017; 35: 1921-8.
- 23) Shrier I, Platt RW. Reducing bias through directed acyclic graphs. BMC Med Res Methodol 2008; 8: 70. doi:10.1186/1471-2288-8-70.
- 24) 日本緩和医療学会緩和医療ガイドライン作成委員会 編.理学的知識 精神依存・身体依存・耐性.がん疼痛の薬物療法に関するガイドライン(2014年版).金原出版,東京,66-9.
- 25) Peduzzi P, Concato J, Kemper E, et al. A simulation study of the number of events per variable in logistic regression analysis. J Clin Epidemiol 1996; 49: 1373-9.






