Abstract
目的:がん患者の呼吸困難へのコルチコステロイド全身投与の有効性を検討する.方法:CENTRAL, MEDLINE, EMBASE, 医中誌を用い,2019年9月23日までに発表された全文献を検索した.主要評価項目は,患者報告による呼吸困難強度,副次評価項目は生活の質(quality of life: QOL),せん妄,重篤な有害事象とした.結果:4263件中2件の無作為化比較試験を採用し,メタ解析を行った.コルチコステロイド群はプラセボ群より有意に呼吸困難を軽減した[平均差:−0.71, 95% confidence interval (CI): −1.4~−0.03].2件中1件は肺病変を伴うがん患者を対象とした試験だった.QOLとせん妄のメタ解析はデータ不足により実施できず,重篤な有害事象の発生率に有意差を認めなかった(相対発生率:0.96, 95%CI: 0.19~4.93).結論:コルチコステロイドはがん患者の呼吸困難に有効である可能性があるが,その適応は限定的である可能性がある.
Translated Abstract
Objective: Almost half of all patients with cancer experience dyspnea, which can have various causes. Although systemic corticosteroids are administered to relieve symptoms, their efficacy has not been established. This systematic review aims to determine the efficacy of systemic corticosteroids for dyspnea in patients with cancer. Methods: CENTRAL, MEDLINE, EMBASE, and Ichushi-Web databases were searched for articles published from their inception to September 23, 2019, on studies of systemic corticosteroid administration for dyspnea in patients with cancer. The primary outcome measure was dyspnea intensity, as assessed by patient-reported outcomes. Secondary outcome measures were quality of life, delirium, and severe adverse events. Results: Two RCTs were included in the meta-analysis. With regard to alleviating dyspnea, the systematic corticosteroid group was associated with significantly greater dyspnea relief than the placebo group (mean difference: −0.71 [95% CI: −1.4 to −0.03]). However, a meta-analysis of quality of life and delirium could not be performed due to insufficient data. Analysis of severe adverse events showed no significant difference in their incidence between the corticosteroid and control groups (relative rate: 0.96 [95% CI: 0.19-4.93]). Conclusions: Systemic corticosteroids may be effective in treating dyspnea in patients with cancer, particularly those with lung involvement. Limiting the conditions for which corticosteroids are approved is expected to promote their appropriate use and minimize their adverse effects. However, further investigation is needed to determine the appropriate dosage, and the conditions in which corticosteroids are effective.
緒言
呼吸困難は,「呼吸の際に生じる不快な感覚という主観的な経験」と定義されている1).がん患者の46~59%が中程度から重度の呼吸困難を経験し2),病気の進行に伴いその頻度と強度が増加することが報告されている3,4).また,呼吸困難は,抑うつや不安を引き起こすだけでなく,日常生活動作に困難を伴い5,6),患者に著しい苦痛を与える7).
呼吸困難にはいくつかの原因があり,がんそのものに起因するもの(原発性または転移性の肺腫瘍,がん性リンパ管症など),がん治療に関連するもの(手術後の変化や薬剤関連の肺障害など),そして,がんとは直接関連のない併存疾患(慢性閉塞性肺疾患(chronic obstructive pulmonary disease: COPD)や間質性肺疾患など)があげられる8).
呼吸困難に対する治療の第一選択は呼吸困難の原因に対する治療だが8),進行がん患者では全身状態から侵襲的な治療が難しいことも多い.このような場合,呼吸困難に対する対症療法的な薬物療法や非薬物療法が用いられる9–11).コルチコステロイドは,抗炎症作用や腫瘍周囲の浮腫軽減作用から,がん患者の呼吸困難を軽減するために使用される薬物療法の一つである12).本邦で行われた全国調査によると,ほとんどの緩和ケア専門医ががんの呼吸困難にコルチコステロイドを使用しており,とくにがん性リンパ管症や上大静脈症候群,主要気道閉塞といった特定の病態に対して使用していることが報告されている13).しかし,コルチコステロイド全身投与の呼吸困難に対する有効性は十分に確立されていない14).
本システマティックレビューの目的は,がん患者の呼吸困難緩和に対するコルチコステロイド全身投与に関する現時点でのエビデンスを明らかにすることである.本システマティックレビューは,進行期疾患患者の呼吸困難の緩和に関する診療ガイドライン作成に際して実施された15–18).
方法
本システマティックレビューは,「システマティックレビューおよびメタアナリシスの報告ガイドライン(Preferred Reporting Items for Systematic reviews and Meta-Analysis: PRISMA)2020」に従って実施された19).プロトコルは,国際的なシステマティックレビュー登録サイト(PROSPERO)に登録した【CRD42020191331】.
選定基準
がん患者における呼吸困難の治療としてコルチコステロイド全身投与を行った無作為化比較試験(randomized control trial: RCT),非RCT,観察研究を網羅的に選定した.選定基準は以下の通りである.(1)少なくとも2件のRCTがあれば,それらを含める,(2)RCTがないか1件しかない場合,対照群がある非RCTまたは観察研究を含める,(3)対照群がないRCT,非RCT,観察研究の場合,単群観察研究を含める.症例報告や症例シリーズは除外した.
参加者の適格基準は,年齢18歳以上で,いずれかのがんと診断され,可逆的要因に対する適切な治療を受けてもなお呼吸困難が継続していることであった.性別,人種,施設に制限は設けなかった.参加者の選択戦略として,(1)がん患者のみを対象とした研究またはサブグループ解析を行った研究を優先して含めた.(2)そのような研究がない場合,対象者の50%以上ががん患者である研究を含めた.(3)いずれもない場合は,がん患者の割合が50%未満の研究を含めた.一方,がん患者を含まない研究は除外した.これらの参加者の適格基準は,研究デザインの選定基準よりも優先された.
評価項目
主要評価項目は,患者報告による呼吸困難の強さとした.副次評価項目は,任意の尺度を用いた生活の質(quality of life: QOL),せん妄の発生率,および重篤な有害事象の発生率とした.重篤な有害事象は,有害事象共通用語規準(Common Terminology Criteria for Adverse Events)におけるグレード3以上の事象と定義し,また,研究著者が「重篤」と記載した事象も含めた.
文献検索
文献検索は,Cochrane Central Register of Controlled Trials(CENTRAL: Cochrane Library),MEDLINE, EMBASE,医中誌Webを用い,各データベースの開始から2019年9月23日までに公開された論文を対象とした.検索語(付録表1参照)は,専門家の意見,文献レビュー,統制語彙(MeSH, EMTREE),および初回検索結果のレビューを基に選定した.さらに,関連研究やレビュー論文の参考文献をハンドリサーチで検索し,2020年11月15日にはPubMedで最新論文の追加検索を行った.
データ収集プロセス
一次スクリーニングでは,2名の評価者(鈴木および片山)が独立してタイトルと抄録を確認し,関連する可能性のある研究を抽出した.その後,一次スクリーニングで抽出された論文の全文を個別に評価し,適格基準を満たす研究を選定した.バイアスリスク評価は,Mindsガイドライン作成マニュアル2020 ver.3.0に基づいて行った20).評価項目には,選択バイアス(無作為化,コンシールメント),実行バイアス(盲検化),検出バイアス(盲検化),症例減少バイアス(Intention-to-treat: ITT,不完全アウトカム報告),報告バイアス(選択的アウトカム報告),早期試験中止,その他のバイアスが含まれ,意見の相違は第三者(小原)を交えて解決した.
データの結合
要約統計量の選択は,対象研究が同じ尺度を使用している場合[平均差と95%信頼区間(confidence interval: CI)]と,異なる尺度を使用している場合(標準化平均差と95% CI)に基づいて決定された.各研究のリスク比は,ランダム効果メタ解析を用いて統合した21).統合解析では,研究間の異質性をHigginsのI2検定で評価し,I2値が50%以上を異質性は有意と判断した.データはCochrane Collaborationの統計ソフトReview Manager 5.3を用いて解析し,二値データにはリスク比,連続データには加重平均差または標準化平均差を適用した.
結果
研究の選択
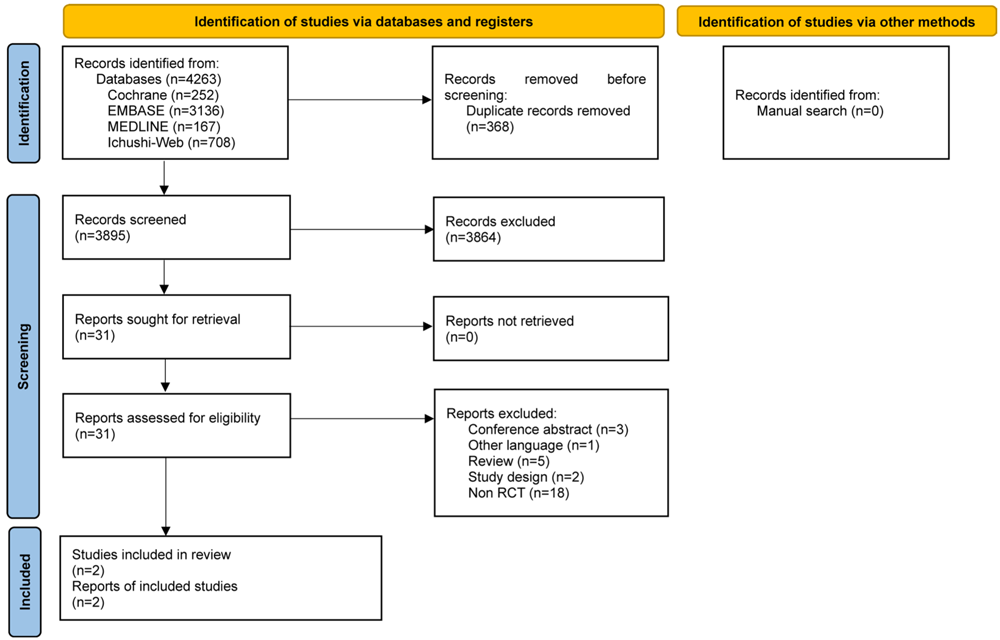
最終的に,データベースリサーチで4,263件の文献が抽出された.そのうち368件は重複のため除外され,残り3,895件のタイトルと抄録をスクリーニングした.その結果,31件が全文評価の対象となり,最終的に2件のRCTが採用された22,23)(図1,表1).
表1 採用文献の概要
| 研究 |
デザイン |
対象者 |
介入群 |
対象群 |
アウトカム |
| 呼吸困難の緩和 |
生活の質(QOL) |
せん妄 |
重篤な有害事象 |
| Yennurajalingam, 201322) |
RCT |
n=84
進行がん患者
過去24時間に三つ以上の症状(例:疼痛,倦怠感,悪心,悪液質,睡眠障害,抑うつ,食欲不振)を有し,エドモントン症状評価尺度(ESAS)で平均強度が4以上
平均年齢60.5 (29~89) |
デキサメタゾン
初回投与量4 mg
1日2回経口投与
14日間 |
プラセボ |
● |
— |
— |
● |
| Hui, 201623) |
RCT |
n=41
肺病変を伴うがん患者
介入前1週間における呼吸困難の数字評価スケール(NRS)平均強度が4以上
平均年齢63 (48~78) |
デキサメタゾン
初回投与量8 mg
1日2回経口投与
3日間 |
プラセボ |
● |
● |
— |
● |
QOL: quality of life, RCT: randomized control trial, ESAS: Edmonton Symptom Assessment System, NRS: numerical rating scale
一つ目のRCT22)は,進行がん患者84名を対象とし,過去24時間に三つ以上の症状(例:疼痛,倦怠感,悪心,悪液質,睡眠障害,抑うつ,食欲不振)を有し,エドモントン症状評価尺度(Edmonton Symptom Assessment System: ESAS)で平均強度が4以上である患者を含めた.本研究では,呼吸困難の強度を副次評価項目として評価した.介入群にはコルチコステロイド全身投与としてデキサメタゾンを初回投与量4 mg, 1日2回経口投与した.呼吸困難の評価は,介入8日目および15日目に実施した.
二つ目のRCT23)は,肺病変を伴うがん患者41名を対象とし,介入前1週間における呼吸困難の数字評価スケール(numerical rating scale)平均強度が4以上の患者を含めた.介入群にはコルチコステロイド全身投与としてデキサメタゾンを初回投与量8 mg, 1日2回経口投与した.呼吸困難の評価は,介入4日目および7日目に実施した.
バイアスリスク
図2は,コルチコステロイド全身投与の呼吸困難に対する有効性評価におけるバイアスリスクを示している.
一つ目のRCT22)では,ランダム化の方法が記載されていなかったため,ランダムシーケンス生成のバイアスリスクは「不明確」と評価された.また,ITT解析が実施されていなかったため,症例減少バイアスリスクは「高」と評価された.さらに,本研究では呼吸困難を主要評価項目として設定しておらず,呼吸困難を有していない症例も含まれていたことから,「間接性」によるバイアスリスクも「高」と評価された.
二つ目のRCT23)では,併存疾患であるCOPDの割合に有意な偏りは認められなかったものの,バランスの不均一性があったため,ランダムシーケンス生成のバイアスリスクは「不明確」と評価された.また,ITT解析が実施されていなかったため,症例減少バイアスリスクは「高」と評価された.さらに,本研究では脱落者が多く,最終的な解析対象症例数が少なかったため,欠測データ(アトリション)バイアスリスクは「高」と評価された.加えて,症例数が少ないことから,その他のバイアスリスクも「高」と判断された.
呼吸困難の強度
両RCT22,23)において,プラセボ群と比較した場合,介入後の呼吸困難の強度のベースラインからの変化には有意差は認められなかった.
しかし,これら二つのRCTを対象としたメタ解析の結果,コルチコステロイド群はプラセボ群に比べて有意に呼吸困難を軽減していた(平均差:−0.71, 95%信頼区間:−1.4~−0.03).また,統計的異質性は認められなかった(I2=0%,異質性のp値:0.49)(図3).
生活の質(QOL)
一つのRCT23)ではESASおよびEuropean Organization for Research and Treatment of Cancer QOL質問票コア30(EORTC-QLQ-C30)をQOL評価の指標として用いた.
ESASの眠気スコアにおいて,コルチコステロイド群は7日目に有意な改善を示した(−1.8±3.1 vs. 1.1±2.1, P=0.01).一方,ESASのほかの項目およびEORTC-QLQ-C30のスコアについては,両群間で有意な差は認められなかった.
せん妄
対象となったRCTのいずれも,せん妄を特異的に評価していなかった.
重篤な有害事象
重篤な有害事象は,二つのRCT22,23)で評価された.一つ目のRCT22)では,コルチコステロイド群の67例中17例(約25%),対照群の65例中11例(約17%)がグレード3以上の有害事象を経験した.二つ目のRCT23)では,コルチコステロイド群の20例中いずれも重篤な有害事象を経験しなかったが,対照群では21例中3例に重篤な有害事象が発生した.
これら二つのRCTを統合した解析の結果,コルチコステロイド群と対照群の間で重篤な有害事象の発生率に有意差は認められなかった(相対率:0.96, 95%CI:0.19~4.93).統計的異質性も認められなかった(I2=39%,異質性のp値:0.20)(図4).
考察
本研究のメタ解析では,がん患者の呼吸困難に対するコルチコステロイド全身投与の有効性が示唆された.一方で,本研究の実施後に発表されたデキサメタゾンのランダム化比較試験(Effect of dexamethasone on dyspnoea in patients with cancer: ABCD試験)では,コルチコステロイドの有効性はプラセボと比較して認められなかった24).この試験では,呼吸困難を有するがん患者を広く対象としており,すべてのがん患者に対して一律にコルチコステロイドを使用すべきではない可能性が示唆された.
最近発表されたアメリカ臨床腫瘍学会11)および欧州臨床腫瘍学会10)の臨床ガイドラインでは,炎症(例:がん性リンパ管症)や気道閉塞を原因とする呼吸困難に対してのみ,コルチコステロイド全身投与の使用を推奨している.また,本研究で含まれたRCTのうち1件23)は,肺病変を伴うがん患者のみを対象としていた.これらの結果を踏まえると,コルチコステロイド全身投与は,肺腫瘍の関与が明確な場合など,特定の病態に限定して使用するのが適切であると考えられる.さらに,がんそのものに起因する呼吸困難以外では抗がん剤や放射線治療に伴う治療関連肺障害に対してもコルチコステロイの投与が検討される10).
本研究のシステマティックレビューでは,コルチコステロイド群と対照群で重篤な有害事象の発生率に有意差は認められなかった.しかし,本レビューに含まれた研究ではせん妄に関する評価が行われていなかった.呼吸困難に対するコルチコステロイドの観察研究では,せん妄の発生率が8~12%と報告されている25,26).さらに,本レビューの実施後に発表されたRCTであるABCD試験24)では,感染症,不眠,精神症状など,コルチコステロイド群で頻度の高い有害事象が報告され,グレード3の高血糖も報告されている.したがって,本研究の結果から有害事象についての明確な結論を導くことは困難であるが,コルチコステロイド投与時には精神症状や高血糖といった有害事象に十分注意する必要があると考える.
本研究にはいくつかの限界がある.第一に,対象とした研究数が少ないことがあげられる.本レビューでは2件のRCTのみを含めたため,がん患者の呼吸困難に対するコルチコステロイド全身投与の有効性を確立するには十分なエビデンスとはいえない.さらに,本レビュー後にABCD試験24)が報告されており,今後ABCD試験を含めてメタ解析を行っていく必要がある.また,含まれたRCTのうち1件22)では,呼吸困難を有することが参加基準になっていなかったため,選択バイアスの可能性がある.二つ目として,追跡期間が短いことがあげられる.本レビューに含まれた研究の追跡期間は1~2週間であり,長期的な有効性および安全性については依然として不明である.最後に,適切なコルチコステロイドの用量が不明であることがあげられる.今回検討したRCTでは,デキサメタゾンの投与量が8~16 mg/日と設定されていた.一方で,日本の緩和ケア専門医を対象とした調査では,呼吸困難に対するデキサメタゾンの開始用量は6~8 mg/日であることが報告されている13).進行がん患者では,急速に進行する呼吸不全を伴うことが多く,RCTの実施が倫理的に困難である27,28).そのため,今後は多施設共同の大規模コホート研究を通じて,コルチコステロイドの適切な用量や有効性を予測する因子を明らかにすることが求められる.
結論
本システマティックレビューの結果,がん患者のうち肺病変を伴う呼吸困難に対しては,コルチコステロイド全身投与の使用が推奨される可能性が示唆された.近年発表されたABCD試験24)では否定的な結果が示されたものの,本研究の結果は,肺病変を伴う限られた病態において,コルチコステロイドが症状緩和に有効である可能性を支持している.しかし,コルチコステロイドが有効である病態の特定や適切な投与量の決定には,さらなる研究が必要である.
謝辞
本研究の文献検索において,Cochrane Japanの貴重な支援に深く感謝する.
研究資金
本研究は,日本緩和医療学会より資金提供を受けて実施された.
利益相反
山口崇:第一三共株式会社から講演料を受領している.
中山健夫:I&H株式会社,ココカラファイン株式会社,コニカミノルタ株式会社,NTTデータ株式会社から研究助成を受け,また,小野薬品工業株式会社から講演料を受領している.
その他の著者には,開示すべき利益相反はない.
著者貢献
すべての著者が本研究の構想およびデザインに関与した.原稿の起草に鈴木,研究データの収集・分析に鈴木,片山,小原,研究データの解釈に鈴木,片山,小原,山口が貢献した.すべての著者が原稿の重要な知的内容に関わる批判的な推敲に貢献し,投稿論文ならびに出版原稿の最終承認,および研究の説明責任に同意した.
References
- 1) American Thoracic Society. Dyspnea. Mechanisms, assessment, and management: a consensus statement. Am J Respir Crit Care Med 1999; 159: 321–40.
- 2) Chan KS, Tse DMW, Sham MMK. Dyspnea and other respiratory symptoms in palliative care. In Cherny NI, Fallon MT, Kaasa S, Portenoy RK, Currow, DC, eds. Oxford Textbook of Palliative Medicine, 5th ed. Oxford University Press, New York; 2015, 421–434.
- 3) Seow H, Barbera L, Sutradhar R, et al. Trajectory of performance status and symptom scores for patients with cancer during the last six months of life. J Clin Oncol 2011; 29: 1151–8.
- 4) Campbell ML, Kiernan JM, Strandmark J, et al. Trajectory of dyspnea and respiratory distress among patients in the last month of life. J Palliat Med 2018; 21: 194–9.
- 5) Tanaka K, Akechi T, Okuyama T, et al. Factors correlated with dyspnea in advanced lung cancer patients: organic causes and what else? J Pain Symptom Manage 2002; 23: 490–500.
- 6) Bruera E, Schmitz B, Pither J, et al. The frequency and correlates of dyspnea in patients with advanced cancer. J Pain Symptom Manage 2000; 19: 357–62.
- 7) Tishelman C, Petersson LM, Degner LF, et al. Symptom prevalence, intensity, and distress in patients with inoperable lung cancer in relation to time of death. J Clin Oncol 2007; 25: 5381–9.
- 8) Crombeen AM, Lilly EJ. Management of dyspnea in palliative care. Curr Oncol 2020; 27: 142–5.
- 9) Yamaguchi T, Goya S, Kohara H, et al. Treatment recommendations for respiratory symptoms in cancer patients: clinical guidelines from the Japanese Society for Palliative Medicine. J Palliat Med 2016; 19: 925–35.
- 10) Hui D, Maddocks M, Johnson MJ, et al. Management of breathlessness in patients with cancer: ESMO clinical practice guidelines. ESMO Open 2020; 5: e001038.
- 11) Hui D, Bohlke K, Bao T, et al. Management of dyspnea in advanced cancer: ASCO guideline. J Clin Oncol 2021; 39: 1389–411.
- 12) Lin RJ, Adelman RD, Mehta SS. Dyspnea in palliative care: expanding the role of corticosteroids. J Palliat Med 2012; 15: 834–7.
- 13) Suzuki K, Matsunuma R, Matsuda Y, et al. A nationwide survey of Japanese palliative care physicians’ practice of corticosteroid treatment for dyspnea in patients with cancer. J Pain Symptom Manage 2019; 58: e3–5.
- 14) Haywood A, Duc J, Good P, et al. Systemic corticosteroids for the management of cancer-related breathlessness (dyspnoea) in adults. Cochrane Database Syst Rev 2019; 2: CD012704.
- 15) 日本緩和医療学会ガイドライン統括委員会(編):進行性疾患患者の呼吸困難の緩和に関する診療ガイドライン2023年版,金原出版,東京,2023.
- 16) Hasegawa T, Ochi T, Goya S, et al. Efficacy of supplemental oxygen for dyspnea relief in patients with advanced progressive illness: a systematic review and meta-analysis. Respir Investig 2023; 61: 418–37.
- 17) Yasuda S, Sugano K, Matsuda Y, et al. Systematic review and meta-analysis of the efficacy of benzodiazepines for dyspnea in patients with cancer. Jpn J Clin Oncol 2023; 53: 327–34.
- 18) Takagi Y, Sato J, Yamamoto Y, et al. Opioids for the management of dyspnea in cancer patients: a systematic review and meta-analysis. Int J Clin Oncol 2023; 28: 999–1010.
- 19) Page MJ, McKenzie JE, Bossuyt PM, et al. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ 2021; 372: n71.
- 20) Minds Manual Developing Committee, eds. Minds Manual for Guideline Development 2020 ver. 3.0. Tokyo. Japan Council for Quality Health Care, 2021.
- 21) Higgins JPT, Green S, eds. Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 https://training.cochrane.org/handbook. (Accessed January 31, 2025).
- 22) Yennurajalingam S, Frisbee-Hume S, Palmer JL, et al. Reduction of cancer-related fatigue with dexamethasone: a double-blind, randomized, placebo-controlled trial in patients with advanced cancer. J Clin Oncol 2013; 31: 3076–82.
- 23) Hui D, Kilgore K, Frisbee-Hume S, et al. Dexamethasone for dyspnea in cancer patients: a pilot double-blind, randomized, controlled trial. J Pain Symptom Manage 2016; 52: 8–16.e1.
- 24) Hui D, Puac V, Shelal Z, et al. Effect of dexamethasone on dyspnoea in patients with cancer (ABCD): a parallel-group, double-blind, randomised, controlled trial. Lancet Oncol 2022; 23: 1321–31.
- 25) Mori M, Shirado AN, Morita T, et al. Predictors of response to corticosteroids for dyspnea in advanced cancer patients: a preliminary multicenter prospective observational study. Support Care Cancer 2017; 25: 1169–81.
- 26) Maeda T, Hayakawa T. Effect of administered corticosteroids for alleviating dyspnea in patients with terminal cancer: a prospective observational approach. Prog Palliat Care 2018; 26: 22–4.
- 27) Aoun SM, Nekolaichuk C. Improving the evidence base in palliative care to inform practice and policy: thinking outside the box. J Pain Symptom Manage 2014; 48: 1222–35.
- 28) Chen EK, Riffin C, Reid MC, et al. Why is high-quality research on palliative care so hard to do? Barriers to improved research from a survey of palliative care researchers. J Palliat Med 2014; 17: 782–7.
 https://orcid.org/0000-0002-1959-772X
https://orcid.org/0000-0002-1959-772X