2020 年 36 巻 1 号 p. 24-34
2020 年 36 巻 1 号 p. 24-34
小児の死亡時画像診断は死因究明,最終的な病態の把握,医療行為の確認,そして虐待の有無等生前の成育状況の評価などを目的に行われている.近年の報告では死後MRIによる解剖学的異常の描出が死後CTより優れていることが示されているが,検査費用が病院負担となることの多いわが国の現状では広く行うことは困難であり,死後CTがより多く実施されている.硬膜下出血など頭蓋内出血や骨折の評価には死後CTも有用であり,予期せぬ乳幼児の突然死の中に潜んでいる虐待による死亡をスクリーニングするために,院外死亡例について死後CTで外傷死をチェックしていくのが現実的で意義のある方法である.
Pediatric post-mortem imaging is used for many purposes, including determining the cause of death, assessing the true pathological condition, confirmation of medical procedures, and identifying child abuse. Post-mortem magnetic resonance (PMMR) has recently been reported to have higher diagnostic accuracy for congenital anomalies compared to post-mortem computed tomography (PMCT). However, more expensive MRI is rarely performed because its cost is hospital-borne in Japan. PMCT is a more commonly used method and may be a feasible and significant tool to detect abuse leading to death in sudden unexpected infant death cases.
死因究明,最終的な病態の把握,医療行為の確認,そして虐待の有無などの生前の成育状況の評価などを目的に,小児においても死後に画像診断が実施されている.死亡時画像診断の歴史,現在,期待される役割について言及する.
死亡時画像診断は入院治療や救急医療の延長線上にある臨床医学として行われる場合と,解剖の術前検査として司法医学の中で行われる場合に大別される.本稿では臨床医学の延長線上にある死亡時画像診断を取り扱う.一定の入院加療を行った後の死亡や,また予期せぬ乳幼児突然死など院外死が主な対象となる.
死亡時画像診断は画像診断の草創期から行われてきた.レントゲンがX線を発見した1895年11月8日(レントゲンの日)から,わずか3年後の1898年(明治31年)には死後の単純X線撮影が行われたことが確認されている.1904年以降に行われた死後の胸部単純X線撮影と肺の解剖所見の画像病理相関の研究は,生体の胸部単純X線写真の読影方法の確立に貢献している1).
CT,MRIも,その臨床応用開始とともに死亡時画像診断にも利用されるようになった.1990年以降には世界的に問題となった解剖率の低下に伴う死因究明の代替手段の模索の中で,2000年代に入りベルン大法医学教室において,解剖と相補的で部分的には代替しうる法医学的・病理学的検査としてCT,MRIを用いた仮想解剖(virtual autopsy; Virtopsy)という系統的なアプローチを示し,以後欧米各国では,法医学,病理学専門施設において遺体専用のCT,MRIが普及している1,2).
わが国においても来院時心肺停止状態の患者に対し,原因推定のためにCTが利用されるようになり,救急医療の現場で実質的な死亡時画像診断が行われてきた.
オートプシーイメージング(autopsy imaging; Ai,エーアイ)という用語・概念は,放射線医学総合研究所の病理医であった江澤英史が,生前画像と解剖所見の乖離が大きい重粒子線治療による腫瘍の治療効果検索のために用いる死亡時画像診断として提唱したものであり,2004年にオートプシーイメージング学会というわが国の死亡時画像診断研究の中心的学会の名称として冠されたことから,医療現場において死亡時画像診断を示すよく普及した用語ともなっている1).
発展してきた分野により呼称が異なるが,ここではもっとも一般的な用語として死因究明等推進基本法などの法規上の用語でもある死亡時画像診断を用い,取得された画像情報を死後画像,死後CT,死後MRIの様に呼称する.
2. 小児領域における死亡時画像診断の歴史小児領域における死亡時画像診断では,乳児期の予期せぬ死亡例や子ども虐待による死亡例への適用が早期から報告されてきた.たとえば1984年に米国マサチューセッツ州ウースター,ボストンで,12例の死因未解明の乳児死亡例に全身骨撮影を行った結果,10例34箇所の骨折を発見し,8例中6例の死因判断と有罪例5例中の4例の刑事訴追に影響したことが報告されている3).
わが国の子ども虐待診療手引き4)や乳児突然死診断の手引き5)においても死亡時画像診断の活用が推奨されており,2009年には医療・医学における死亡時画像診断(Ai)活用に関する検討委員会より「小児全例について体表からのみではなくAi で死因を確認すべきである」との提言が行われ6),小児の死亡時画像診断の読影を支援する医療・医学における死亡時画像診断(Ai)活用に関する検討委員会モデル事業が開始されている.
わが国での解剖実施率は2.7%と非常に低く,特定機能病院における病理解剖実施率も10%程度にとどまっている.これは生前の画像診断等医療技術の進歩等によるものとも考えられるが,死因究明の立場からは問題点と指摘されている.また日本の医療法に基づく医療事故調査においては調査方法のひとつとして通達で示されており,これらが死亡時画像診断を推進する動機となっている7).
わが国で死亡者のどの程度に死亡時画像診断が行われているかについての正確な統計は存在しない.種々のアンケート調査によれば,不慮の死亡例に対しては48.8%の症例で死後画像が取得されており,救命救急センターの89%で死亡時画像診断の経験があると報告されている7,8).これらの調査から10年程度を経過している現在では,死亡時画像診断はより普及していると推測され,依頼医,診療放射線技師,放射線科医の違和感も緩和されていると思われる.
死亡時画像診断の実施費用については明確な定めや支払い体制は存在しない.医療機関,ご家族,警察等の依頼機関などが,個々の事情に応じて負担している.
施設の管理者の許可があり,適正に放射線診断機器を稼動させている医療機関であれば,臨床機を用いて死亡時画像診断を行うことに制限は受けない.実施するにあたって施設,医師,診療放射線技師に要求される設備要件や資格要件はないが,オートプシー・イメージング学会では全国的な実施状況を把握する目的でAi撮影参加施設の登録を行っている.また日本診療放射線技師会では一定の臨床経験を有し,Ai認定講習会を受けたものをAi 認定診療放射線技師として認定している.
2. 同意取得と説明医療機関内の死亡患者が対象の場合は,原則としてご家族に対して死亡時画像診断の有用性や限界について十分な説明を行い,同意を得た上で実施すべきである7).しかし外因死の場合や小児の家庭内事故など不慮の死亡の場合には,担当医師や医療機関の判断により,ご家族の同意を得ずに死亡時画像診断が行われる場合もあり得る7).
3. 情報の取扱死亡時画像診断の資料の保存及び情報開示等については,診療に関する情報の取扱いを規定している既存の法令等(医療法第21条第1項第9号,医療法施行規則第20条第10号,医師法第24条,診療情報の提供等に関する指針,医療・介護関係事業者における個人情報の適切な取扱いのためのガイドライン等)を踏まえ,適切に行う必要がある7).
死亡時画像診断が行われた際は,他の画像診断と同様に画像診断報告書が作成され,主治医より他の臨床所見と併せてご家族に説明されるべきであり,犯罪の可能性等を示す事実が発見された場合には警察など然るべき機関への連絡が必要となる.
4. 撮影に際しての留意点死亡診断,ご家族の同意取得,ご遺体搬送,検査の連絡,他の受診者への配慮などについて,院内で検討し合意を得ておかねばならない.参考となる実施の手引き書がわが国でも発行されている9,10).
感染対策は,生体と同様に各施設での院内感染防止指針に従ったスタンダードプリコーションと感染経路別対策に基づいた対応が求められる10).検査を実施する従事者の感染防止と他の患者への感染予防が主眼となる.液性成分の漏出や臭気の対策としては,ご遺体を格納密閉する納体袋の活用が望まれるが,死亡診断直後に行われる死亡時画像診断であれば問題となることはほとんどない.
5. 使用モダリティと撮影条件正確な全国統計は存在しないが,アンケート調査では死亡時画像診断の97.6%にCTが行われ,単純X線撮影25.1%,MRI 3.6%に比して圧倒的に高く代表的な使用モダリティとなっている6).CTは医療機関での普及率が高く,短時間に広範囲を撮影する事が可能であり,外傷性変化や大量の出血など死因の判定に影響する情報を得る能力は単純X線撮影を上回る.
CT撮影条件については,死亡時の状態でなるべく高画質の画像を得ることに留意する9,10).すなわち原則として死亡時のままの体位で,放射線透過性のデバイス類は取り除かず,頭頂から足先までを撮影範囲とし,ピッチファクターをなるべく下げ,ビュー数と線量をあげる9,10).再構成画像は小児の小さな体格に適合した有効視野で行い,四肢の骨折を評価するなど,特定の目的や部位があればそれに適合した再構成画像を作成する(Fig. 1, 2).
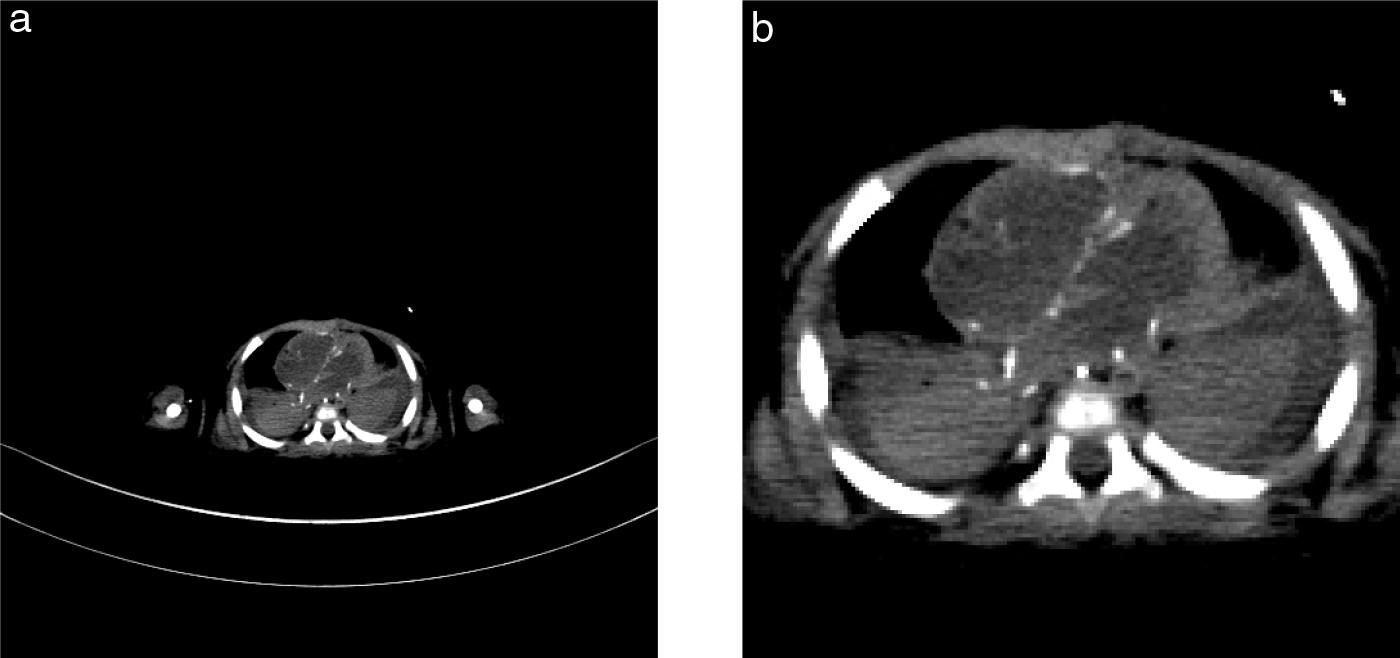
大きな関心領域だけでは情報を活かしきれない
生後1か月半 男児 死後CTの横断像(a)とその部分拡大(b).
死後CTは全身を撮影することが強調され,それをVR像で提示することが頻用される.小さな小児においても非常に大きな関心領域(FOV)で画像が再構成される場合が多い.体厚9 cmの本児でも軸位断像がFOV = 35 cmで再構成されている(a).部分拡大をすると辺縁は階段状に凹凸が目立ち解像度を喪失している(b).体の大きさに適合したFOVを選択して画像再構成をすることが望ましい.
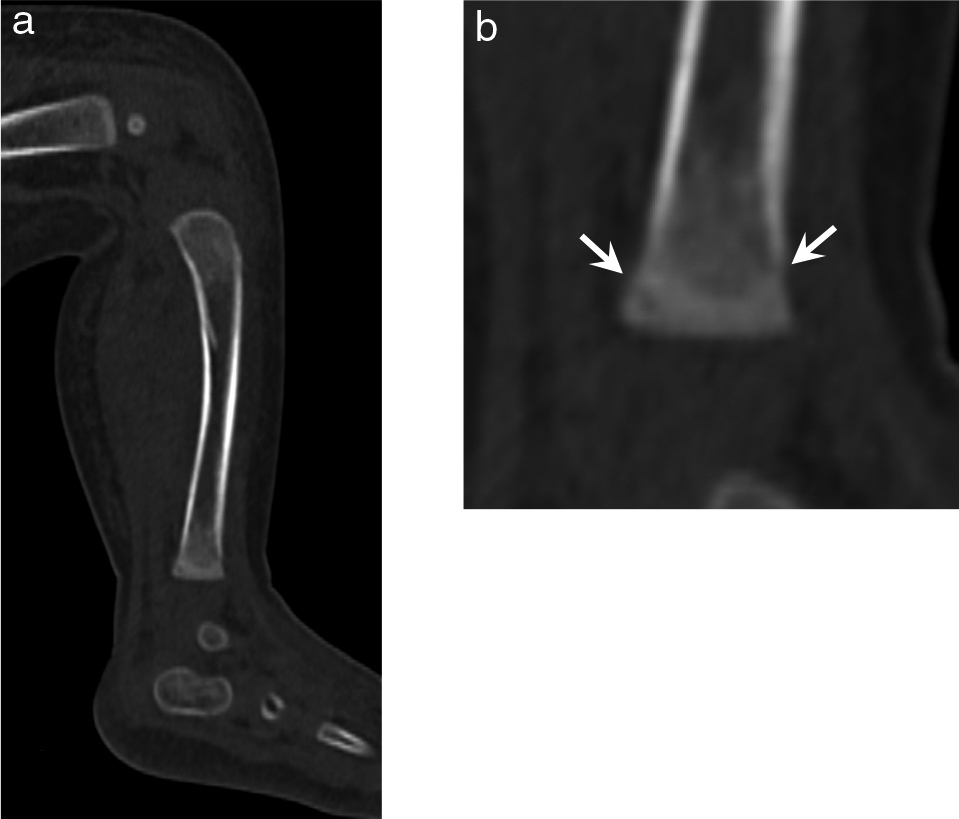
各器官・部位に絞った画像再構成で詳細な情報が得られる
生後1か月半 男児 死後CTの脛骨の矢状断MPR(a)とその部分拡大(b).
再構成断面やFOVを適切に設定すると,非常に詳細な検討が行える.
この患者の脛骨の長さはわずか7 cmで成人の親指程度の大きさであるが,脛骨長軸に合わせてMRPを作成し,さらに遠位骨幹端部を拡大して観察すると(b),脛骨遠位骨幹端の角骨折が明瞭に描出される(b→).身体的虐待の存在と関連が深い損傷であり,本児の死亡に関連する司法判断の重要な根拠とされた.
欧州小児放射線学会(European Society of Paediatric Radiology; ESPR)と国際法医画像学会(International Society for Forensic Radiology and Imaging; ISFRI)の提唱するガイドラインは,今後死後CTの撮影プロトコールと画像再構成に大きな影響を与えるものと思われる11).
死亡時画像診断における画像所見は,a)死後変化(死体現象),b)蘇生術後変化,c)病変(死因関与に係わらず)の3つに大別される.
1.死後変化(死体現象)(Fig. 3, 4)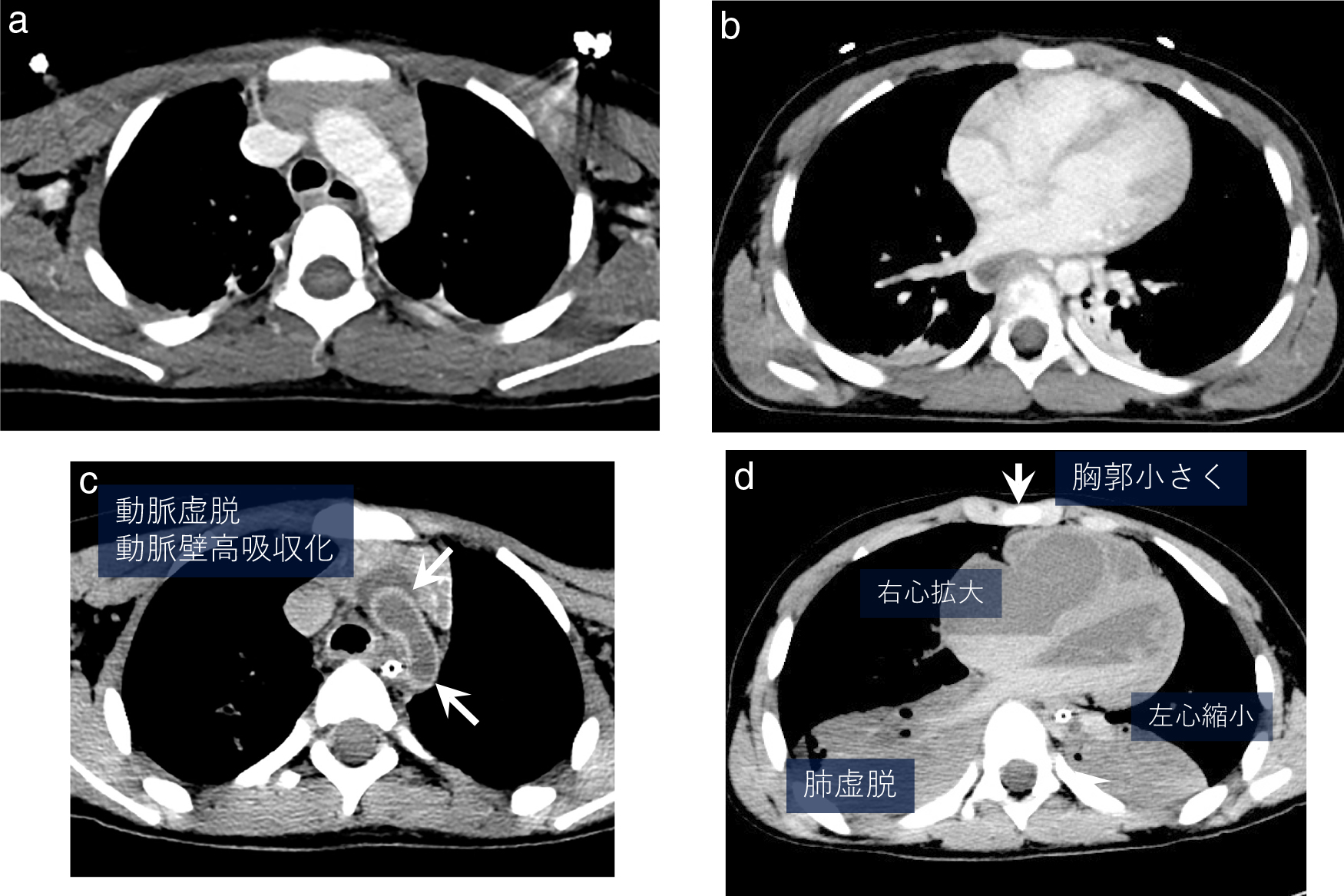
死亡(呼吸・循環停止)による変化
同一人の生前の造影CT(a, b)と死後CT(c, d).
循環・呼吸の停止により,血管内圧は左心系は平均充満圧まで低下し,大動脈は虚脱して壁は高吸収化する(c→).左心室は収縮して停止,右心系は拡大,肺は虚脱,吸気が消失して胸郭の断面積の縮小も起こる(d).
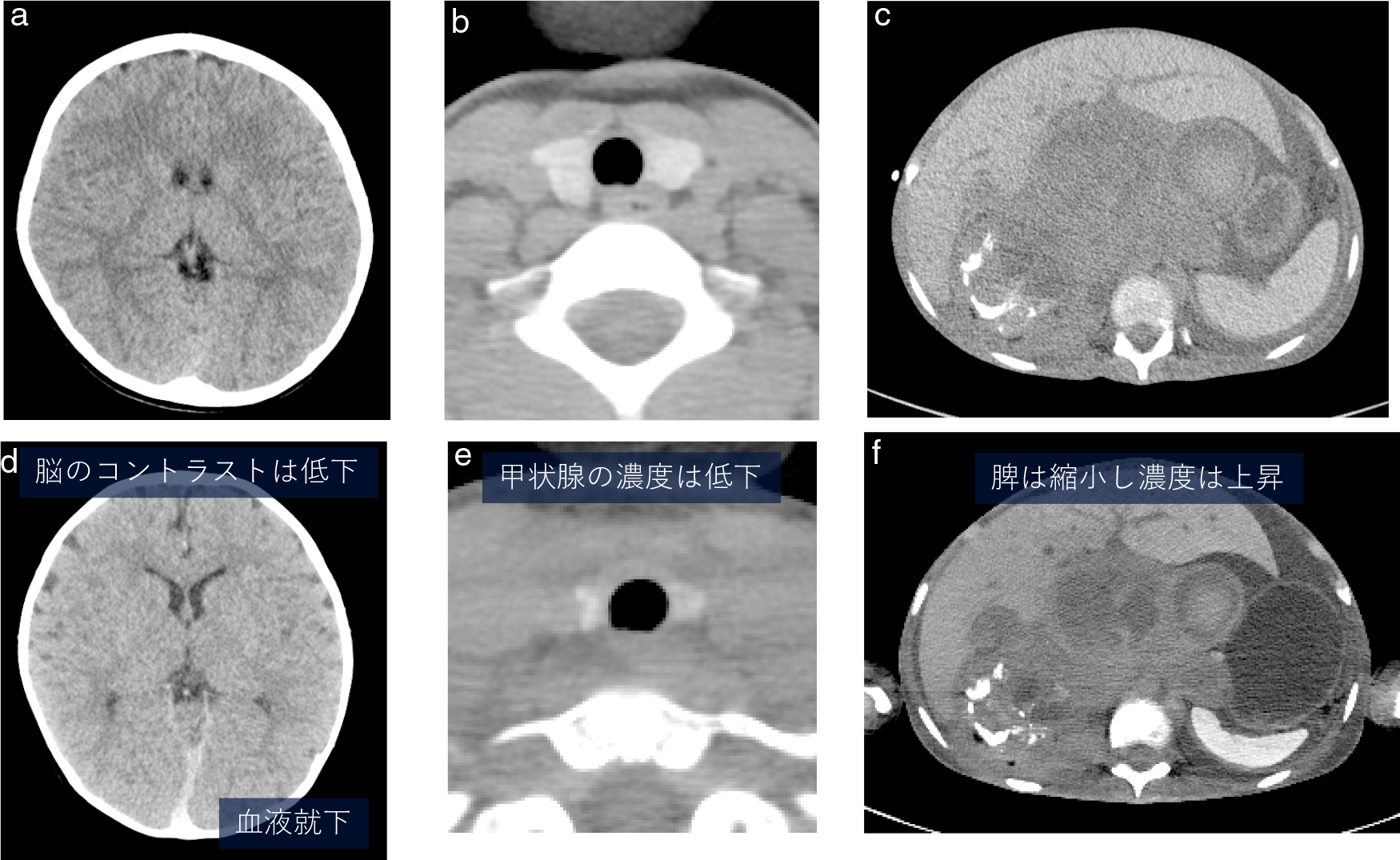
死亡による各臓器の描出の変化
同一人の生前のCT(a, b, c)と死後CT(d, e, f).
死後変化は不可的な呼吸・循環の停止によるもので,さらに死亡直後からの早期死体現象と,死後数日からの腐敗,自己融解等の進行による晩期死後変化に分かれる.死亡時画像診断が救急医療の延長線上で行われる場合は,早期死体現象に遭遇することになる.
循環器系の変化早期死体現象は循環器系に顕著に見られる.心臓は収縮期に心停止し死後硬直が進行して左室壁は増大,心収縮による血圧が消失して,心・大血管内圧は7 mmHg程度の平均充満圧に従うようになるため右心系は拡張することになる12).心臓は全体として拡張,心胸郭比も増大する.大動脈は細径化し血管壁も収縮して高吸収化する12)(Fig. 3).
急速な転帰をたどった急性死の場合,線溶系の亢進により循環停止後も血液流動性が高く保たれ,心腔内などに血液就下による液面形成が生じる.
中枢神経系の変化死後CTでは循環停止により重力分布に沿って血液分布の背側への偏りが起こり,硬膜静脈洞や硬膜そのものの高吸収化を生じる.乳児では硬膜内静脈叢が発達しており硬膜の高吸収化がとくに目立つため硬膜下出血との鑑別にあたって重要となる12,13).
脳実質の描出の変化は生前の異常の有無を判断する上で重要であるが,死因を形成するような生前のものか,死戦期・死後変化なのかについての判断は確実ではない12).CTでは灰白質は細胞性浮腫の発生により濃度が下がり,白質は脳圧亢進による組織の圧縮や血流うっ滞による白質濃度の上昇により皮髄コントラストの低下が起こる14)が,循環停止後の変化であれば,脳溝・脳槽・脳室の著しい狭小化をもたらすような脳腫脹は発生しないとされる15).
呼吸器系の変化死後CTでは血液就下による背側肺の高吸収化が生じる16).水平面形成を伴った濃度上昇域であることから生前の肺炎などの異常と区別される.また死後に肺間質から肺胞や気道内に液体が移行し,気管内の含気が失われることがある12).胸水貯留や肺の浸潤影が存在するときに見られやすい所見である.誤嚥との鑑別が問題となる可能性が考えられる.
小児の死後変化の特殊性頭蓋骨の縫合での変形が容易な新生児や胎児では,検査台にのせただけで大きな頭蓋変形を来す.この様な機械的な大きな変形は固定が発達していない腹部臓器,眼球などでも生じ,小児の死亡時画像診断を行う上で注意点となる17,18).
また呼吸が確立し,一定期間経過した後の死亡であっても,小児の死後画像では肺の含気がCTでは全く描出されなくなることが経験され,生前の肺炎などの異常の診断を困難にすることが知られている19).
加えて新生児の女児で母胎ホルモンの影響で乳腺や子宮が肥大していることなど,生体の小児画像診断でも注意点となる所見にも留意が必要である.
自家融解・腐敗自家融解は死亡後に自己酵素により組織が消化される現象で,臓器の輪郭の不明瞭化や体積の変化をもたらす.膵,副腎の自家融解が起こりやすく,胃粘膜も死後自己消化され消化管穿孔を来す場合もある20).
腐敗は腐敗菌による組織分解により生じ,血管内・組織内にガスを生じることにより画像上顕在化する.基本的には死後長時間を経過してからの晩期死体現象である.
2. 蘇生術後変化蘇生時に行われる胸骨圧迫,人工換気,急速輸液などの処置により,血管・臓器内ガス,消化管拡張,肋骨骨折,心嚢内血腫などのアーチファクトが生じる.
血管内・臓器内ガス死後画像での血管内ガスの起源は,三つ考えられている.胸骨圧迫の際の心腔の拡張によって死戦期に濃度上昇していた溶存二酸化炭素が気化するもの,人工換気や胸骨圧迫による気管支血管癆の形成,そして輸液から流入する血管内ガスである21).
生成された場所,心腔内・大血管の短絡路や胸骨圧迫による逆行性の移行で,動静脈双方に分布が生じ得る.
消化管拡張蘇生時の人工換気で消化管の著しい拡張が生じ得る.ときに腸管気腫から門脈内へとガスの侵入経路ともなる.
肋骨骨折肋骨骨折の存在は身体的虐待の可能性を示唆する重要な所見である22).生体における検査と同様に,死後CTは死後の単純X線撮影に比べて肋骨骨折を検出する感度は高い.肋骨骨折を1本でも指摘できる感度は(死後CT 81.5%[75.8–86.0]vs死後単純X線撮影64.7%[57.3–71.4]),骨折していた肋骨を正しく診断できる感度は(62.4% [95% CI 44.9–77.1] vs 23.1% [12.9–37.8])であり,読影する放射線科医の確信度も上昇する22).
蘇生時の胸骨圧迫によって生じる肋骨骨折の存在は,死亡時画像診断で注意を要する点である.胸骨圧迫により生じる肋骨骨折は前方の座屈骨折(buckled fracture)であり,虐待による肋骨骨折の特徴が後方骨折で,すでに骨膜反応・骨膜反応を生じた陳旧性骨折が存在すれば,それが大きな鑑別の根拠となる23).
硬膜下出血の死後変化硬膜下血腫は虐待による頭部外傷の代表的な損傷である.その死後変化について理解をしておく必要がある.循環の停止によって,硬膜下出血の量が減少することが成人例で報告されている.生前の最後のCTと比較して,死後CTでは硬膜下血腫の体積が減少し24,25),正中線偏位は軽減24,25),血腫のCT値は増大する25).
心嚢内血腫と腹部臓器損傷胸骨圧迫は心嚢内血腫を来しうる.心筋梗塞による生前の心筋破裂との鑑別点として心外膜側に高吸収の層状構造を認めれば出血時に心拍が持続していたことを示唆し,心腔内に液面形成が認められれば死後に生じた血液漏出であるという報告がある.心嚢内血腫の他に肝損傷など腹部の臓器損傷も蘇生後変化として生じ得る12).
小児の死亡時画像診断は,死因や先天的な解剖学的異常についてどの程度の診断能を有しているのか.対象と検査法を限定したケースシリーズ研究の他に,比較的症例数の多い前方視研究,さらにメタアナリシスによる報告も存在する.
解剖との一致度を参照基準とした場合,単純X線写真,死後CT,死後超音波検査,死後MRなどの各種診断手法はどの程度の診断精度を示すか.また死後MRは臓器や病態によりどのような診断精度の変動を示すかを見る.
1. 新生児での単純X線撮影小児期の死亡例について,ルーチンに全例死亡時画像診断を行った場合の有効性についての報告21)は,新生児・乳児期の単一施設の死亡例全員に死後単純X線撮影を実施し,骨異形成,骨折,他の骨の異常の診断と評価を目的として行われた1,027例の研究報告が存在する.結果は異常所見の発見率12.3%で,33の偶発所見,19の意味ある所見,20の診断的所見,2例の偽陽性所見を見出したが,ルーチンに検査をしなければ発見不可能な所見は739例中2例のみ(0.27%)であり,費用対効果を考慮すると全例実施は効率が悪く,合理的な死亡時画像診断実施の選択基準を設けるべきであると結論づけられている21).ただしこの研究では検査方法が単純X線撮影であり,対象とする疾患が骨異形成,骨折,他の骨の異常と有病率がかなり低い疾患に限定して対象としているものであり,発見率の低さは検査の感度や特異性をただちに表すものではないことに留意しておくべきである.
2.死後CTと死後MRの比較(Fig. 5)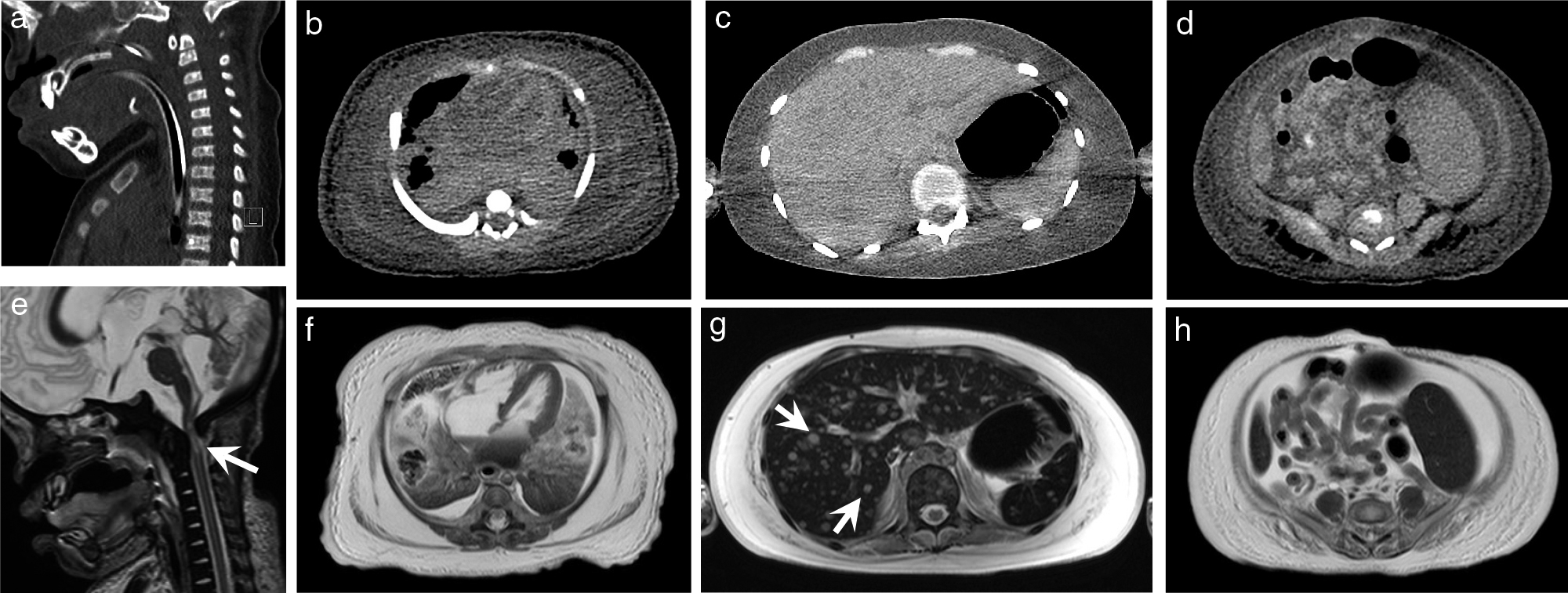
死後CTと死後MRI(T2強調像)の描出の比較
軟骨無形成症の大後頭孔レベル(a, e),別症例の心臓レベル(b, f),肝臓レベル(c, g),腸管のレベル(d, h)で死後CTと死後MRIの描出を比較.
大後頭孔では,CTでは脊髄の状態は不明(a)であるが,MRIでは脊髄が圧迫により信号変化を来しているのが明瞭である(e→).心臓もCTでは心筋と内腔の弁別が困難な場合があるが,MRIでは明瞭である.また胸水と肺の区別のより容易である.
肝臓ではMRIでは多数の肝の転移性腫瘍が描出されている(g)が,CTでの指摘は困難である(c).
腸管相互の区別のMRIの方が容易に見える(d, h).
死後MRIでは,動きや流れなど生体で画質劣化の原因となる要因が見られないため,優れた組織コントラストの優位性が強く現れる.
解剖,死後CT,死後MRによる死因に関連する主要な病理学的異常と5つの身体器官系におけるすべての診断所見の診断能を,82例(胎児53例,小児29例)で比較検討した報告26)では,死後MRは55例中24例,43.64%(31.37–56.73%)で正確な診断を与えており,死後CTの55例中18例,32.73%(21.81–45.90%)に比べて優れていた.死後CTはとくに24週未満の胎児において28.6%(8.1–46.4%)と診断能が低かった26).
3. 死後超音波の有用性の検討生体では主要な小児の画像診断方法となっている超音波検査は,死亡時画像診断での有用性も期待されており,胎児の先天異常の描出における死後超音波検査と解剖を75例で比較した結果では,脳の異常の検出に関しては感度81.5%(63.3–91.8%),特異度97.9%(89.1–99.6%)であり,特に24週以前の胎児の場合,感度,特異度とも100%であった.肺,心臓,腹部,尿路の異常は感度は18.2%から100%と大きな変動を示すが,特異度は一致して100%と報告されている27).
4. 胎児・小児期死亡の死後MR胎児・小児期死亡に対する死亡時画像診断の系統的評価が最も進んでいるのは英国を中心とした欧州における一連の死後MRの研究である28,29).
死後MRの正確性,受容性,費用対効果を見定めるためのシステマチックレビュー29)では,539論文から対象基準を満たした9研究の患者を抽出,胎児146例,小児11例を成人24例と比較して検討している29).死後 MRによる死因または臨床上もっとも重要な所見を検出する感度と特異性は,胎児ではそれぞれ69%と95%,小児では28%と64%,成人では28% と64%であり,胎児では比較的高い感度と特異性が認められたものの,出生後の小児や成人では高くなかった29).
このシステマチックレビューの結果より,死後MRについて従来公刊されているデータは,少数,多様であり,スタディデザインに限界が多く,承諾率と経済性のデータは不十分だったことが示された.この結果,死後MRの価値をより厳密に評価し,最小限の侵襲による限定的な解剖と併せて従来の解剖を代替しうるかを検討する,次の大規模前方視研究が行われた28).
5. 死後MRによる大規模前方視研究の成績ロンドンの2つのセンターで4年半の期間に対象を限定せず,24週以前,24週超の胎児,16歳未満の小児に,全身の死後MRを実施し,死後MRに加えて臨床経過,生前と死後の検体検査,他の画像検査などを合わせて判断した場合,死亡と関連する主要な病的所見の描出が通常解剖とどの程度一致するかを評価している28).
胎児が277例,小児123例の合計400例が対象となり,357例(89.3%, 95% CI 85.8–91.9)で死後MRが通常解剖と一致した.年齢別に見ると24週以下の胎児は175/185例(94.6%, 90.3–97.0),24週超では88/92例(95.7%, 89.3–98.3),新生児は34/42例(81.0%, 66.7–90.0),生後1か月超の乳児45/53例(84.9%, 72.9–92.1),1歳~16歳では15/28例(53.6%, 35.8–70.5)と,低年齢ほど良好な一致率が得られている28).
165例(41%)では,従来法の解剖は不要と判定されたが実際には解剖が行われ,死後MRと従来法の解剖との一致率は99.4%と高かった28).
死後MRは臨床経過や検査値などと合わせて判断すると,年長児では正確さが低下するものの,胎児,新生児,乳児の死因と主要な病的所見の描出においては従来法の解剖に匹敵し,また家族からの承諾が得られやすく,症例を選択すれば従来法の解剖の代替手段となりうると結論づけられている28).
6.死後MRの臓器別の診断精度(Fig. 6)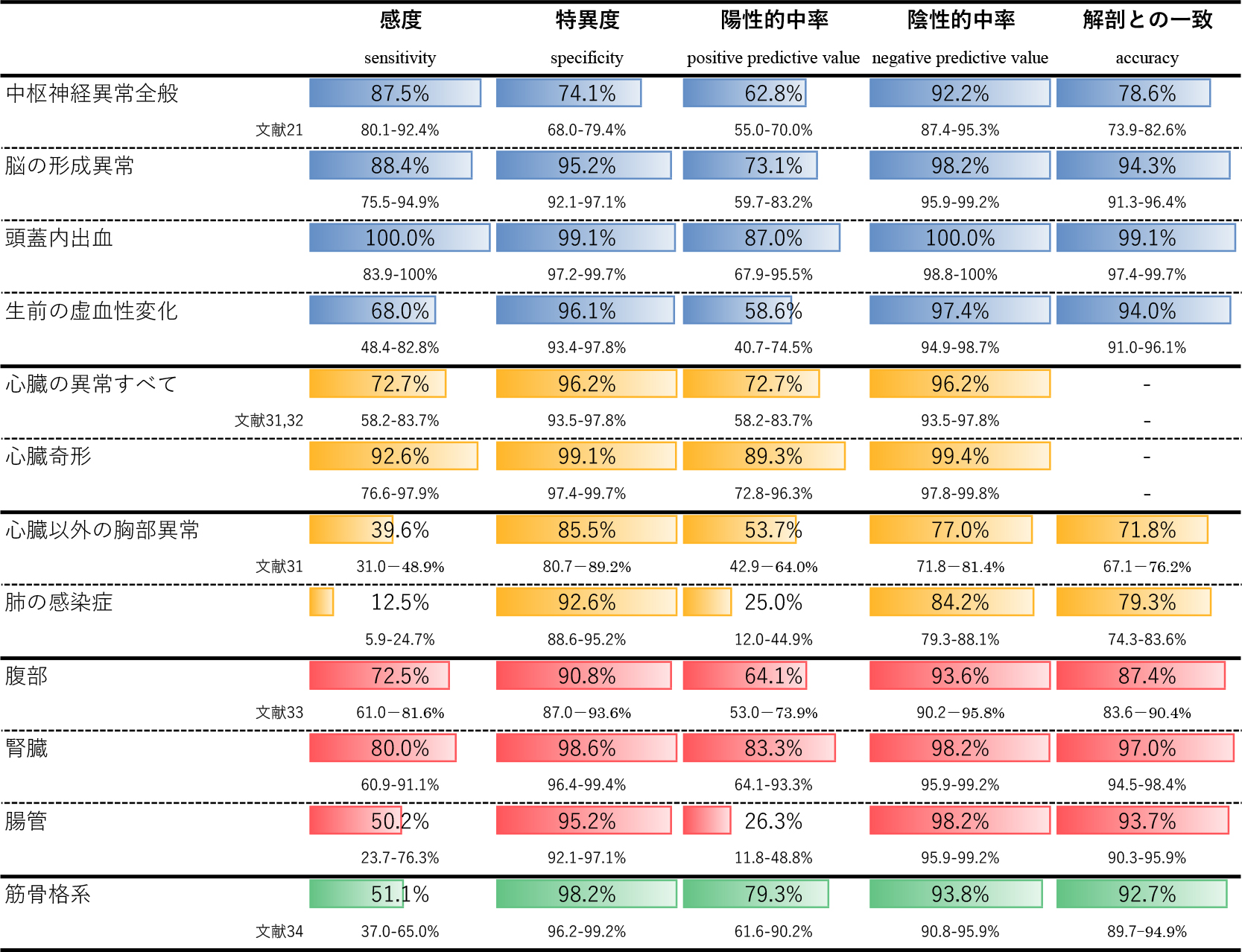
死後CTと死後MRの診断精度の比較
この研究の400例の対象はMagnetic Resonance Imaging Autopsy Study (MaRIAS) Collaborative Groupにより,臓器別に診断精度を従来法の解剖との一致度を参照基準として,臓器別・疾患別に診断精度を報告されている.その結果をFig. 6に示す30–34).
中枢神経は形成異常,出血とも高い診断精度を示すが,生前の虚血性変化の感度は68.0%(48.4–82.8%)で検出されたに過ぎなかった30).
胸部では,心臓奇形の診断精度は非常に高かったが(Fig. 6)30),肺の異常に関する感度は39.6%と低く,肺の感染症に関しては12.5%と非常に低い感度しか示していない(Fig. 6)31,32).しかしながら肺の異常の特異度や陰性的中率は100%に近い高さであり,異常所見のない肺の死後MRは,解剖時の重要な胸部病変の大部分を除外できる点で有用性が認められた(Fig. 6)31).
腹部では腸管の異常に対する感度が50%と低いが,特異度や陰性的中率は90%を超えており,全体の解剖との一致度も87.4%(83.6–90.4%)であり,死後MRは腹部の解剖学的異常を検出するための解剖の有用な代替または補助検査であると結論づけられている(Fig. 6)33).
筋骨格系の異常に対する死後MRの感度は51.1%(37.0–65.0%)と低いが,特異度や陰性的中率は98.2%(96.2–99.2%)と93.8%(90.8, 95.9%)と高く,やはり陰性であったときに異常を除外できる可能性が高い,また通常の解剖では検査されない部位の異常が死後MRで検出される場合が存在し,死因に直接関連しない場合でも臨床的に有用な異常が指摘される可能性がある34).
7. 特定の病態に対する診断能診断の生命維持が困難となるような中枢神経の異常,心大血管の重篤な奇形などについての診断能については,前項のMaRIAS Collaborative Groupによる報告を参考にできる.生前のCTやMRIで診断がつくような形態的異常は,死亡時画像診断でも診断がつけられることが見込まれる.
一方,就寝時の保護者の覆い被さり等による窒息死や,乳幼児突然死が引き起こされることが知られている先天代謝異常症(脂肪酸代謝異常症,ミトコンドリア呼吸鎖異常症など)などの疾患について死亡時画像診断の診断能を系統的に検討した研究は存在しない.カルニチンパルミトイルトランスフェラーゼII異常症で突然死を示した例の死後CTで脂肪肝を認めた報告35)など,診断の端緒になり得たとの報告が散見されるものの,生体の画像診断の知識を準用して推測するに,有用性は限定的なものに留まらざるをえないと思われる.
中枢神経のびまん性軸索損傷は虐待による頭部損傷の診断に関与する可能性が高い病変である.CTでの検出には限界がある事は広く知られており,診断にはMRIが利用される.死後MRIでも死後CTや解剖の肉眼的検査で発見できなかったびまん性軸索損傷を指摘し得たとの報告があり,生体と同様に有用性が期待できるのではないかと思われる36).
小児の死亡時画像診断は,死亡状況調査や解剖の相補的な検査として,死因の究明,最終的な病態の評価,医療行為の妥当性の評価,そして身体的な虐待や不適切養育の有無を検索する手段としての有用性が期待できる.しかしながら具体的にどの様な対象について,どの様な状態の解明を期待し,その目的を実現できるようなモダリティを用いて制度として実装していくか,という議論は深められていないように思われる.また死亡時画像診断を実施するにあたっての同意取得などの手続き,検査費用,読影,得られた情報の活用など,体制は未整備な部分が多い.
これら,わが国の現状の死亡時画像診断の実施状況を考えると,院外での予測不能乳児突然死例に対して,外傷性変化が死因に関与していないかをCTで検討すること,という目標が現実的かつ有用性が期待できる方策ではないかと考えられる.成育基本法の成立によってあらためて注目を集めている,小児の死亡例の登録・検証・予防策の立案のためのチャイルドデスレビューの一環として体制が整備していくべきである.