2024 年 144 巻 1 号 p. 61-69
2024 年 144 巻 1 号 p. 61-69
Liposomes have been reported to be useful nanocarrier, however, there are number of challenges to resolve before they can be optimized for drug delivery. Liposomes are taken up by cell in the reticuloendothelial system (RES). Polyethyleneglycol (PEG) modification on the liposomal membrane forms a fixed aqueous layer and thus prevents uptake by the RES. The physicochemical properties of liposomes that are most commonly evaluated particle size and zeta potential are not sufficient indicator of the passive targeting effect by PEG modification. In contrast, the fixed aqueous layer thickness (FALT) around liposomal surface was clear to be regulated to be the utilized action in the body. It was showed that the FALT value of PEG-modified liposomes containing doxorubicin increased with the increase in the molecular weight of PEG. Furthermore, PEG modification with a combination of high- and low- molecular weight PEGs on liposomal membranes showed in optimal results with respect to FALT and a higher antitumor effect. In addition, we designed and synthesized a novel PEG-lipid, different double arms PEG (DDA-PEG), which consisted of two PEG chains of 500 and 2000 in one molecule to develop more useful PEG-modified liposomes. DDA-PEG was found to have superior antitumor activity and was associated with the prevention of tumor metastasis. Furthermore, we sought to (−)-epigallocatechin-3-O-gallate (EGCG) functions as a target ligand of the 67-kDa laminin receptor (67LR), which is expressed on high-grade tumor cells. EGCG-PEG-modified liposome appear to have superior antitumor activity against high 67LR-expressing tumor cells, as the liposomes had dual effects.
薬学部が6年制に移行後,モデルコアカリキュラムが制定され,物理薬剤学,製剤学は製剤化のサイエンスという分類に含まれることとなった.この中で重要な位置を占めるものにdrug delivery system(DDS)がある.かつて製剤学は医薬品製造において開発の最終段階に関連する剤形が主であった.しかしながら,この数十年でくすりの効果を持続(controlled release)させたり,標的部位に薬物を集積(targeting)させるDDSの考え方が研究・教育においても重要な位置を占めている.1)この中で脂質集合体であるlipid nanoparticle(LNP)やリポソームの基礎研究が展開され,医薬品として利用されるようになってきた.この3年ほどの世界的なコロナ大流行において,ワクチン接種が大きな役割を果たしてきたが,コロナウイルス修飾ウリジンRNAワクチン(SARS-CoV-2)2)はLNP製剤である.mRNAはマイナスにチャージしており,マイナスにチャージしている細胞膜を透過することができない.そこでLNP製剤とすることにより,生体内での安定性と細胞膜透過性を付与し,ワクチンとしての機能を発揮できるようにした.このように,現在では身近な製剤に様々なDDS技術が応用されている.
リポソーム製剤も,制がん剤であるドキソルビシン塩酸塩(doxorubicin hydrochloride: DOX)を内封するドキシル,3)イリノテカンを内封するオニバイド,4)抗真菌剤であるアムホテリシンBを内封するアムビゾーム5)などが上市されている.薬物キャリアとして利用されるリポソームは,受動的ターゲティング(passive targeting)と能動的ターゲティング(active targeting)に大別6)され,現在上市されている製剤のほとんどがpassive targeting製剤である.さらに,近年では,サプリメント,化粧品にもリポソームが利用されてきている.リポソームは百数十nmの微粒子であり,その調製方法には様々なノウハウがある.さらに,調製後のリポソームの生物学的有効性を規定する物理学的なファクターは,医薬品製造におけるバリデーションの観点からの非常に重要である.すなわち,工業生産品である医薬品は,厳密な規格化と保存中の安定性保証が必須であり,薬効を規定する普遍的な工業生産品としてのファクターが必要となる.一般的にこのような微粒子は粒子径と表面電位より特徴付けられるが,これだけではpassive targetingの有効性を規定できない.そこで,本論文では,別の物理化学的ファクターが重要であることを明確にし,その算出方法を明示するとともに,より有効なtargetingを可能とする新たな修飾物質について解説する.
生体膜由来の脂質二分子膜閉鎖小胞であるリポソームは,生体適合性,生分解性に優れ毒性が低いという利点を有するとともに,他の脂質微粒子キャリアと異なり,内水層を有することより,脂溶性薬物だけでなく水溶性薬物も内封可能である.6)また,機能性を有する物質でリポソーム表面を修飾することにより,様々な挙動を付与することが可能となる.リポソームの生体内での機能性を損なう原因は細網内皮系(reticuloendothelial system: RES)組織による異物認識・捕捉であり,リポソーム粒子に補体系の血清タンパクが結合することに起因する.6,8,9) Active targetingにより肝臓や脾臓といったRES組織に薬物を集積させたい場合を除き,active targeting, passive targetingいずれでもこの捕捉を回避する必要がある.両親媒性物質であるpolyethylenglycol(PEG)脂質でリポソーム表面を修飾することにより,PEGポリマーと水分子の相互作用でリポソーム表面に固定水層が形成され,これにより血清中のオプソニン分子のリポソームへの結合を阻害し,RES組織による捕捉を回避,血中滞留性を改善し,enhanced permeability and retention(EPR)効果により腫瘍や炎症部位に内封薬物を集積させ効果を発揮する.6)
リポソームの物理化学的ファクターとしては,粒子径及び表面のゼータ電位が一般的である.粒子径が大きい場合はRES捕捉だけでなく,毛細血管に詰まるなどの弊害が生じるため,重要なファクターであるといえる.また,表面のゼータ電位も細胞膜透過性やリポソーム粒子同士の凝集を防ぎ分散性を保証する点で必須のファクターである.しかしながら,PEG修飾によりリポソーム表面に形成される固定水層のため,同じ構成脂質の未修飾リポソームの電位が−40 mV程度であった場合,−15 mV程度に電位の絶対値が減少する.すなわち,PEG修飾によるEPR効果はゼータ電位からは判断できず,ゼータ電位は,リポソームの体内動態や薬理効果を規定する因子とはなり得ない.そこで,リポソーム膜表面におけるPEGの状態を物理化学的側面から解明することで生物学的有効性を規定する新たなファクターの創出が試みられてきた.10–12)
リポソーム表面を修飾するPEG脂質は,PEG部とリポソーム膜に差し込まれるアンカーと呼ばれるアルキル鎖及びこれをつなぐスペーサーからなる.PEG部の分子量が大きいほど,固定水層を大きくできると推測されるが,水溶性部分が大きくなるとアンカーとのバランスがとれなくなり,リポソーム膜へのPEG修飾量が著しく低下する.13,14)これによりPEG修飾の効果が減少するため,現在では,PEG部の分子量は2000を用いるのが一般的である.PEGは,分子量が小さい場合はオキシエチレン鎖がほぼまっすぐに伸びたブラシ構造をとるが,分子量が大きくなるとPEG鎖同士が丸まったマッシュルーム構造をとる.13)このことを含めて,リポソーム表面のFALTを正確に規格化し,簡便な測定方法により数値化されなくてはならない.
リポソームの表面電位として測定されるゼータ電位は,リポソーム膜を構成する荷電脂質に由来する電位とリポソームが分散している緩衝液との電位差を表しているに過ぎず,用いる緩衝液が異なってくれば同じリポソームであっても測定される電位は変化することとなる.この変化を利用してリポソーム表面に形成されるFALTを算出することができる.すなわち,リポソーム周囲の電位ψはGouy–Chapmannの式から膜表面からの距離xとDebye–Hückel parameterκによって変化する.
 |
 ,C: M for NaCl)
,C: M for NaCl)
ゼータ電位はリポソーム膜上ではなく,すべり面と呼ばれる位置で測定されるのであり,リポソーム粒子が分散している緩衝液の塩濃度を変化させると測定されるゼータ電位は変化する.すなわち,Fig. 17)のPoisson Boltzmann式に基づく電位分布の模式図において,膜表面から距離Lに存在するすべり面における電位ζは,FALTが一定ならば溶液の電解質濃度が上昇するとともに減少する.

この方法に従って,異なる濃度のNaCl水溶液中に分散させたリポソーム懸濁液中でゼータ電位を測定し,κ(1/nm)に対してln|ψ(L)|をプロットすれば,得られた直線の傾きLはすべり面の位置となり,直線の傾きの絶対値からFALTを決定することができる.リポソーム膜表面のPEG修飾により,膜近傍に存在する水分子がオプソニンの吸着を防ぎ血中滞留性をもたらす訳であり,FALTの変化は生体内挙動を反映することができると考えられる.
同一組成の構成脂質よりなるリポソームを異なった分子量のPEG-distearoylglycerol(PEG-DSG)で修飾した際のFALTの変化をTable 1に示す.15)
| Particle size | FALT (nm) | |
|---|---|---|
| Plain Liposome | 128.3±2.7 | 0.34±0.05 |
| PEG500 | 121.3±2.0 | 1.00±0.01 |
| PEG900 | 135.6±7.4 | 2.10±0.02 |
| PEG2000 | 134.1±3.8 | 2.52±0.03 |
| PEG(2000 : 500) | ||
| 1 : 2 | 140.1±1.4 | 2.26±0.04 |
| 1 : 1 | 139.1±2.1 | 2.95±0.03 |
| 2 : 1 | 142.7±5.1 | 3.30±0.26 |
| 4 : 1 | 137.9±0.2 | 2.53±0.23 |
Particle sizes and FALTs represent the mean±S.D. (n≧3)
未修飾リポソームにおいてもFALTは存在し,その値は0.34 nmを示した.これに対し,PEG修飾することによりFALTは増大し,PEG分子量が500では1.00 nm, 900では2.10 nmと分子量に比例して増大した.一方,2000では2.52 nmと900に比べ分子量が倍増したにもかかわらずFALTの変化はわずかであった.PEG分子はその存在状態によりブラシ構造とマッシュルーム構造をとり,PEG500のオキシエチレン鎖の結合角と結合の長さから理論上のFALTを算出すると完全にブラシ構造をとった場合は4.18 nm,完全にマッシュルーム構造をとった場合は0.73 nmとなる.一方,PEG2000においては,完全にブラシ構造をとった場合は16.72 nm,完全にマッシュルーム構造をとった場合は1.45 nmとなり,分子量の大きいPEGほどリポソーム膜上で高度に折りたたまれたマッシュルーム構造をとっていると推測できる.また,PEG500, PEG900で修飾したリポソームは血中滞留性をほとんど示さないことから,有効なpassive targetingをもたらすには,FALTは2.5 nm以上が必要であると考えられる.
PEG脂質のリポソーム膜への導入量が多くなると物理的にマッシュルーム構造はブラシ構造に移行し,FALTを大きくできると推測されるが,両親媒性脂質であるPEG脂質のリポソーム膜への導入量には限界があり,PEG分子量増大はリポソーム膜へのPEG脂質導入量低下を招く.PEGの分子量とリポソーム膜への導入量のバランスという点でPEG2000が最良であり,有効なFALTにより血中滞留性を確保できているといえる.そこで次に,更に有効性の高いPEG修飾を模索するためにこれまで有効性がないとされてきた短鎖PEGをPEG2000と混合してリポソーム修飾し,FALTへの影響を検討した.リポソーム膜への導入量,リポソーム膜上での安定性を考慮して組み合わせるPEG脂質の特性が異なっていることが重要であると考えられるので,オクタノール/水分配係数が異なっているPEG500をPEG2000と様々な比率で混合し,リポソーム修飾した.
Table 1に示すように,PEG2000 : PEG500の混合比率が2 : 1になるまではPEG2000の添加量に比例してFALTは増大し,その値は2 : 1で3.30 nmを示した.一方.それ以上の混合比率のPEG2000では,単独修飾より高値を示すものの2 : 1に比べ低下が認められた.すなわち,長鎖PEGと短鎖PEGによる混合修飾は,単独でのPEG修飾に比べFALTが増大し,その混合には最適比が存在することが明らかとなった.これは,マッシュルーム構造をとっている長鎖PEGの隙間に短鎖PEGが入り混み,長鎖PEGのマッシュルーム構造がブラシ構造に近づいたためであると考えられる(Fig. 2).短鎖PEGの比率が大きい場合は,リポソーム膜上では短鎖PEGの占める割合が多く,そのFALTは短鎖PEG単独修飾と長鎖PEG単独修飾の間をとることとなる.一方,短鎖PEGの割合が小さすぎると長鎖PEGのマッシュルーム構造に及ぼす影響は限定的となり,そのFALTは長鎖PEG単独修飾と類似の値をとると考えられる.以上より,FALTの観点からPEGの混合修飾には最も適した比率が存在すると言える.なお,最大のFALTを示したPEG2000 : PEG500(2 : 1)において,実際のPEG導入率は,PEG2000が54%,PEG500が100%であり,PEG2000 : PEG500(2 : 1)の混合修飾の実際の修飾比は1 : 1であることが明らかになっている.
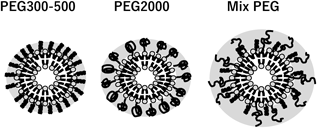
以上より,特性の異なった複数の分子量を有するPEG脂質を用いてリポソーム膜を修飾することにより,各々が単独では取り得なかった高いFALTが得られることが示された.
なお,このような混合修飾はPEG脂質の分子量での混合だけでなく,PEG脂質のアンカーでの混合も試みており,アルキルアンカーとコレステロールアンカー混合の有用性も明らかにしている.17)
単独PEG脂質でのリポソーム修飾において,生物学的有効性とFALTに相関があることは示してきたが,混合修飾において同様のことがいえるのかを確認するために,抗腫瘍剤DOXを含有させたPEG2000 : PEG500(2 : 1)修飾リポソームの抗腫瘍効果を腫瘍重量及び腫瘍中のDOX濃度を指標に各々のPEG単独修飾リポソームと比較した.
Figure 316)に示すように,未修飾リポソーム(plain liposomal DOX: PLDOX),PEG500修飾リポソーム[PEG(500)−LDOX]はコントロール群と腫瘍重量に差はなかった一方,PEG2000修飾リポソーム[PEG(2000)−LDOX],PEG2000 : PEG500(2 : 1)修飾リポソーム[PEG(2000 : 500=2 : 1)−LDOX]は腫瘍重量を減少させた.さらに,腫瘍中DOX濃度はPEG(2000 : 500=2 : 1)−LDOX>PEG(2000)−LDOX>PEG(500)−LDOX>PLDOXの順であり,FALTの結果と相関するものであった.したがって,PEG単独修飾の場合と同様に短鎖PEGと長鎖PEGによる混合修飾においてもFALTはその生物学的有効性を保証する物理化学的因子であることが明らかとなった.

Ehrlich ascites carcinoma cells (5×105 cells/animal) were transplanted onto the backs of mice, and then liposomal DOX was injected at a dose of 2.5 mg/kg at 14, 17 and 20 d after tumor inoculation. The mice were sacrificed by cervical dislocation on the 23rd after inoculation. Each column represents the mean±S.D. (n=4–6). Significant differences from the level of the PLDOX group are indicated by a)p<0.01 and b)p<0.001.
PEG2000とPEG500で混合修飾したリポソームの有効性を損なう原因のひとつにリポソーム膜上でのPEG脂質の修飾安定性がある.これまで述べてきたように,PEG部の分子量が大きくなると水溶性が増大し,リポソーム膜から抜け易くなる.PEG2000 : PEG500(2 : 1)混合修飾においても,PEG2000がリポソーム膜から早く脱離することが観察された.すなわち,この混合修飾は生体内において時間経過とともにPEG500単独修飾に近づくこととなる.
そこで,この混合修飾の有用性から新たなPEG脂質を考案した.Fig. 418)に示すように,1分子中にPEG500とPEG2000のふたつの異なった分子量のPEG鎖を有するPEG脂質(1,2-distearoyl-sn-glycero-3-phosphoethanolamine-PEG)を合成し,different double arms PEG(DDA-PEG)と名づけた.DDA-PEG修飾リポソームのFALTは3.57 nmを示し,PEG2000 : PEG500(2 : 1)混合修飾をしのぐものであり,通常添加量の半量のPEG脂質修飾でも同等のFALT値を示した.18)
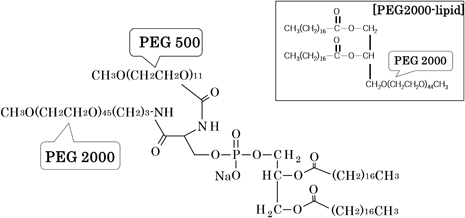
DDA-PEGで修飾したリポソームにDOXを含有させ,腫瘍細胞移行性や抗腫瘍効果を検討した.In vitroにおいて,マウスM5076 ovarian sarcoma cell懸濁液への各リポソームを添加後のDOXの移行性をFig. 519)に示す.
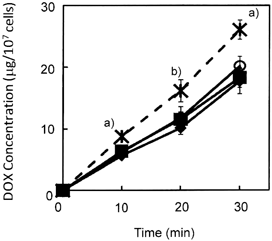
M5076 ovarian sarcoma cells were incubated at 37°C for 30 min with 10 µg DOX /mL of liposomes. Each point represents the mean± S.D. (n=4). Significant differences from the level of mix PEG2000 modified liposome are indicated by a)p<0.001 and b)p<0.01. ◆: PEG2000L, ■: mix PEGL, ○: DDAL. ×: DDAL/2
腫瘍細胞中のDOX濃度は,PEG2000単独修飾(PEG2000L),PEG2000 : PEG500混合修飾(mix PEGL),DDA-PEG修飾(DDAL)の各リポソームにおいて類似の経時変化を示したが,DDA-PEGの添加量を半量にしたDDAL/2添加群において,他の群に比べ有意な移行性の増大を認めた.リポソーム膜に修飾されたPEGにより形成される固定水層は腫瘍細胞との接触を妨げる可能性が指摘されているが,より少ないPEG添加量で有効なFALTを形成されたDDAL/2は,リポソーム膜上でのPEGの揺らぎが可能となり,有効に細胞とコンタクトがとれるようになったと考えられる.この現象はマウスP388 leukemia cellにおいても認められており,この際の殺細胞効果は,細胞移行性を反映するものであった.
通常の1分子中にひとつのPEG鎖を有するPEG修飾リポソームに比べ,FALT及び腫瘍細胞移行性,殺細胞効果において有効性を示したDOX含有DDA-PEG修飾リポソームのin vivoでの腫瘍集積性,抗腫瘍効果をマウスM5076 ovarian sarcoma cellを背部皮下に移植し固形腫瘍を形成させた担がんマウスにおいて検討した.血漿中及び腫瘍中のDOX濃度をFig. 6に示す.

Significant difference from the level of mix PEG modified liposome is indicated by a)p<0.01.
DOX水溶液(DOX solution: DOXsol)投与群では,投与2時間後血漿中でDOXを検出することはできなかったが,混合修飾リポソーム(MIX-LDOX)及びDDA-PEG修飾リポソーム(DDA-LDOX)投与群で高値を示した.腫瘍中においてもMIX-LDOX及びDDA-LDOX投与群において高値であり,投与8時間後においてDDA-LDOXに比べMIX-LDOXにおいて高い値を示す傾向が認められたが,24時間後ではDDA-LDOXのほうが有意に高いDOX濃度であった.すなわち,MIX-LDOXでは,8時間後から24時間後にかけて腫瘍中DOX濃度は低下したが,DDA-LDOXではDOXが腫瘍中で高濃度に維持されていることが示された.なお,腫瘍サイズより判断してDDA-LDOXが最も優れた抗腫瘍効果を有していた.
がん治療において,転移は予後を悪化させる最大の要因である.抗腫瘍剤による化学療法だけでなく,外科的切除においてもがん転移は問題であり,切除時には見つけられなかった転移巣が予後を悪化させることは明らかである.上述のマウスM5076 ovarian sarcomaは,原発巣が卵巣の腫瘍であるが,肝転移を起こす.そこで,次に肝転移に対する効果を検討した.なお,混合修飾では投与後にリポソーム膜上でのPEG2000とPEG500の比率が変化し,この変動が効果を左右することが懸念される.医薬品としての安定性を考慮すると,単独PEG脂質により有効な効果が得られることが重要であると考えられる.したがって,PEG2000単独修飾(PEG2000-LDOX)とDDA-PEG修飾リポソーム(DDA-LDOX)での腫瘍の肝転移に対する効果を比較した.
肝転移の効果をみることを目的としているので,原発巣での効果による影響を除くためM5076 ovarian sarcoma cellを静脈内投与し,肝臓への転移が認められた移植6日後より各リポソームを3回(6, 9, 12日後)静脈内投与した.肝転移スコア及び肝臓重量をTable 2に示す.20)
| Score | Liver weight (g) | |
|---|---|---|
| Control | 5.0±0.0 | 2.96±0.4 |
| DOXsol | 4.5±0.4 | 2.96±0.4 |
| PEG2000-LDOX | 1.3±0.5a) | 1.46±0.1a) |
| DDA-LDOX | 1.3±0.5a) | 1.42±0.2a) |
Data represents the mean±S.D. (n=5–7). Significant difference from the level of control is indicated by a)p<0.001.
肝臓に占める転移巣の割合を未処置のコントロール群を5としてスコア化したところ,DOXsolでは同等のレベルを示したが,PEG2000-LDOX, DDA-LDOXでは,その値は1/4程度に減少した.また,肝臓重量は転移腫瘍により肥大し,コントロール群の値は正常肝臓の1.7倍であった.DOXsolではこの重量を減少させることはほとんどできなかったが,PEG2000-LDOX, DDA-LDOXでは約50%にまでその値を低下させた.以上より,PEG修飾によりマウスM5076 ovarian sarcomaの肝転移を抑制できることは明らかであり,がん治療の予後を改善できることが示されたが,DDA-PEGの優位性は認められなかった.なお,正常肝臓と分けて肝転移部のDOX濃度を測定したところ,転移スコア,肝臓重量を反映する結果であった.
上記結果は,各リポソーム投与最終投与48時間後に摘出した肝臓で得られたものである.次に,同様の投与スケジュールで得られた移植後60日間の延命効果をFig. 720)に示す.

M5076 ovarian sarcoma cells (5×105 cells/animal) intravenously injected into BDF1 mice via the tail vein. On days 6, 9, and 12 after inoculation with M5076 ovarian sarcoma, the mice were administrated each sample. The gray full line, the gray broken line, the black broken line, and the black full line represent the control group, the DOX solution group, the PEG2000-LDOX group, and the DDA-LDOX group, respectively. Data represents the means±S.D. (n=9). Significant difference from the level of control is indicated by a)p<0.001.
コントロール群では移植16日後より生存率が低下し始め,21日後には0%,平均生存日数は18日であったのに対し,DOXsolでは平均生存日数は17日と肝転移による致死に対し延命効果は認められなかった.一方,PEG2000-LDOX群では,20–26日でマウスが死亡したが,DDA-LDOX群の生存率は,PEG2000-LDOX群において0%となった26日後でも66.7%を示していた.この生存率は検討期間の60日後でも維持されており,肉眼では60日後の肝臓に転移巣は認められなかった.すなわち,PEG2000-LDOX群とDDA-LDOX群では,投与48時間後の転移スコア等ではその差が認められなかった.一方,Fig. 6で示されたようにその後の転移腫瘍でのDOX濃度維持においてDDA-PEG修飾が優れており,その効果が長期にわたって継続されることによって顕著な延命効果として現れたと推測できる.
以上より,DDA-PEG脂質はリポソーム修飾において,単独PEG修飾より有効なFALTを保持するとともに,高い細胞親和性と抗腫瘍効果,転移抑制効果を有する画期的な修飾物質であることが明らかとなった.
これまで示してきたPEG修飾リポソームはpassive targetingにより標的組織での集積を果たすキャリアであるが,次に新たなactive targeting型リポソームの開発を試みた.
Epiagallocatechin-3-O-gallate(EGCG)は,緑茶の苦み成分として知られているポリフェノールであり,抗酸化作用や抗腫瘍作用を有する.21) EGCGは悪性度の高い腫瘍細胞膜に発現している67 kDa laminin receptor(67LR)に結合することによりアポトースを誘導する.22)これによりEGCGが抗腫瘍効果を示すこととなるが,in vitroでこの効果を発揮する濃度のEGCGをin vivoで維持することは難しく,この濃度では肝障害を発症する危険性もある.23)そこで,リポソーム膜にEGCGを修飾しアポトーシス誘導を図るとともにリポソーム内水層にはDOXを封入することで異なった作用点に基づく抗腫瘍効果の増強を試みた.
リポソーム膜表面へのEGCG修飾ではリポソームの脂質二分子膜に挿入されるアルキル鎖が必要であることより,alkyl-EGCGを合成,in vitroで殺細胞効果を検討したところ,PEG修飾リポソームに比べ強い効果を示した.しかしながら,PEG修飾をしていないリポソームはRES捕捉により血中滞留がはかれないことは明らかである.一方,PEG鎖に比べEGCGの方が分子量が小さいことは明らかであり,alkyl-EGCGでは,PEG鎖の外にEGCGを露出させ細胞と接触させるのは不可能である.すなわち,PEG修飾リポソームにEGCGを更に修飾することが必須となる.そこで,PEG2000と反応性を有するEGCG-monoamineを新たに合成し,PEG修飾リポソーム調製後にこのPEG鎖の先にEGCGを結合させた.これにより,血中滞留性を保証するとともに67LRに結合できるEGCG-PEG2000修飾リポソームを作成した.20) DOX含有EGCG-PEG修飾リポソーム(EPL-DOX)の効果をFig. 821)に示す.

C57BL/6 mice were subcutaneously inoculated with B16F10 mouse melanoma cells (5×105 cells/animal). The mice were divided as follows: control, DOX solution (DOXsol), EGCG solution (EGCGsol), PEG2000 modified liposome (PL), PL+EGCGsol (PL+E), and EGCG-PEG2000 modified liposome (EPL). At 8, 11, and 13 d after inoculation, each sample was administered intravenously with 2.5 mg DOX/kg. EGCG solution was also administered intravenously at 11.3 mg/kg, based on the amount of EGCG modification in EPL. Data represents the mean±S.D. (n=6–7). Significant differences from control and DOXsol group were a)p<0.01 and b)p<0.05, respectively. Significant difference from PL+E was c)p<0.01.
67LRの過剰発現が認められたB16F10 mouse melanoma細胞をマウスに移植し,腫瘍重量より抗腫瘍効果を検討したところ,DOXsolにおいて腫瘍重量の減少が認められ,PEG2000修飾リポソーム(PL-DOX)ではその作用は増強していた.一方,PL-DOXにEGCG水溶液を併用したPL-DOX+Eでは,EGCGによる作用増強が認められなかったのに対し,EPL-DOXで更なる作用増強が示され,腫瘍重量はコントロール群の33%にまで低下した.
EGCGによるアポトーシス誘導はcaspase 3の活性化によることが示されていることより,23,24)このときの抗腫瘍効果をアポトーシス誘導の観点から評価した.DOXsol, PL-DOXに対しPL-DOX+Eではcaspase 3の活性は変化しなかったが,EPL-DOXでは有意に上昇していた.すなわち,EGCGはリポソーム膜表面に修飾されたることでより有効に67LRに結合しアポトーシスを誘導することが明らかとなった.
以上より,DOXを内水層に保持するとともに膜表面にEGCGを挿入したEPL-DOXは,異なった作用メカニズムにより抗腫瘍作用を発揮する画期的なキャリアであるといえる.
以上,リポソームの血中滞留性を規定するFALTの測定,PEG混合修飾によるFALTの増大,1分子中に分子量の異なったPEGを有するDDA-PEGの有用性とEGCG-PEGによるdual functional liposomeに関し記述した.リポソーム製剤は,静脈内投与を中心に展開,医薬品として開発されてきたが,近年は経口,経皮などにも応用されるようになってきており,その可能性はますます増大している.それぞれの製剤を物理化学的に規定する重要性は今後も同じであり,多くの有用な製剤が開発されることを期待するとともに本研究がその一助を担ってくれることを願っている.
本研究は,前・静岡県立大学薬学部教授 広田貞雄先生,岩手医科大学薬学部講師 杉山育美先生のご助言,ご支援,ご協力の下で行ったものであり,心より深謝申し上げます.
開示すべき利益相反はない.
本総説は,2022年度退職にあたり在職中の業績を中心に記述されたものである.