2021 年 61 巻 10 号 p. 663-670
2021 年 61 巻 10 号 p. 663-670
自験例は,2歳頃より四肢筋力低下・筋萎縮・関節拘縮が進行した女性で,拘束性換気障害,30代より上室性及び心室性不整脈を合併し,55歳時に気管切開術,人工呼吸器装着,植込み型除細動器植込み術を施行したが,心不全が進行し,59歳で死亡した.血中CK値は正常で,針筋電図検査では,正常波形に混在して高振幅や多相性の運動単位電位を認め,強収縮では干渉は低下していたが動員は比較的保たれていた.典型的なミオパチーの所見が明らかでなく診断に苦慮したが,疾患関連遺伝子エクソーム解析により,LMNA遺伝子にヘテロ接合性ミスセンス変異p.E358Kを認め,ラミノパチーの診断に有用であった.
Laminopathy, caused by mutations in the LMNA gene, include a variety of diseases, such as Emery–Dreifuss muscular dystrophy. A Japanese woman developed progressive muscle weakness, muscle atrophy and joint contractures of upper and lower limbs after the age of two years old. She had restrictive respiratory dysfunction, and developed both supraventricular and ventricular arrhythmias after the fourth decade of life. At 55 years old, she had tracheostomy, required mechanical ventilation and was implanted with the implantable cardioverter defibrillator. The serum level of creatine kinase was within normal range. Electromyography showed polyphasic or large motor unit potentials and reduced interference pattern, while relatively normal recruitment. The exome analysis of disease-related genes revealed a heterozygous pathogenic variant c.1072G>A (p.E358K) in the LMNA gene, which contributed to the diagnosis of laminopathy.
LMNA遺伝子変異によるラミノパチー(laminopathy)では,常染色体優性(autosomal dominant,以下ADと略記)遺伝形式として,Emery–Dreifuss型筋ジストロフィー(Emery–Dreifuss muscular dystrophy,以下EDMDと略記)2,LMNA関連先天性筋ジストロフィー(LMNA-related congenital muscular dystrophy,以下L-CMDと略記),肢帯型筋ジストロフィー(limb-girdle muscular dystrophy,以下LGMDと略記)1B,拡張型心筋症1A等,常染色体劣性(autosomal recessive)遺伝形式として,EDMD3,Charcot–Marie–Tooth病2B1等,多様な病型がみられ1),診断には遺伝学的解析が必要である.我々は,臨床的に典型的な筋原性変化をとらえることが困難であった進行期の筋萎縮性疾患の症例で,疾患関連遺伝子エクソーム解析によりLMNA遺伝子の病的バリアントを同定し,ラミノパチーが考えられた1例を経験したので報告する.
症例:59歳,女性
主訴:四肢筋力低下
家族歴(Fig. 1):両親血族婚なし.母(II-4)は高血圧症があり,54歳時に突然死した.父(II-3)は64歳時に胃癌で死亡.母方祖母(I-4)に胃癌.

Arrow indicate the patient as III-5 at the age of 54 years old. P means proband. The patient’s mother (II-4) died suddenly at the age of 54 years old.
既往歴:34歳,壊疽性虫垂炎で虫垂切除術.子宮筋腫.肛門脱.
現病歴:周産期に問題なし.出生時体重3,600 g.生後17ヵ月に歩行を獲得したが,2歳頃から歩行障害,四肢筋力低下が進行し,3歳頃に歩行困難となった.10歳頃より四肢関節拘縮がみられた.14歳時(1974年),当院小児科外来を受診した.四肢筋力低下・筋萎縮・関節拘縮,四肢深部腱反射消失,腰椎前弯を認め,起立・歩行不能であった.血中CK値は正常であった(Table 1).16歳時(1976年)に右大腿四頭筋より筋生検を施行されるも診断に至らなかった.18歳時の握力は右4 kg,左2 kgであった.肺機能検査(19歳)で混合性換気障害を認めた(Table 1).上肢筋の針筋電図検査(20歳)では,刺入時電位正常で,安静時に線維自発電位,多相性で持続時間が延長した運動単位電位(motor unit potential,以下MUPと略記)(2.8~3.5 mV,13 msec),最大収縮で干渉に移行し難い所見を認めた.21~29歳時,肺炎等の気道感染症や下痢等で入退院を繰り返した.31歳時(1991年),長期療養のため当科に入院した.
| Laboratory data | |||
|---|---|---|---|
| Age (years old) | 14 | 31 | 57 |
| CK (U/l) | 25 | 54 | 109 |
| Aldolase (U/l) | 3.3 | 3.5 | |
| Myoglobin (ng/ml) | 53 | ||
| Analysis of blood gas (room air) | |||
| pH | 7.361 | ||
| pO2 (mmHg) | 79.7 | ||
| pCO2 (mmHg) | 49.5 | ||
| HCO3 (mmol/l) | 27.2 | ||
| SaO2 (%) | 95.3 | ||
| Lung function test | ||
|---|---|---|
| Age (years old) | 19 | 31 |
| VC (L) | 1.28 | 1.32 |
| %VC (%) | 44.2 | 52.5 |
| FEV 1.0% (%) | 68.5 | 86.1 |
| Echocardiography | ||
|---|---|---|
| Age (years old) | 40 | 57 |
| LVEF (%) | 78 | 41.3 |
| LVDd (mm) | 38 | 42 |
| LVDs (mm) | 23 | 33.6 |
| Nerve conduction study (at 53 years old, Right nerves) | ||||
|---|---|---|---|---|
| DL (ms) |
CMAP | MCV (m/s) | ||
| distal | proximal | |||
| (mV) | ||||
| The median nerve | 2.4 | 0.16 | 0.22 | 39.8 |
| The ulner nerve | 2.9 | 0.76 | 0.8 | 66.6 |
| The posterior tibialis nerve | 4.3 | 10.9 | 10.7 | 42.3 |
VC and FEV1.0 mean vital capacity and forced expiratory volume in one second, respectively. LVEF, LVDd and LVDs mean left ventricular ejection fraction, left ventricular end-diastolic diameter, and left ventricular end-systolic diameter, respectively. DL, CMAP and MCV mean distal latency, compound muscle action potential, and motor conduction velocity, respectively. Normal range of CK are <=25 U at the age of 14 years old, 18–86 U/l at 31 years old, and 41–153 U/l at 57 years old. Normal range of aldolase are 2–8 SU at the age of 31 years old, and 2.7–7.5 U/l at 57 years old. Normal range of myoglobin at the age of 57 years old is <65 ng/ml. Normal range of LVEF, LVDd and LVDs are 53–80%, 40–53 mm and 23–42 mm, respectively.
入院後経過:入院時,身長135 cm,体重26 kg,体温36.3°C,脈拍84/min,血圧109/75 mmHgであった.四肢・体幹に高度の筋萎縮・筋力低下・関節拘縮を認め,全介助であったが,嚥下は問題なく,電動車椅子で移動した.理解・判断は問題なく,構音は正常で,患者会の活動や講演などを精力的に行った.拘束性換気障害を認め(Table 1),心電図は正常範囲であった.32歳頃よりI度房室ブロック等の不整脈を認め,39歳頃より徐脈(40~50/分)となり,房室ブロックを伴う上室性期外収縮・心房頻拍,洞機能不全症候群等の上室性不整脈を合併した(Fig. 2A).また,心室期外収縮,心室頻拍等の心室性不整脈やQT時間延長を認めた.心エコーでは40歳頃より軽度僧房弁逆流を認めたが,左心室の大きさと左室駆出率は正常範囲であった(Table 1, Fig. 2B).45歳時より夜間睡眠時に非侵襲的陽圧換気を導入した.47歳時,Torsade de pointes(TdP)による失神を来した.52歳,心原性脳塞栓症,発作性心房細動を合併し,左片麻痺,嚥下障害,気分障害が後遺症として残存した.食事は経口摂取を継続したが,飲水に経鼻胃管が必要になった.頭部MRI(53歳)では,右放線冠と左前頭葉に脳梗塞を認めた(Fig. 2C).ワルファリンによる抗凝固療法を行い,その後脳梗塞の再発はなかった.血液検査では,血算,肝・腎機能,電解質,耐糖能,炎症反応,免疫グロブリン,甲状腺機能に異常なく,CK,アルドラーゼ,ミオグロビンは正常範囲であった(Table 1).53歳時に施行し得た針筋電図検査(浅指屈筋,内側広筋)では,安静時放電は認めず,正常波形に混在して高振幅や多相性のMUPを認め,早期干渉は認めず,強収縮では干渉は低下していたが動員は比較的保たれていた(Fig. 3A).運動神経の神経伝導検査では(Table 1),後脛骨神経は正常であり,正中神経と尺骨神経で複合筋活動電位低下を認めたが筋萎縮による所見と考えた.感覚神経とF波は評価困難であった.55歳時に,肺炎,左無気肺,心不全,失神を伴うTdPを合併し,気管切開術,人工呼吸器装着,植込み型除細動器(implantable cardioverter defibrillator,以下ICDと略記)植込み術,胃瘻造設(56歳)を施行した(Fig. 2D).心電図ではペースメーカー調律(60/分)となった.56歳時より心エコーで左室壁運動のびまん性低下を認め,心不全が進行した(Fig. 2B).58歳時,神経学的に,意識清明で,時々軽度躁鬱様になるが,理解や判断は問題なく,口を動かして意思伝達した.脳神経では,眼球運動は正常で,両側眼輪筋軽度筋力低下,嚥下障害,咽頭反射減弱を認めるが,舌に異常なかった.運動系では,四肢・体幹の筋萎縮を認めるが,線維束性収縮は認めなかった.四肢関節に拘縮を認め,両側肩関節は外転し内旋,肘関節は90度屈曲し内旋,手関節は伸展,股関節・膝関節高度屈曲,足関節の内反尖足,腰椎前弯を認め(Fig. 3B),深部腱反射は評価困難であった.僅かに動く右手指でボタンを押してスマートフォンを操作し,両側で股関節の屈曲と内外転や足関節底屈が少しみられたが,その他の筋収縮は認めなかった.感覚系,自律神経系に異常を認めなかった.59歳,心室細動を合併したがICDにより除細動できた.しかし,心不全の進行により死亡した.全経過約57年.
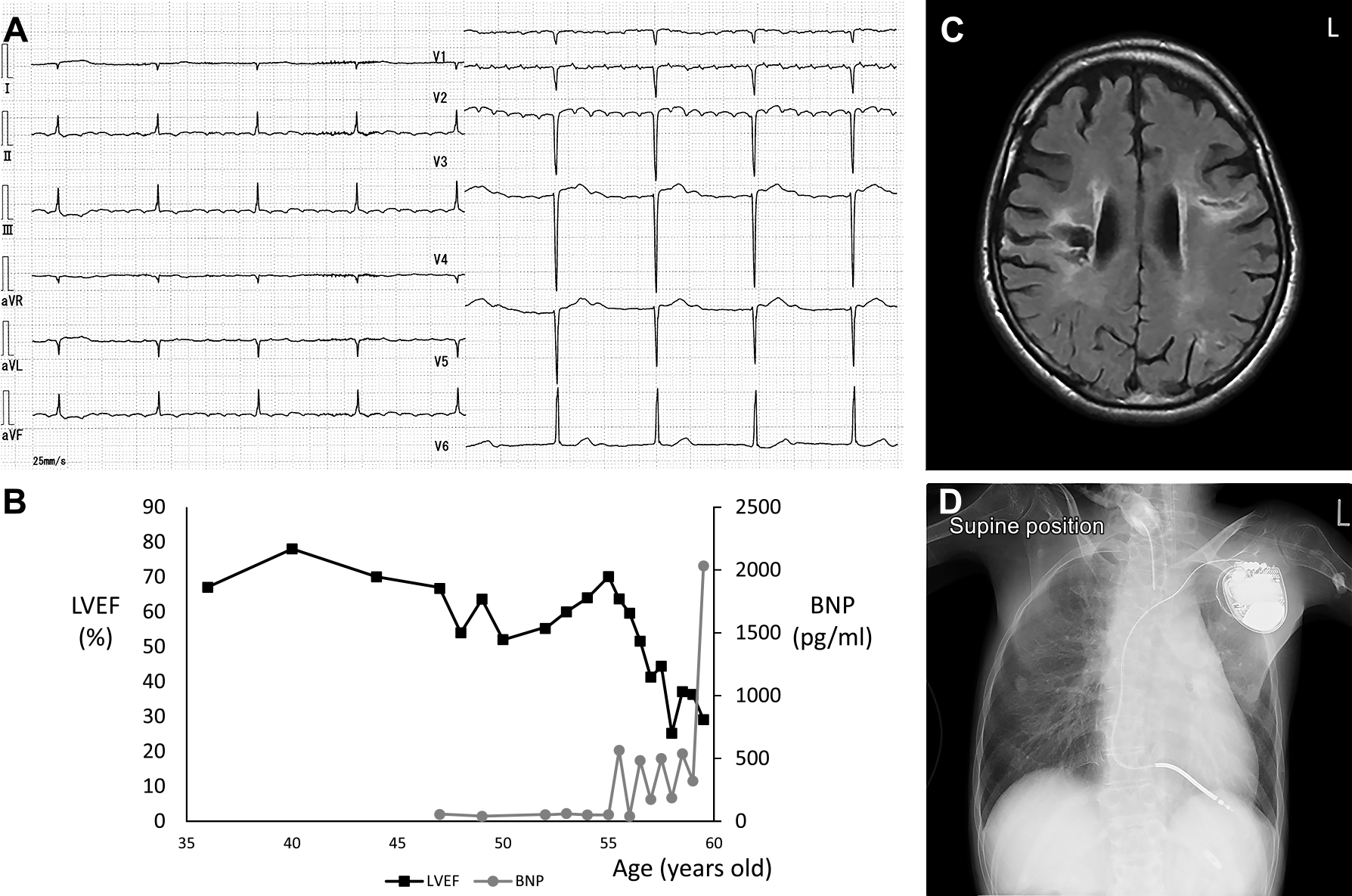
(A) Electrocardiography examined at the age of 53 years old showed supraventricular arrythmia resembling atrial flutter. (B) The course of the left ventricle ejection fraction (LVEF) measured by echocardiography and of the plasma level of brain natriuretic peptide (BNP). (C) FLAIR image on brain MRI at the age of 53 years. (D) Chest X-ray at the age of 55 years old after implantation of implantable cardioverter defibrillator.

(A) Needle electromyography of the Vastus medialis muscle examined at the age of 53 years old. (B) The photograph of the patient at the age of 58 years old. Fig. 3B is published with patient’s permission.
遺伝学的解析:脊髄性筋萎縮症(spinal muscular atrophy,以下SMAと略記)の鑑別のため,本人の同意を得て(54歳時),末梢血よりDNAを抽出し,SMN1遺伝子とNAIP遺伝子のコピー数を調べたが正常であった.本人が原因の解明を希望したため,56歳時に,文書による本人の同意と国立病院機構西別府病院の倫理審査委員会の承認(承認番号28-22,平成29年3月10日承認)を得て,当院臨床研究部遺伝子解析センターで,疾患関連遺伝子エクソームパネル(TruSight Oneシーケンスパネル,Illumina),次世代シーケンサー(MiSeq, Illumina)を用いて,4813遺伝子(target region 12 Mb)のエクソン領域の塩基配列を解析し,VariantStudio software(Illumina)を用いてデータ解析を行った.遺伝学的解析の結果,各データベース2)3)においてアレル頻度1%未満で,ClinVar4)においてclinical significanceが “pathogenic” のバリアントとして,唯一,LMNA遺伝子に,コドン358のグルタミン酸がリジンに置換される(p.E358K, NP733821.1)ミスセンス変異c.1072G>A(NM170707.3, dbSNP rs60458016)をヘテロ接合性に認め,ダイレクトシークエンス解析で確認した(Fig. 4).
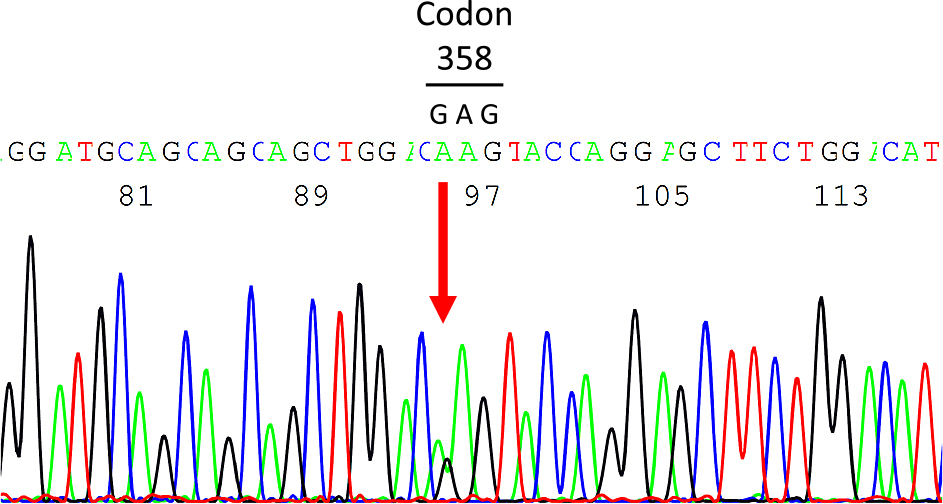
The presence of c.1072G>A heterozygous variant (arrow) in exon 6 of LMNA gene was identified by the direct dye-terminator sequence analysis, using the forward primer (5'-GAAGCTTCGAGACCTGGAGG) and the reverse primer (5'-ATGAGTGAGAGGAAGCACGG).
LMNA遺伝子は核膜蛋白であるラミンA/Cをコードしており,ヒトの各組織で差次的に発現している6).p.E358Kヘテロ接合性変異はAD遺伝形式のEDMD2,L-CMD,LGMD1Bに関連する既知の変異として報告されている7)8).LMNA遺伝子のc.1072G>Aバリアントは,各データベース2)3)5)において日本人及び世界の各地域において健常者には検出されていない(アレル頻度0%).自験例は孤発例であるが,LMNA遺伝子のヘテロ接合性変異による筋ジストロフィーではde novoが多い(76%)とされている9).なお,自験例は母が突然死しており,母が本変異を有している可能性は否定できない.以上より,自験例はラミノパチーと考えた.
自験例では,筋萎縮,関節拘縮,心伝導障害という臨床症状よりEDMD2が考えられるが,典型的な筋原性変化をとらえることができず,診断に苦慮した.針筋電図検査では,高振幅,多相性のMUP,干渉低下を認め,一見神経原性変化様に思われた.しかし,約51年間の罹病期間(検査時)で動員が比較的保たれていたことから,筋原性変化の可能性も考えられる10).ミオパチーにおいて針筋電図検査で高振幅電位や多相性電位がみられることがあり,高振幅電位の機序として,肥大線維によるもの,あるいは,分節性壊死した筋線維の終板がついていない側や再生線維において神経支配の再構築を通じて同一運動単位に属する筋線維のlocal groupingを生ずることによる可能性が推察されている11).また,多相性電位がみられる機序として,上記に加えて,筋線維の大小不同,筋線維のsplitting,隣接筋線維間のephaptic transmission等が推察されている11).Rowińska-Marcińskaらは,非典型的(高振幅,持続時間延長,多相性)MUPが混在してみられたEDMD 21例(X連鎖遺伝16例,AD遺伝5例)を報告し,筋線維サイズの多様性及び筋線維密度増加によるものと考察している12).一方,LMNA遺伝子のヘテロ接合性変異(以下,変異と略記)の症例では,筋原性変化を認めることが多いが7)~9)13)~15),針筋電図検査や筋病理組織で神経原性変化がみられたとする報告が散見される16)~20)(Table 2).多くはミオパチーを示唆する所見も混在してみられ,Table 2の11例中9例で血中CK値上昇を認め,血中CK値正常の2例(case 5, 10)を含む5例では針筋電図検査で筋原性変化の混在を認めた.Table 2のcase 10で認めたp.R377H変異は,EDMD214),LGMD1B15),SMA20),心筋症21)等の多様な病型が報告されており,p.E358Kと同じexon 6の,central rod domainのcoil 2 helical domain(アミノ酸残基244~390)に変異が存在している.p.E358K変異の報告例では,筋原性変化及び1例を除いて高CK血症を認め7)~9),非典型的な針筋電図検査所見の報告はなかった.自験例はp.E358K変異において多様な針筋電図検査所見を呈することを示す貴重な症例と考えられた.
| Case No. | Authors (year) | Mutation (exon) | Age at onset | Sex | Electromyography | Nerve conduction study | Muscle biopsy | CK level (IU/l) (normal range) | Cardiac complications |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Goizet C., et al. (2004) |
c.99G>T p.E33D (exon 1) |
teen | male | Mixed pattern | n.p | n.p | 2 x | Af |
| 2 | teen | male | Neuropathic pattern | sensorimotor neuropathy | Dystrophic | 1.8 x | Af, bradycardia, PMI | ||
| 3 | teen | female | n.p | 6.7 x | AVB | ||||
| 4 | Benedetti S., et al. (2005) |
c.1711C>T p.R571C (exon 11) |
6 y (examined at 14 y) |
male | Ins, fib, psw, high-MUP (TA, G). Minimal denervation and myopathic signs (D, B, VM) |
(Peroneal N) rCMAP, rMCV, (Sural N) rSNAPs, (Upper limbs) w.n.r | Myopathic and neurogenic features (VL) | 5 x | (Normal at 14 y) |
| 5 | c.864_867del p.H289RfsX189 (exon 5) |
33 y (examined at 37 y) |
female | Myopathic signs (proximal muscles) |
w.n.r | Mild myopathic and neurogenic features (Q) | w.n.r | (25 y) AVB, PMI | |
| 6 | Walter MC., et al. (2005) |
c.-3del15 (exon 1) |
39 y | male | Poly- and high- MUP, rIP. Spontaneous activity (B) | rCMAPs, rSNAPs | Neurogenic | 200 (<80) | (45 y) CE, PMI, (48 y) DCM, HT |
| 7 | 35 y | male | Poly- and high- MUP, rIP | rCMAPs, rSNAPs | n.p | 130 (<80) | (42 y) conduction disturbances (45 y) PMI (60 y) DCM (62 y) sudden heart death | ||
| 8 | 20 y | male | Poly- and high- MUP, rIP | rCMAPs, rSNAPs | n.p | 400 (<80) | (31 y) sudden heart death | ||
| 9 | Rudnik-Schöneborn S., et al. (2007) | c.1477C>T p.Q493X (exon 8) |
39 y | female | (45 y) Poly- and small MUP, (60 y) Poly- and high- MUP, Early recruitment (Q) | w.n.r | Neurogenic (Q) | 72 (<70) | (53 y) CHD, AVB grade II with intermittent AT, double node disease, p-Af, PMI |
| 10 | c.1130G>T p.R377H (exon 6) |
34 y | female | Poly- and small MUP | w.n.r | Neurogenic (B) | w.n.r | (56 y) AVB, LBBB, PMI, DCM, (66 y) PMI, died suddenly (septic CVD) | |
| 11 | Iwahara N., et al. (2015) |
c.1057C>T p.Q353X (exon 6) |
childhood | male | Chronic neurogenic changes | (Tibial N) rCMAP | n.p | 179 (45–160) | (43 y) Af, (45 y) complete AVB, PMI, (60–65 y) CE (two attacks) |
| presented case | c.1072G>A p.E358K (exon 6) |
2 y | female | (20 y) Fib, poly-MUP, rIP, (53 y) Poly- or high- MUP, rIP, Normal recruitment | (53 y) (Median and Ulnar N) rCMAP (Tibial N) w.n.r | (16 y) no diagnostic (Q) | w.n.r | (32 y–) bradycardia, AVB, APC, p-Af, VT, Vf, DCM, (55 y) ICD |
y means years old of age. n.p means not performed. w.n.r means within normal range. x means times above normal. N means nerve. Ins, fib, psw, den, poly-, high-, rIP, rCMAP, rMCV and rSNAP mean insertion activity, fibrillation, positive sharp wave, denervation, polyphasic, high amplitude, reduced interference pattern, reduced amplitude of compound muscle action potential, reduced motor conduction velocity, and reduced amplitude of sensory nerve action potential, respectively. B, D, G, Q, TA, VL and VM mean biceps, deltoid, gastrocnemius, quadriceps, tibialis anterior, vastus lateralis, and vastus medialis muscle, respectively. Af, p-Af, AT, AVB, CE, CHD, CVD, DCM, HT, LBBB and PMI mean atrial fibrillation, paroxysmal atrial fibrillation, atrial tachycardias, atrioventricular block, cerebral embolism, coronary heart disease, cardiovascular dysregulation, dilated cardiomyopathy, heart transplantation, left bundle branch block, and pacemaker implantation, respectively. MUP means motor unit potential.
ラミノパチーでは,心伝導障害,上室性不整脈,致死性心室性不整脈,左室機能障害,心筋症,心不全等の心疾患を合併することが多く,突然死を来すこともある22)23).Table 2の11例中,14歳のcase 4以外の10例で経過中に心疾患や心原性脳塞栓症の合併,突然死を認めた.ラミノパチー患者の突然死の原因として心室性不整脈が推定されており,突然死の予防のためICDの植込みが推奨されている22)24).自験例では,30代より徐脈性心房性不整脈,40代より心伝導障害と致死性心室性不整脈,50代より左室機能障害,心不全がみられ,ICD植込み術を行った.LMNA関連心疾患の病的変異を有する日本人の研究では,20歳未満では心症状がみられないことが多く,40歳以上では典型的な心症状がみられることが多かったとされ23),自験例の心合併症の経過は矛盾しないと考えられた.筋萎縮性疾患の鑑別において不整脈など心疾患を合併している場合はラミノパチーを鑑別にあげる必要があると考えられるが,病早期では心症状がみられないこともあり,鑑別疾患は多岐に渡る.遺伝学的解析に当たっては,臨床所見から解析の対象をLMNA遺伝子に絞ることは困難であり,複数の遺伝子が解析候補にあがる.自験例では,典型的なミオパチーの所見が明らかでなく診断に苦慮したが,疾患関連遺伝子エクソーム解析が既知の病原遺伝子変異の検索に有用であった.
p.E358K変異のミオパチーの報告例では,発症年齢は0~7歳,重症度及び進行の速さは1歳で要介助・経管栄養から20~30代で独歩可能と多様であった7)8).検索した範囲ではp.E358K変異の日本人の症例の報告はなかった.自験例は,3歳で歩行不能となり,30代には全介助であり,本邦の他の変異(p.S303P13), p.R377H14))のEDMD2の報告例と比較して進行が速い傾向であった.自験例は小児科受診時から死亡までの経過を追うことができ,その自然歴を把握できたこと及び本疾患を鑑別する上で貴重な症例と考えられた.
謝辞:SMN1遺伝子解析(PCR法)について神戸大学大学院医学系研究科 地域社会医学・健康科学講座疫学分野 西尾久英先生,遺伝学的解析(疾患関連遺伝子エクソーム解析,LMNA遺伝子解析,SMN1遺伝子解析(MLPA法))に携わった国立病院機構 西別府病院 臨床研究部 樋口裕子様,心合併症の診療について同院 循環器内科 天田浩司先生,宮崎寛子先生に深謝致します.
本報告の要旨は,第221回日本神経学会九州地方会で発表し,会長推薦演題に選ばれた.
※著者全員に本論文に関連し,開示すべきCOI状態にある企業,組織,団体はいずれも有りません.