日本臨床衛生検査技師会穿刺液検査標準化ワーキンググループは,穿刺液(体腔液)検査の臨床的意義と施設間差の是正を目指し,細胞数算定法,細胞分類法,報告法についてまとめ日常検査法として推奨する。細胞数算定は細胞数(個数/μL)とし,赤血球以外のすべての細胞を算定する。細胞分類は,サムソン3分類法またはギムザ3分類法を用いる。サムソン3分類法は,多形核球・リンパ球・その他の細胞の3分類,ギムザ3分類法は,好中球・リンパ球・その他の細胞に分類する。分類細胞は,百分率(%)で表示する。その他の細胞の分類が可能な場合は,補足として詳細に記載する。3分類法による報告は,急性炎症と慢性炎症,漏出性の病態が示唆でき,臨床的意義1)と結びつく結果報告である。またこれらは,一次スクリーニングとしても役立ち,微生物学的検査や細胞診検査などへのきっかけとなる。
A working group for the standardization of puncture fluid established by the Japanese Association of Medical Technologists has compiled the methods of cytometry, cytotaxonomy, and reporting for the puncture fluid test. First, cells were counted, except red blood cells. Next, we employed the Samson classification method and Giemsa staining for the cytotaxonomic classification of three cell types. The Samson classification method classified cells into polymorphonuclear cells, lymphocytes, and other cells. Giemsa staining classified cells into neutrophils, lymphocytes, and other cells, and the percentage of each type of cell was shown. If the details of other cells were known, they would be recorded as supplemental information. The reports based on the results of these classification methods may indicate acute inflammation, chronic inflammation, or leaky pathology. They were also useful for primary screening and for determining the next tests, such as microbiology tests and cytology.
穿刺液検体(胸水,腹水,心嚢水,関節液,CAPD排液)として提出される体腔液は,呼吸器内科,総合診療科,消化器内科,腎臓内科,循環器科,整形外科,リウマチ科等さまざまな診療科から提出され1)~8),検査目的や臨床的要望も多岐にわたる。また臨床検査室では一般検査室,生化学検査室,血液検査室,細菌検査室,病理・細胞検査室など多くの部門が穿刺液検体に関与し,それぞれ専門的な検査を行っている。しかし穿刺液検査にかかわる専門的な診療科がないため,標準的な検査項目もなく,また検査技師が検査結果を総合的に評価する機会も少ないと思われる。現状の穿刺液検査では細胞数算定及び細胞分類について,どのような細胞を算定・分類するのか標準法が提示されていないため,施設ごとに算定や分類に差があると考えられ,臨床医は施設間差を含む検査結果で診断をしなければならない9),10)。今回我々は,顕微鏡学的検査における標本作製法や形態学的細胞分類法,細胞数算定法,手順について,臨床的意義11)をもとに施設間差改善を目指した検査方法を提案する。
原則として穿刺液の検体採取時には抗凝固剤は使用せず,速やかに検査室へ提出してもらう。自動血球分析装置で算定する場合は,抗凝固剤(ヘパリンもしくはEDTA2K等)を用いることがある。ただしヘパリン使用時はサムソン(Samson)液の染色には適さない。
細菌検査や遺伝子検査の依頼がある場合は,無菌的操作により滅菌容器を使用し,速やかに検査室へ提出してもらう。検体の取り扱い時は,陰圧室やN95マスク使用など感染対策に注意を払って行うことが望ましい。
2. 試薬・器具1)サムソン(Samson)液
2)チュルク(Türk)液
3)メイ・グリュンワルドギムザ(May-Grünwald-Giemsa; MG)染色液またはGiemsa系染色液
4)ヒアルロニダーゼ(Hyaluronidase)
関節液検査で使用する。約1 U/μLに調整し,マイクロチューブへ100 μLずつ分注して−20℃以下で凍結保存する。
5)フックス・ローゼンタール(Fuchs Rosenthal)計算盤:細胞分類を行うために×400(対物レンズ40×)で観察できるものを使用するのが望ましい。また,感染防止の観点から,ディスポーザブル計算盤12)を用いることが望ましい。
胸水,腹水,心嚢水などの体腔液は,急性炎症や慢性炎症,腫瘍,循環障害などにより貯留し,白血球,組織球,中皮細胞,悪性細胞などのさまざまな細胞を含有する。細胞数と出現細胞分類は,疾患原因との関連が深く,臨床診断や治療に役立つ重要な結果報告となる13),14)。
1. 外観の観察検体を十分に混和し,肉眼で外観(色調,混濁,性状)を観察する。色調の分類は淡黄色,黄色,淡赤色,赤色,褐色,白色などとする。混濁は-,±,+などとする。性状は漿液性,膿性,血性,乳びなどとする。
2. 細胞数算定と細胞分類について染色方法の選択について,使用染色法と検査の流れを,穿刺液検査の染色法適応フローチャートを示した(Figure 1)。フローチャートに沿って選択して行い,細胞数と細胞分類は必須項目である。
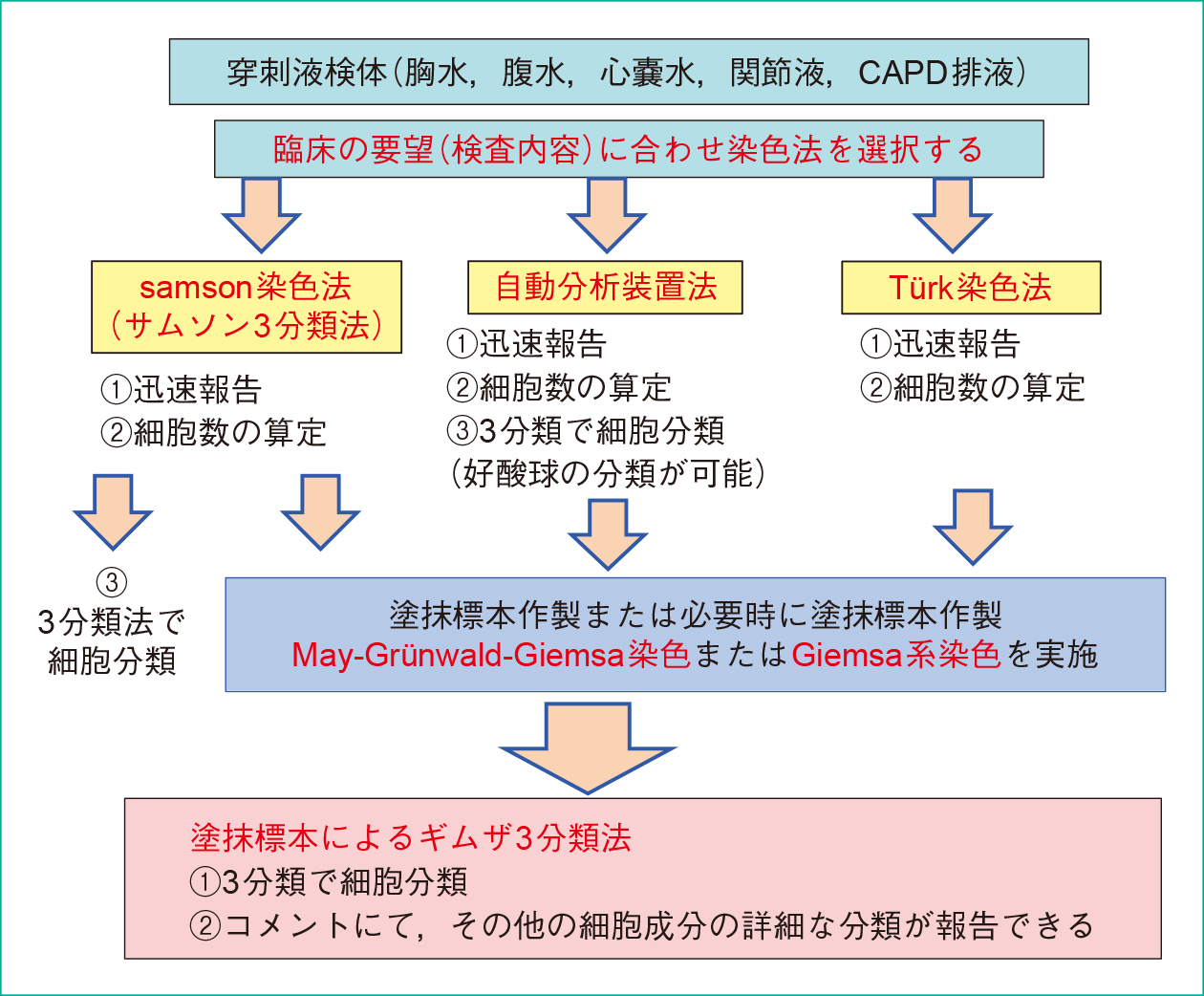
使用染色法と検査の流れを示した。フローチャートに沿って選択して行う。
用手法では,細胞数算定と細胞分類が同一計算盤上でできるSamson液染色法を推奨する。さらに詳細な細胞分類が必要な場合や悪性を疑う細胞,分類困難細胞がみられた場合は,塗抹標本を作製しMG染色液またはGiemsa系染色を実施し分類することが望ましい。
3. Samson液染色による細胞数算定と細胞分類法 1) 検体希釈検体を十分に混和し,生理食塩水(0.85~0.9 w/v (%) NaCl)により3倍に希釈する。
例:検体100 μL + 生理食塩水200 μL
2) Samson染色上記1)の希釈検体(180 μL)とSamson液(20 μL)を試験管内で十分に混和し,Fuchs-Rosenthal計算盤で算定する。細胞数検体別算定方法(Figure 2)を,フローチャートで示した。あらかじめ検体を3倍希釈するが,染色手順は髄液検査と同じである12)。
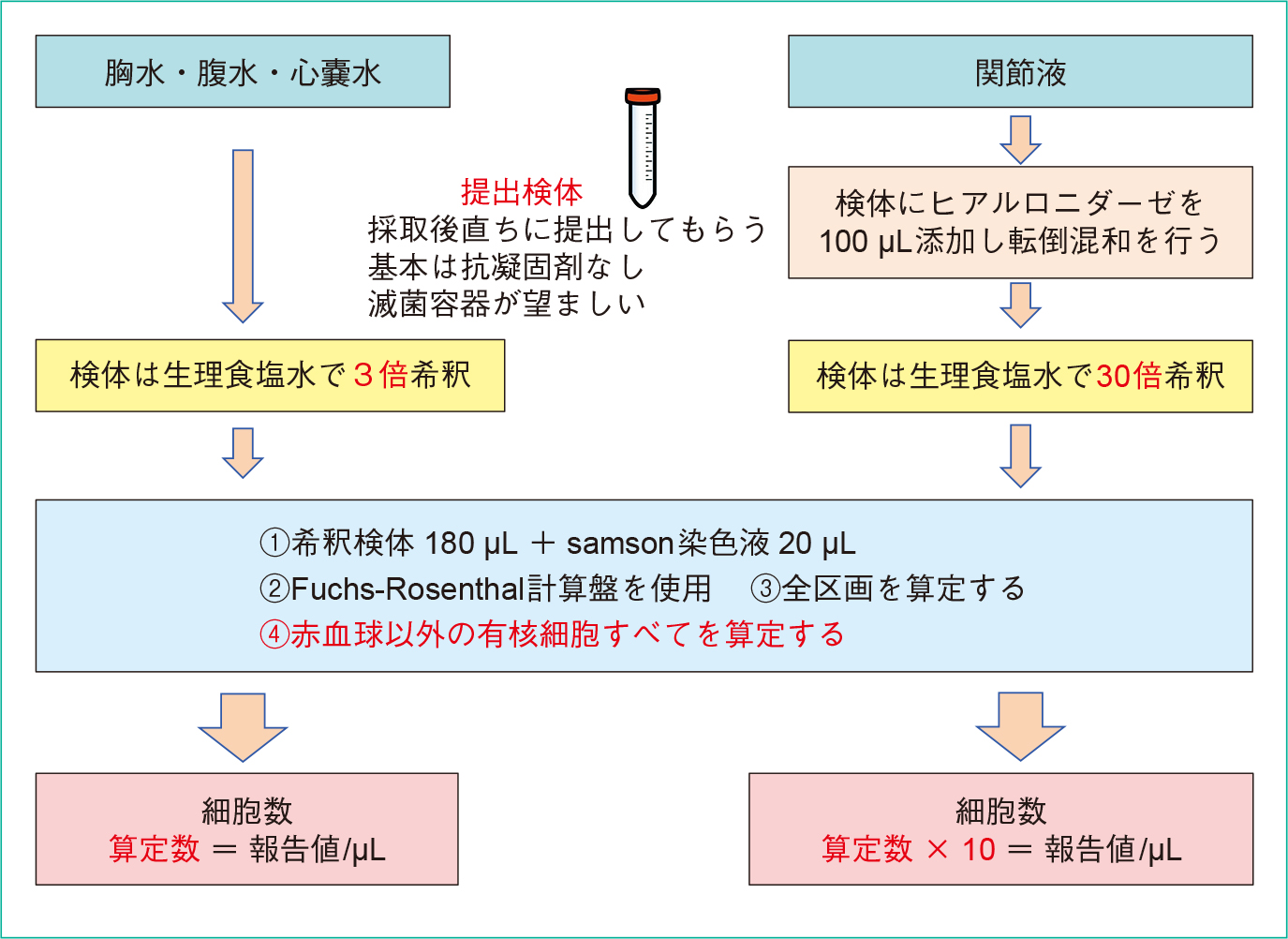
検体種別から希釈に注意する。
はじめに×100(対物レンズ10×)で計算盤全体の細胞を鏡検し,分布・細胞集塊など全体像を観察する。次いで細胞数は×400で全区画について赤血球以外の細胞をすべて算定する。細胞数はカウントされた実測数から1 μL中の細胞数に換算し報告する(個数/μL)。細胞数が多い場合は,いくつかの中区画を算定し,全区画の算定数に換算する。細胞集塊の細胞数を算定する場合は,それを構成している細胞を出来る限り数え,細胞数としてカウントする。
4) 細胞分類法(サムソン3分類法)Samson染色では詳細な細胞の判別が困難なため,多形核球・リンパ球・その他の細胞の3分類15)とする。多形核球には好中球・好酸球・好塩基球が含まれる。リンパ球にはリンパ球だけでなく形質細胞も含む(リンパ球と形質細胞は,Samson染色での判別が難しく両細胞を含むものとする)。その他の細胞には,多形核球とリンパ球以外のすべての細胞(単球・組織球・中皮細胞・悪性細胞など)が含まれる。各細胞の割合は,総細胞数に対する百分率(%)で報告する。細胞数が多く,計算盤内の細胞分布が均一に分布している場合には,200~300個の細胞を分類し,1 μL中の細胞分類に換算する。ただし,細胞の見落としが無いよう確認に,計算盤の全視野観察は必要である。
[報告例]
総細胞数1,200/μL,多形核球80%,リンパ球10%,その他の細胞10%
4. MG染色液またはGiemsa系染色標本について 1) 塗抹標本作製法(引きガラス法)遠心条件は約2,000 gで3~5分間とする。遠心後の検体を示す(Figure 3)。沈渣の塗抹標本作製に際しては,蛋白の添加は不要である。また,細胞量が多い場合は,上清で沈渣を引きやすい細胞濃度に調整する。細胞数が少ない場合は,デカンテーションにより,上清を出来るだけ除去する。遠心後上清の調節を示した(Figure 4)。塗抹標本の作製には,乾燥しやすい標本作製のため,遠心後沈渣の積載量は5~10 μLとし,ウェッジ法にて,引き止めとする。塗抹標本の作製を示す(Figure 5)。細胞成分が多い場合は,引きガラスを倒し(スライドガラスと引きガラスの角度を小さくする),ゆっくりと一定の速度で引く。また細胞量にかかわらず,粘性や膿性の検体では,細胞が壊れやすいため,検体を挟んでスライドを両サイドに引く,すり合わせ法(Figure 6)が有効である。

遠心後の細胞量を見ながら,塗抹標本作製しやすい濃度に上清を除去する。この検体の場合は,上清をデカントしても良い。

遠心後沈渣が少ない(細胞量が少ない)場合は,デカントにより上清を除き,細胞のみにすることで細胞萎縮のない塗抹標本作製が出来る。

乾燥しやすい標本作製のため,スライドへの沈渣の積載量は5~10 μL程度とする。
粘性の高い検体や膿性の検体は,検体を挟んでスライドを両サイドに引く。
乾燥操作:塗抹した標本は,すみやかに冷風により乾燥(Figure 7)を行う。乾燥が不十分だと,細胞が萎縮し,適切な細胞分類が行えない。特に塗抹量が多い検体は注意が必要である。

安全キャビネット内にて標本作製と乾燥操作を行う。
染色:標本の染色性は,室温や出現細胞数量が大きく影響するため,慣れないうちは時々顕微鏡下で細胞の染色状態を確認しながら染色時間を決定する。
2) 自動遠心塗抹法自動遠心塗抹法(オートスメア法・サイトスピン法など)は,専用の機器を用い遠心力により細胞をプレパラートに直接塗抹する方法で,集細胞能が高い特徴がある。細胞数の少ない場合や検体量が少ない時(500 μL以下が目安)に行われる。体腔液の性状や細胞数は検体によってさまざまであるため,血性検体であれば予め遠心してバフィーコートから採取した検体を使用する。細胞数が多い検体であれば,厚い標本にならないように細胞の濃度を調整し,細胞が重なり合わないようにすることがきわめて重要である。
3) 鏡検方法(引きガラス法の場合)塗抹標本は×100で標本全体を観察し,細胞分布や細胞集塊の有無を確認する。次に×400でそれぞれの細胞を分類する。
引きガラス法による塗抹では,大型の細胞は標本の引き終わりや辺縁部位に,小型の細胞は中心部位に多く塗抹される。従って,大小さまざまな細胞が出現する体腔液で細胞分類を行う場合は,細胞分布のばらつきを考慮して,引きガラス細胞鏡検法に示すように辺縁部位の2ヶ所(①と③),中心部位の1ヶ所(②),引き終わり周辺部位の2ヶ所(④と⑤)のそれぞれ100個ずつ,合計500個の細胞をカウントする16)(Figure 8)。
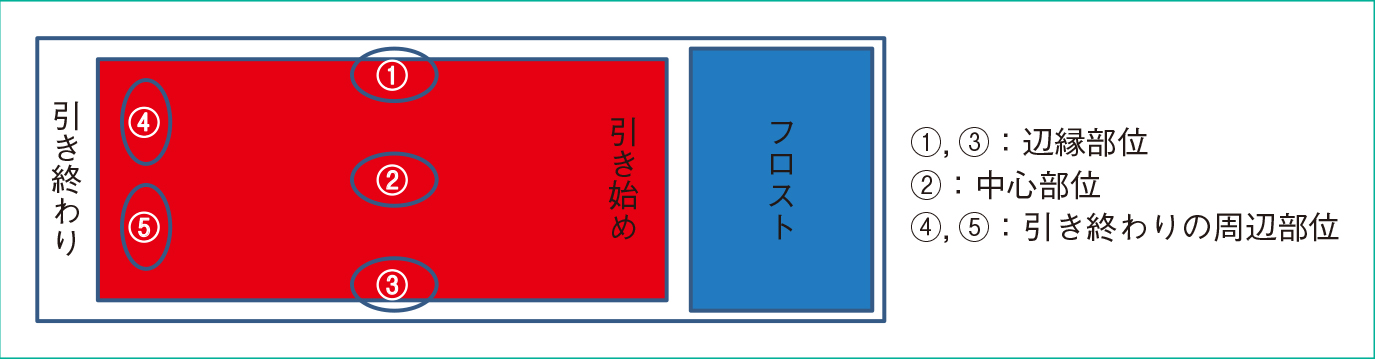
①~⑤までの部位にて細胞分類を行い,平均することで標本の均等な細胞分類が出来る。
MG染色液またはGiemsa系染色による細胞分類は,好中球,リンパ球,その他の細胞の3つに分類し,それぞれの細胞の割合を百分率(%)で表示する。細菌や結晶などが認められた場合も報告する。
その他の細胞には好酸球,好塩基球,組織球(単球),中皮細胞,悪性を疑う細胞などが含まれる。より詳細な細胞分類が可能な施設では,それぞれの細胞数を%で報告する。組織球や中皮細胞,悪性を疑う細胞など類似しており分類が出来ない場合は,その旨を記載して合計の百分率(%)を報告する。悪性を疑う細胞が認められた場合は「悪性を疑う細胞」と報告する。悪性細胞との鑑別が困難な細胞が認められた場合は「良・悪性不明細胞」もしくは「分類困難細胞」,細胞の由来がはっきりしない場合は「不明細胞」として報告するが,いずれの場合も細胞の大きさ,集塊の有無,細胞質や核の性状などの細胞学的所見を記載することが重要である。一般検査部門で使用する用語の「異型細胞」は悪性細胞を意味することが多い。しかし血液検査部門や病理検査部門などでは,良性細胞や反応性細胞を示すこともあり,表現する内容,意味に違いがある。穿刺液は多部門が関わる検体のため,部門を超え共通認識の用語で報告することが求められる。そのため悪性を疑う場合の報告は「悪性を疑う細胞」とする。
検体を混和後,外観(色調,粘稠性,混濁,性状)を観察する。色調,混濁,性状の分類は胸水・腹水・心嚢水に準ずる。粘稠性の判断は,強・弱などとする。
2. Samson液による細胞数算定17) 1) ヒアルロニダーゼ処理関節液検体は粘稠性を認めるため,検査を実施するにあたり,検体にヒアルロニダーゼ調整液100 μLを測定直前に添加する。数回の転倒混和を行い,検体の粘稠性を除去する。検体量が500 μL以下の場合には,添加するヒアルロニダーゼによる希釈率を計算し,細胞数の報告を行う。
2) 検体希釈生理食塩液(0.85~0.9 w/v (%) NaCl)で30倍に希釈する。
例:検体100 μL+生理食塩液2,900 μL
3) 細胞数算定細胞数の算定法は,胸水・腹水・心嚢水に準ずる。ただし,検体はあらかじめ生理食塩水で30倍に希釈しているため,細胞数値は,算定数を10倍にして報告する。
4) 細胞分類法(サムソン3分類法・ギムザ3分類法)胸水・腹水・心嚢水に準じる。
3. MG染色液またはGiemsa系染色による細胞分類塗抹標本作製法,鏡検方法は胸水・腹水・心嚢水に準ずるが,中皮細胞ではなく滑膜細胞となる。結晶の貪食像や,組織球内への好中球や細菌の貪食像などは臨床上有用な所見であるため報告は重要である。
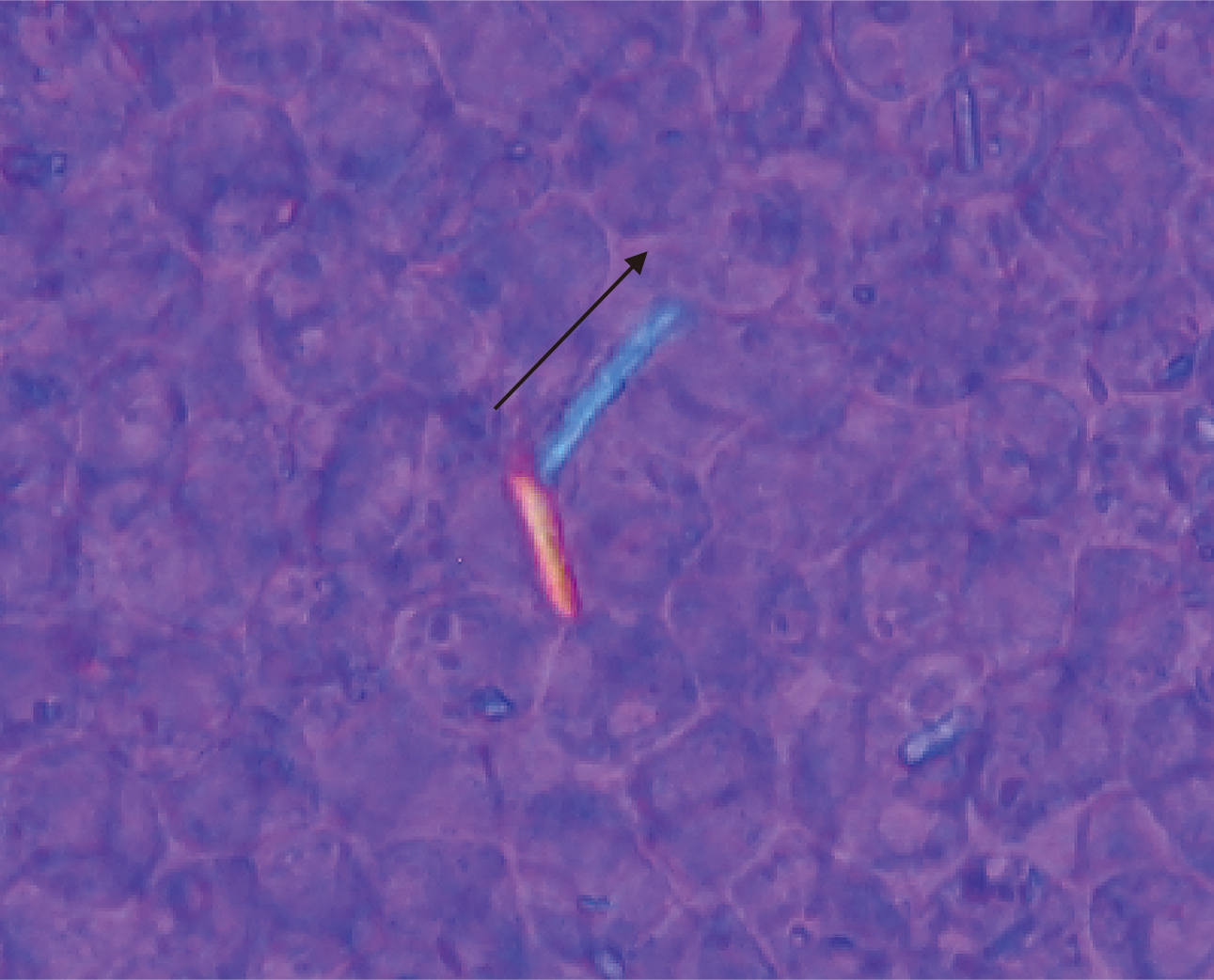
4. 結晶の確認 1) 結晶の分類結晶の有無は,スライドガラスに原液の検体を約15 μL積載し,カバーガラスをかけて鏡検をする。好中球や組織球の細胞内へ結晶の貪食像を認めた場合,免疫反応(炎症)が生じている所見であり,結晶誘発性関節炎の診断に繋がる。そのため,「細胞内に結晶の貪食像あり」のコメントは臨床にとって有用な所見になる。結晶が見つからない場合や判断に困る場合は遠心(約2,000 g,3~5分間)後の沈渣を再度鏡検する。偏光装置の鋭敏色偏光板アナライザー(UGAN)とポラライザー(UPOT)を用い,結晶の鑑別が出来る。結晶誘発性関節炎の結晶鑑別は,長期治療方針に必要のため診断上重要である。X線検査では,尿酸結晶は写らないため,顕微鏡学的検査による結晶鑑別の臨床的意義は高い。写真は,ルーチンの顕微鏡(正立顕微鏡)に,鋭敏色偏光板アナライザーとポラライザーを用いて,簡易偏光法で観察する方法を示した。結晶の鑑別は,鋭敏色偏光板アナライザーを取り付け,レバーを中央に設定した写真を示した(Figure 9)。ポラライザーを光源の上にセットする写真を示した(Figure 10)。結晶を見つけたら,ポラライザーを回しながら暗くし,光量を上げ,絞りを調整する。鋭敏色偏光板アナライザーのレバーで前後に変えながら,偏光をかけて結晶の同定を行う。Z軸(γ軸)の方向と結晶判定(Figure 11)を載せた。ゴミ,ガラス片なども偏光があるため注意を要する。結晶の形は均一であり,辺縁は鋭く硬い。細胞内に結晶の貪食像が観察されると確実である。尿酸ナトリウム結晶(Figure 12)とピロリン酸カルシウム結晶(Figure 13)の写真を載せた。結晶の長軸が偏光板Z軸(γ軸)と平行で光っている色を見て判定する。

鋭敏色偏光板アナライザーのZ'(γ)軸変更レバーにより結晶の鑑別を行う。

ポラライザーを光源にセットし,光量調整を行う。
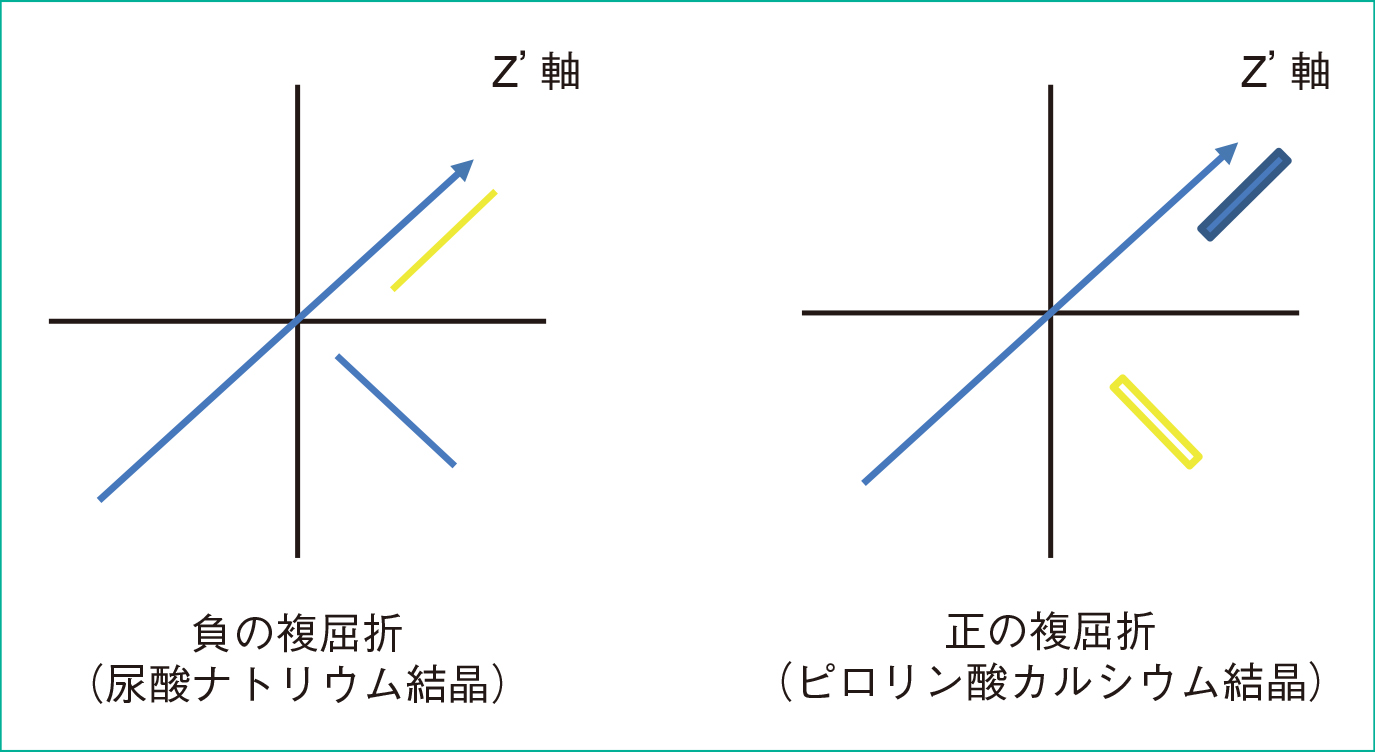
鋭敏色偏光板のZ'軸と結晶の判定を示した。

矢印は偏光板Z'(γ)軸。結晶は平行に黄色。
矢印は偏光板Z'(γ)軸。結晶は平行に青色。
外観(色調,混濁,性状)を観察する。色調,混濁,性状の分類は胸水・腹水・心嚢水に準ずる。
2. Samson液による細胞数算定 1) 算定方法,細胞分類方法胸水・腹水・心嚢水に準ずるが,細胞数は検体の混濁具合により原液か希釈かを選択する。
3. MG染色液またはGiemsa系染色による細胞分類 1) 塗抹標本作成法胸水・腹水・心嚢水に準ずる。標本作成は,遠心(約2,000 g,3~5分間)後の上清をデカントし,沈渣にアルブミンを添加して標本作製を行う。
穿刺液検査には,自動分析装置を使用することが可能になりつつあり18),日常検査のみならず,時間外や日当直検査の個人差解消や施設間差の是正が期待できる。
穿刺液は,組織球・中皮細胞・悪性細胞などが出現するので,それぞれの細胞を測定できることが理想である。測定については各社特徴があり,細胞分布表示データを利用し,ある程度の細かい細胞の算定ができる機器や,全有核細胞数のみの測定しかできない機器もあり,使用機器の特徴を踏まえて測定する必要がある。また,詳細に分類する必要がある時は,目視による算定や分類を行うことが必要不可欠であり,MG染色液またはGiemsa系染色法を実施することが望ましい。現在,穿刺液検体を血算モード以外の測定モードで測定できる機器メーカーは,シスメックス社,シーメンス社,ベックマンコールター社などである(2020年4月現在)。測定時の注意点として,検体の状態をよく観察し測定しなければならない。例えばフィブリンの析出は,分析機のトラブルの原因となるので,フィブリン除去やあらかじめ抗凝固剤の添加などが必要である(ヘパリンを加えた検体ではSamson染色法は実施できないので注意が必要である)。
細胞数算定について,Türk液を用いたBürker-Türk計算盤では,検体希釈が10倍,計算盤の深さが0.1 mm容積は0.9 mm3であり,1 μL中の細胞数は測定数の約100倍となる。これは,膿胸や化膿性関節炎などの細胞数が多い検体では算定しやすい条件となるが,細胞数が少ない場合には逆に希釈による誤差を生じる19)。また細胞分類については,Türk液は細胞の染色性が良いとは言えず,細胞数算定は可能であるが細胞分類には適さないと考えられる。
それに対してSamson液は広く髄液検査で利用され,フクシン・酢酸により細胞の染色性が良好12)で,細胞数算定,分類ともに適している。またサムソン法では検体を生理食塩水で希釈することにより,検体中の蛋白や脂質成分がSamson液と反応し現れる微粒子の析出防止となり,核の染色性が良いことと相まって細胞分類がより容易となる。
細胞数算定において,赤血球以外の細胞すべてを算定することは,技師間差の少ない検査法と考えられる。
細胞分類についても,鏡検による単球と組織球,中皮細胞の判別は困難であり,悪性細胞も含めて,「その他の細胞」として分類することにより,細胞分類が実施しやすくなる。報告の記載については,細胞数は全細胞数として報告し,細胞分類は病態を示唆できる3分類法が有用である。好中球とリンパ球,その他の細胞の3種類分に分類することは,自動分析装置の運用を実現するためにも有用と考えられる。単球や組織球,中皮細胞,悪性細胞の分類が難しいことも含めてシンプルな3分類法が臨床的意義1)と施設間差の解消を目指した検査法として適切と考える。そして,塗抹標本のMG染色液またはGiemsa系染色により,好酸球や好塩基球,組織球,中皮細胞,悪性細胞が分類可能な場合は,「その他の細胞」の詳細報告が実施でき,臨床にとってさらに重要な結果報告となる。
穿刺液検体(胸水・腹水・心嚢水,関節液,CAPD排液)として提出される体腔液の検査法について,顕微鏡学的検査を中心とした検査法を提案した。臨床医の要望に則した検査法として施設間差と技師間差の改善を目指した本提案は,それぞれの検査目的に十分な検査法であり,多くの施設で実施可能な検査法である。今後,標本の作製手順や基準的な細胞分類についてのアトラス集を追加提示し,広く測定手技や細胞分類に於いて実施可能な環境を整え,個人差及び施設間差の是正を進めていきたい。また,臨床現場からの要望が多い自動分析装置法についても,標準的な運用方法を提案していきたい。
細胞3分類法のSamson液使用の計算盤細胞写真×400を載せた(Figure 14–16)。緑矢印は多形核球,黄色はリンパ球,青矢印その他の細胞に分類する。
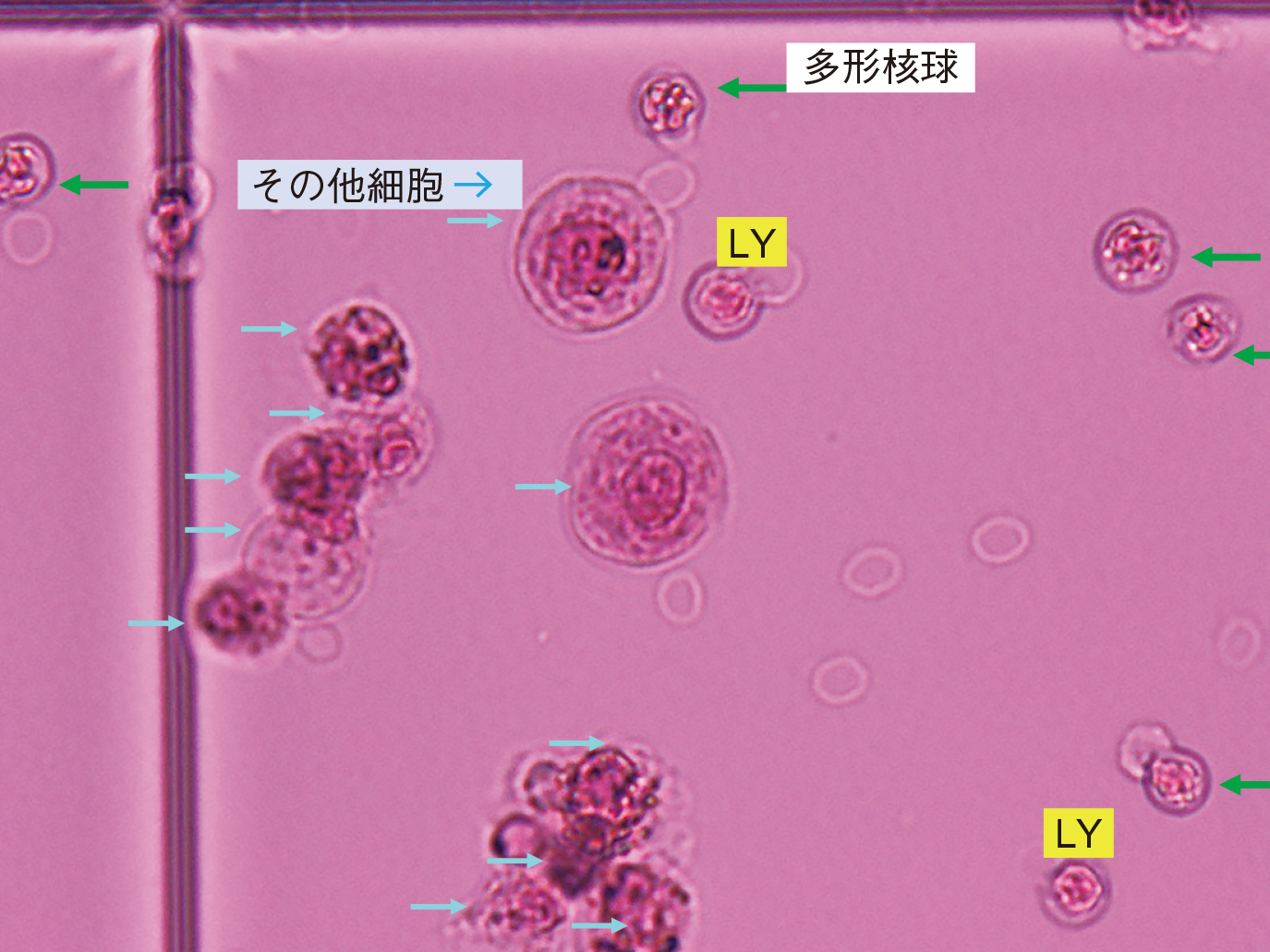
多形核球5,リンパ球2,その他の細胞11。

多形核球5,リンパ球1,その他の細胞1。
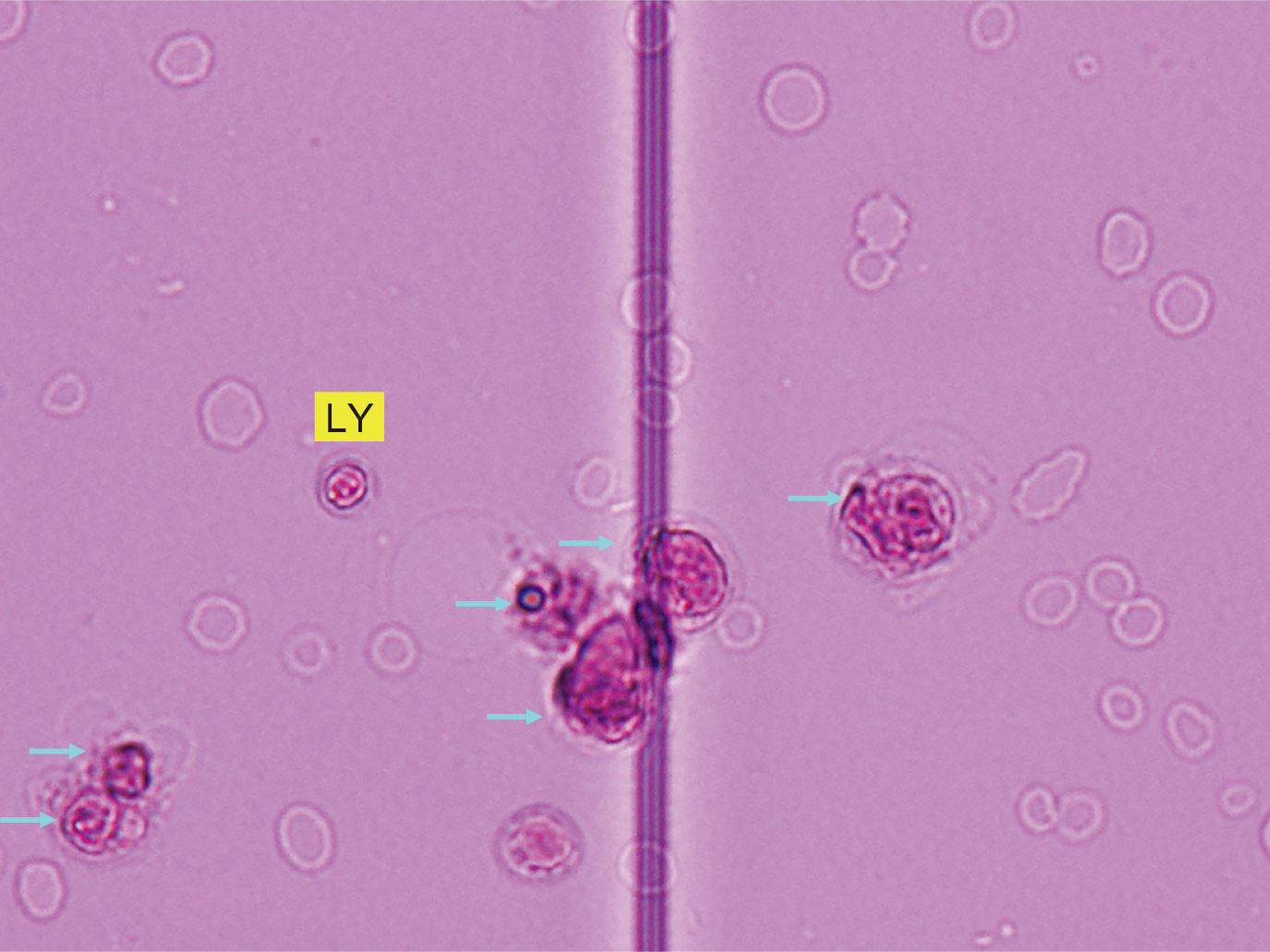
多形核球0,リンパ球1,その他の細胞6。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。