2019 年 40 巻 1 号 p. 45-55
2019 年 40 巻 1 号 p. 45-55
波長Er:YAGレーザー光は2.94 μmの水に極めてよく吸収され軟組織と硬組織の蒸散も可能であることから,歯周治療領域では主に炎症性肉芽組織と歯石のデブライドメントに用いられてきた.近年Er:YAGレーザーの表面のみに限局した血餅形成能を応用した骨再生の新術式であるEr:YAG laser-assisted bone regenerative therapy(Er-LBRT)を開発し,既存の術式と比較して同等以上の効果を得ている.また,インプラント周囲炎治療にも応用され良好な結果を示している.本稿ではEr-LBRTの臨床症例を紹介し,文献を参考に解説する.
Er:YAGレーザーは,他の歯科用レーザー以上に高い水への吸収能と,ハイドロキシアパタイト内の水分を急激に気化させることで生じる硬組織蒸散能の特徴を活かし歯科領域で応用され良好な結果を示している1).また,生体組織の極表面でレーザー光が吸収されることから,比較的薄い歯肉の治療時に深部にある骨膜,骨組織に熱影響を及ぼすことが少なく,注水による冷却作用と合わせて繊細な治療を可能とする2).特に歯周治療領域では,炎症性肉芽組織等の軟組織の蒸散以外にも,歯肉縁下歯石の除去,骨外科治療,歯肉のメラニン色素除去等に用いられ,多彩なバリエーションのチップにより既存の器具と比較し,効率的な治療が可能となっている3-5).歯科治療時にEr:YAGレーザーは通常,注水下で使用するため,術部の出血を洗浄しながら常に明視野での治療を可能とする.さらに蒸散層周囲に発生する細胞活性層の影響により治癒促進も期待できる6).そのため現在では歯周外科治療および歯周組織再生治療時に使用されることも多い7-9).文献的裏付けとして,Er:YAGレーザーを用いた歯石除去後の根面の形態学的研究では,根面に微細な凹凸が確認され血餅を維持しやすい形態になっていることから,歯周治療後の再生への関与が示唆されている3,10,11).イヌを用いた動物実験では,Er:YAGレーザーを使用することで歯周外科治療後の歯槽骨再生が対照群と比較して有意に認められたと報告されている.その際,レーザーを用いてデブライドメントを行った歯根表面に熱変性層が確認されているが,治癒過程を妨げることなく経過は良好であったとされている12).Er:YAGレーザーの歯周治療に対する臨床効果を示す論文として,Er:YAGレーザー使用群と既存の器具を使用する群の比較研究では,Er:YAGレーザー使用群はプロービングデプス,アタッチメントレベルともに既存の器具を使用する群の治療効果と同等以上の効果を示し13),術後2年間臨床パラメーターは維持されていた14).さらに手用器具を用いてのデブライドメントとは異なり術部の殺菌およびエンドトキシンの除去効果も示されていることも歯周治療に有利に働いていると考えられる15-18).
一方,再生治療は歯周治療,インプラント治療領域において日常的に行われている19,20).歯槽骨およびインプラント周囲骨の再生治療は様々な用途の材料が開発され主に骨補填材,タンパク質製剤,メンブレンに大別される21-23).臨床的には再生を計画する骨形態に対し,これらを組み合わせることにより歯周およびインプラント周囲骨の再生が可能となる.骨補填材料は一般的には顆粒状であり,人工骨ではβ-TCP,ハイドロキシアパタイト,炭酸アパタイト,生体由来材料ではFDBA,DFDBA,ウシ骨材料が多く用いられおり,血液と混和後に骨欠損部に填入する様式で使用される24-27).歯周組織再生治療では必要移植骨量も少なく自家骨移植単独を行うケースもあるが,インプラント周囲における骨再生は目標とする再生骨量が多量であるため,骨移植材料単独もしくは自家骨と混和し使用するケースが多い.タンパク質製剤は主にエナメルマトリックスタンパク,ヒト合成血小板増殖因子,骨形成タンパクが用いられ,根面および骨面への塗布,移植材へ混和し使用される28,29).メンブレンは上皮を含む軟組織の骨欠損部への遮蔽を行い,骨欠損部に骨再生を誘導するスペースを維持する効果を示し,歯周組織再生治療ではGuided Tissue Regeneration(GTR)法,インプラント治療を目的とする骨再生ではGuided Bine Regeneration(GBR)法とされている.現法ではメンブレンのみを使用する術式であったが,現在は骨移植との併用が一般的である22).
具体的な歯周組織再生治療を目的とした術式では,歯肉の切開剥離を行い,炎症性肉芽組織,歯石,石灰化物のデブライドメントを行なった後,再生材料を使用する.このとき3壁性骨欠損形態であればタンパク質製剤単独での再生も期待できるが,2および1壁性骨欠損形態へ移行するに従い,タンパク質材料単独では十分な再生が期待できないことから,骨補填材料やメンブレンを使用する症例が多くなる30-36).このうち,移植後の骨補填材料の形態が維持できない症例はメンブレンの使用が適応となる37-39).しかし,メンブレンの設置は縫合およびタッグ,スクリューを使用し直接骨に固定するため技術的に煩雑であり,またテンションフリーでの閉創を目的とした大幅な骨膜減張切開を行うため,術後の出血,疼痛,腫脹などの不快症状が出現する.特に歯肉の薄い症例および歯間部では,継時的な粘膜の裂開によるメンブレンの露出が認められることもあり,術部の感染による骨吸収を惹起させる可能性がある(Fig.1a–d).さらに骨膜減張切開に起因する付着歯肉の喪失および口腔前庭狭小が認められることも多く,術後のプラークコントロールが困難になるため,追加処置として口腔前庭拡張術が必要なケースも認められる.一方メンブレンを使用しない,骨補填材とタンパク質材料の併用療法は比較的術式は簡略化されるが,骨壁の少ない骨吸収およびインプラント周囲では粘膜を介して加わる,外力により移植骨の形態を維持できず骨再生を促すスペースが損なわれ十分量の再生が見込めない症例も認められる.
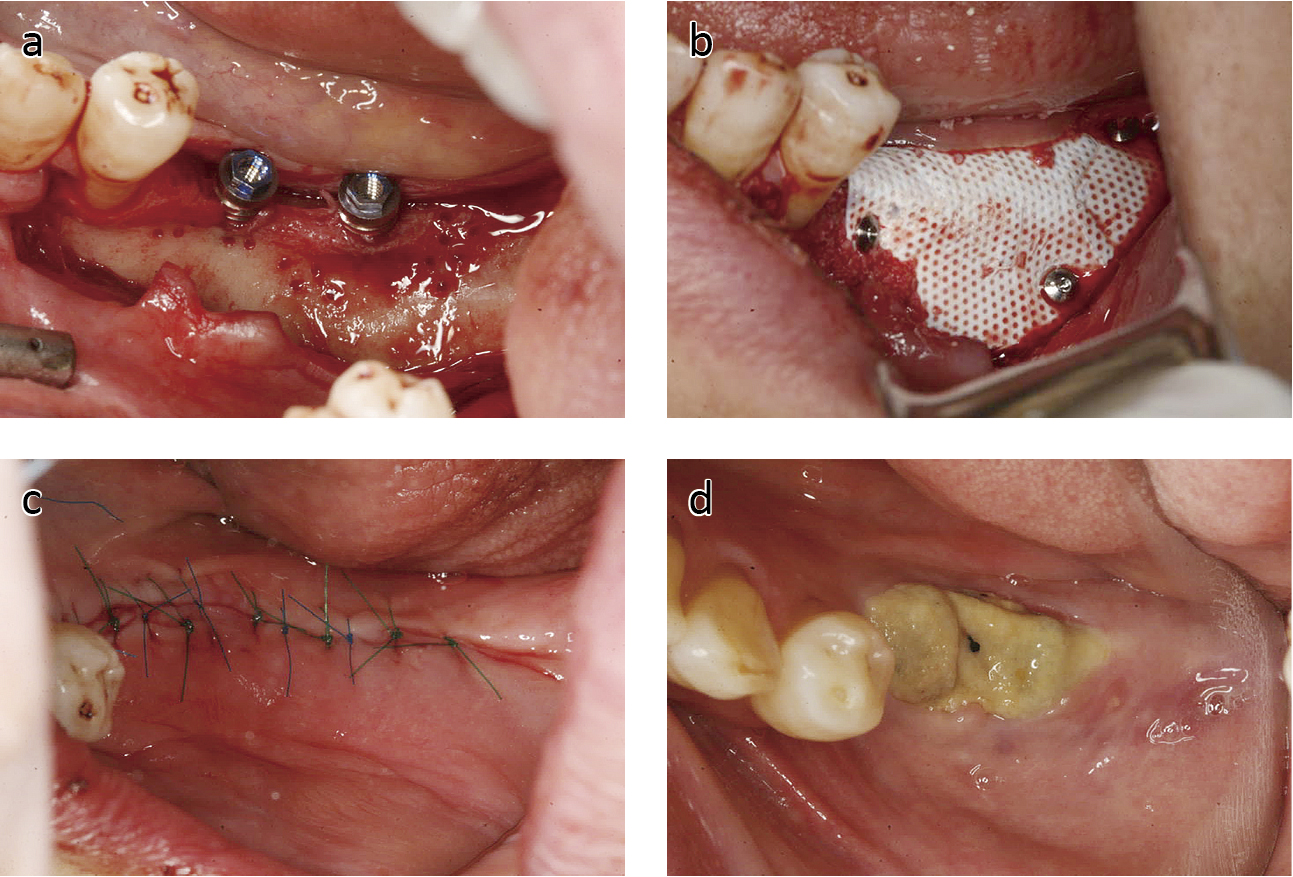
Conventional GBR technique.
a, b) After fixture and bovine bone mineral placement, the titanium-reinforced membrane covering the regeneration materials was fixed on the surrounding bone surface using 4 bone tacs.
c) After extensive releasing incisions, tension free flaps were sutured.
d) After 2 weeks, the membrane became exposed due to retraction of the thin overlying flap. In order to manage this problem, the exposed membrane as well as the surrounding inflamed gingival tissue was disinfected once a week using chlorhexidine gluconate solution.
このように既存の術式ではそれぞれ利点欠点が存在する.そのため,著者らはメンブレンを使用せずレーザー光で血餅を形成し移植骨の形態を維持安定化させる術式Er:YAG laser-assisted bone regenerative therapy(Er-LBRT)を開発した(Fig.2).Er-LBRTはEr:YAGレーザーを補助的に用いた骨造成手術の総称で,歯科における骨再生治療での大部分を占める歯周組織再生治療,インプラント周囲骨再生治療にメンブレンを使用した術式に代わり用いることができる40,41).
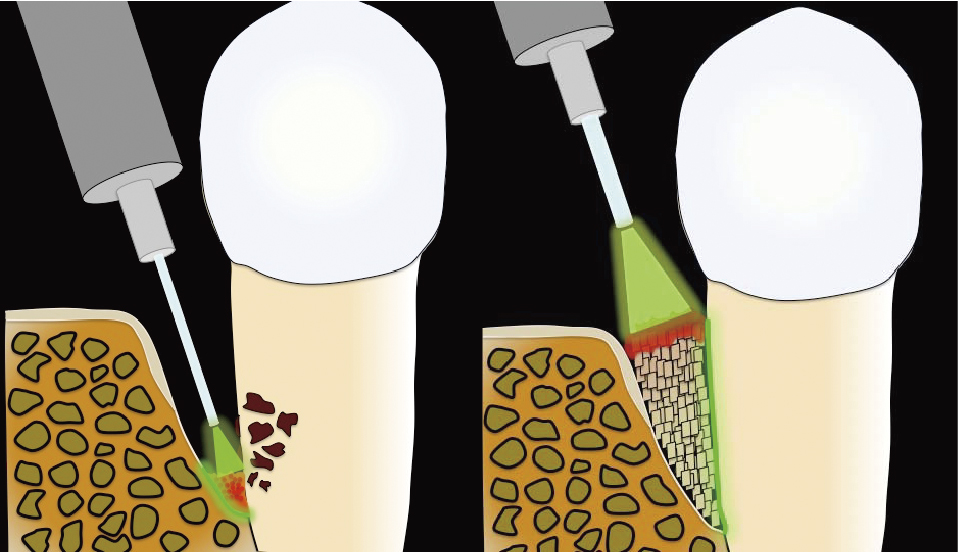
Er-LBRT Illustration.
After conventional mechanical debridement, remaining calculus and granulation tissue are debrided using Er:YAG laser. Enamel matrix protein derivative is applied to the root surface, the bone graft is adapted into the bone defect, and blood coagulation is formed on the grafted bone using the Er:YAG laser. [Modified pictures and legend from Taniguchi, Y. et al. A novel surgical procedure for Er:YAG laser-assisted periodontal regenerative therapy: case series. Int J Periodontics Restorative Dent 36: 507-515, 2016. © copyright (2016) Quintessence Publishing Co, Inc.]
Er-LBRTの術式は浸潤麻酔後,歯間乳頭保存術を併用し切開剥離を行う.デブライドメントは既存の器具とEr:YAGレーザーを併用し行う.手用器具と超音波スケーラーにて歯冠側の比較的大きい炎症性肉芽組織および歯石を除去し,歯根陥凹部,狭い骨吸収底部はEr:YAGレーザー(Erwin AdvErLTM; J. Morita Mfg. Co., Osaka, Japan)を20 Hz,パネル値70 mJ/pulse,注水下,接触照射の条件で,骨欠損形態に合わせC400F,C600F,C800Fのチップを選択し,細部に到るまで徹底的にデブライドメントを行う.歯周組織再生治療に応用する症例では,移植骨と根面の界面における再生を促すため,エナメルマトリックスタンパク製剤(EMDOGAIN® GEL; Straumann, Basel, Switzerland)を根面に塗布する.続いて自家骨を血液と混和し骨欠損内に移植後,移植骨表面にEr:YAGレーザーを20 Hz,50 mJ/pulse,非注水,3–4 mm程度のデフォーカス,スイーピングモーションで照射を行い血餅形成し,移植骨の形態の維持安定化を図る.
再生治療にEr:YAGレーザーを用いる利点は,既存の手用器具では除去困難であった細部の炎症性肉芽組織,歯石,インプラント体表面に付着している石灰化物のデブライドメントが容易かつ徹底的に行えることに加え,Er-LBRTの術式の特徴でもある移植骨最外層のみに限局した血餅形成を行うことにより,メンブレンを使用せず血餅にて移植骨形態の維持を補強することである.
また,既存の器具を併用するメリットとして,Er:YAGレーザーとハンドキュレットおよび超音波スケーラーを併用することにより,Er:YAGレーザー単独では不得手とする比較的大きい歯石や炎症性肉芽組織を効率良く除去することが可能となる.手用器具と比較しEr:YAGレーザーはデブライドメント時の手指感触が劣るため,細部のデブライドメントの確認としてハンドキュレットを併用することも有効であるが,ハンドキュレットでのデブライドメント後にはスメアー層が残存するので,最終的な仕上げにはEr:YAGレーザーを用いることを推奨する.
これらの利点を活かし偶発症に対する低リスクの再生治療が容易かつ可能となった.しかしながら,本邦ではインプラント周囲炎治療時にEr:YAGレーザーを用いる場合は薬事法で定められた使用方法の適応の範囲外であり,本稿では東京医科歯科大学歯学部倫理委員会の承認のもと,患者の同意を得て実践された症例を用い歯周組織再生治療,インプラント周囲炎治療へのEr-LBRTの応用を解説する.
Er-LBRTは歯周組織再生治療を元法とし,治療を効果的かつ効率的に行う目的で開発された40).Fig.3はEr-LBRTを応用した症例である.患者は46歳女性で,歯周病の治療を主訴として来院し検査の結果,二次性咬合性外傷を伴う広汎型重度慢性歯周炎と診断し,歯周組織再生治療を行う同意を得た.切開剥離は既存の再生治療の術式と同様に行い,歯間乳頭および辺縁歯肉を全層弁にて翻転した.垂直性骨欠損部歯冠側の比較的大きい炎症性肉芽組織と歯石はキュレット等の手用器具を用いて大まかに除去を行い,根尖側の狭い骨欠損内の炎症性肉芽組織および残存歯石をEr:YAGレーザーを用いデブライドメントした(Fig.3a–d).デブライドメント後,エナメルマトリックスタンパク製剤を根面に塗布し,手術部位近傍より採取した自家骨を血液と混和し骨欠損内に移植する(Fig.3e, f).移植骨表面にEr:YAGレーザーを非注水のデフォーカス条件で用い血餅形成し,縫合した(Fig.3g).治癒期間に手術部位に裂開や感染は認められなかった.12ヵ月後,術前と比較しデンタルエックス線写真では,残存歯槽骨頂まで再生が認められる(Fig.3h, i).またリエントリー時には1壁性の部位を越え歯槽骨の再生が確認できた(Fig.3j).

Periodontal regenerative therapy with Er-LBRT: Case 1.
a) Before surgery, probing depths were 9 mm, with bleeding on probing at the mesial sites of 34 and 35.
b) Deep angler bone defects were observed on the mesials of 34 and 35 on the dental radiograph.
c) Sub-gingival calculus and granulation tissue were debrided using conventional hand instruments. Then, residual calculus and granulation tissue were completely and thoroughly debrided using an Er:YAG laser.
d) After debridement, the deep angler bone defect was consisted of a 3-wall defect apically and a 1-wall defect coronally.
e) Autogenous bone was harvested from alveolar bone near the surgical site using a bone scraper.
f) Enamel matrix protein was applied to the debrided root surface, and the harvested autogenous bone was adapted into the bone defect.
g) Blood clot was formed by inducing blood coagulation using Er:YAG laser irradiation, in non-contact mode, without water spray, on the grafted bone surface.
h) After 12 month, soft tissue healing was favorable without any complications.
i) 12 months post-surgery, the bone defect appeared filled, as evidenced by the radiographic appearance of regenerated bone.
j) On surgical reentry, dramatic bone regeneration was observed extending beyond the original alveolar ridge height.
[Modified pictures and legend from Taniguchi, Y. et al. A novel surgical procedure for Er:YAG laser-assisted periodontal regenerative therapy: case series. Int J Periodontics Restorative Dent 36: 507-515, 2016. © copyright (2016) Quintessence Publishing Co, Inc.]
Fig.4では粘膜も薄く,骨欠損形態も通常は再生治療が困難であろう重篤な病態においても,本術式は十分な効果示したので症例を提示し解説する.患者は24歳女性,下顎前歯部の動揺を主訴に来院した患者で,限局型侵襲性歯周炎と診断し,病態の説明後に再生治療を希望した.術前診断の結果,歯根周囲に再生の基盤となる骨壁の存在しない1壁性の骨吸収であり,また頬側骨は水平性に吸収していた(Fig.4a).切開剥離後,Er:YAGレーザーを用い徹底的にデブライドメントを行い,エナメルマトリックスタンパク製剤,自家骨移植,移植骨表面に血餅を形成し縫合を行った(Fig.4b–f).12ヵ月後,デンタルエックス線写真では残存歯槽骨頂まで骨の再生を認めた.菲薄な歯間乳頭に僅かな退縮が認められるが,軟組織の治癒に異常は認められない(Fig.4g).12ヵ月後の歯槽骨の再生は十分であったが,患者は審美性の回復も希望したため,遊離結合組織移植を併用した歯間乳頭の再建を行った.歯間乳頭再建時,患歯遠心の1壁性の骨吸収と水平的骨吸収を呈していた部位に十分な骨再生が確認できる(Fig.4h).歯間乳頭再建から12ヵ月後,遊離結合組織は生着し軟組織の垂直的ボリュームの増加による審美性の回復が達成された(Fig.4i).この結果から,再生骨は軟組織移植のレシピエントサイトとしても十分に対応可能な血流を持つ骨組織であることが示唆された.

Periodontal regenerative therapy with Er-LBRT: Case 2.
a) Before surgery, a deep angler bone defect was observed on the distal of 31 on the dental radiograph.
b) The root surface and granulation tissue were debrided using Er:YAG laser irradiation in non-contact mode with water spray.
c) After debridement, the bone defect was consisted of a 1-wall defect with horizontal bone resorption.
d) Enamel matrix protein was applied to the debrided root surface, and the autogenous bone was adapted to the root surface and bone defect.
e) Blood clot was formed using Er:YAG laser irradiation in non-contact mode without water spray.
f) After blood clot formation, the grafted bone was stabilized without using a membrane.
g) After 12 months, soft tissue hearing was favorable. And the angler bone defect was filled with regenerated bone on the dental radiograph.
h) At interdental papilla reconstruction surgery using connective tissue grafting (re-entry surgery), the bone regeneration was observed in the original 1-wall bone defect with horizontal bone resorption.
i) After 12 months from the papilla reconstruction surgery, the interdental papilla was reconstructed onto the regenerated bone.
Er-LBRTの臨床効果を後ろ向き研究として6名の患者(9部位)の治療データを抽出,解析したところTable 1に示す良好な結果を得た.特にプロービング深さの改善とデンタルエックス線写真上での骨欠損の減少量およびクリニカルアタッチメントレベルは術前と比較し有意に改善を示した(東京医科歯科大学歯学部倫理委員会承認:840号).
| Patent number | 1 | 2 | 3 | 4 | 5 | 6 | Mean ± SD | |||
| Case number | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| sex | F | F | F | M | F | F | F | F | F | |
| age | 46 | 46 | 69 | 36 | 63 | 63 | 65 | 65 | 24 | 53.0 ± 14.8 |
| Treatment area | 34MB | 35MB | 21MB | 14MB | 14MB | 46D | 45ML | 13MB | 31D | |
| Type of bone defect | 3 + 1 wall | 3 + 1 wall | 2 + 1 wall | 2 + 1 wall | 3 + 1 wall | 2 + 1 wall | 2 + 1 wall + dehiscence | 3 + 1 wall + dehiscence | 1 wall+dehiscence | |
| PD (base line) | 6 | 7 | 6 | 8 | 4 | 6 | 6 | 9 | 4 | 6.2 ± 1.5 |
| PD (12 month) | 2 | 2 | 1 | 3 | 1 | 2 | 3 | 3 | 1 | 2.0 ± 0.8* |
| PDR | 4 | 5 | 5 | 5 | 3 | 4 | 3 | 6 | 3 | 4.2 ± 1.0 |
| BOP (base line) | + | + | + | + | + | + | + | + | + | |
| BOP (12 month) | − | − | − | − | − | − | − | − | − | |
| CAL (base line) | 9 | 9 | 8 | 9 | 7 | 6 | 6 | 9 | 5 | 7.5 ± 1.4 |
| CAL (12 month) | 4 | 3 | 3 | 6 | 3 | 3 | 3 | 3 | 3 | 3.4 ± 0.9* |
| CAG | 5 | 6 | 5 | 3 | 4 | 3 | 3 | 6 | 2 | 4.1 ± 1.3 |
| IDD (base line) | 6.4 | 5.6 | 7.7 | 5.6 | 6.4 | 2.4 | 6.9 | 8.6 | 9.7 | 6.4 ± 2.1 |
| IDD (12 month) | 0.2 | 1.2 | 3.3 | 0.5 | 0.2 | 0.1 | 2.3 | 1.4 | 1.1 | 1.1 ± 1.0* |
| IDDR | 6.2 | 2.8 | 4.4 | 5.1 | 6.2 | 2.3 | 4.6 | 7.2 | 8.6 | 5.2 ± 1.9 |
(mm, n = 9)
PD: probing depth, PDR: probing depth reduction, BOP: bleeding on probing, CAL: clinical attachment level, CAL gain: clinical attachment level gain, IDD: intrabony defect depth, IDDR: intrabony defect depth reduction. *p < 0.01 relative to the base line value.
[Modified table from Taniguchi, Y. et al. A novel surgical procedure for Er:YAG laser-assisted periodontal regenerative therapy: case series. Int J Periodontics Restorative Dent 36: 507-515, 2016. © copyright (2016) Quintessence Publishing Co, Inc.]
インプラント周囲炎とは,インプラント周囲のプラークコントロール不良により細菌感染による炎症が波及し,フィクスチャーを支持している骨が吸収を起こす病態であり,インプラント治療後の長期的問題の一つである42,43).歯周炎と比較しインプラント周囲炎治療は困難であり,フィクスチャー表面にはスレッドが存在するため根面より凹凸が多くデブライドメントの妨げになる44).さらに近年はオッセオインテグレーションを促進させる目的で,フィクスチャー表面にマイクロストラクチャーが付与されており,既存のキュレットや超音波スケーラーではミクロレベルでの除菌が困難であり,完全なデブライドメントは不可能となっている45,46).Er:YAGレーザーは近年の動物研究でフィクスチャー表面のデブライドメントにも有効性が示されており,出力および注水条件を調整することにより表面の損傷を抑え,徹底的な除染が可能であることが示されている45-47).
実際の照射条件としては,現在最も多く臨床応用されている中等度の粗面のフィクスチャーにおいては,出力30 mJ/pulse,注水下,非接触スイーピングモーションでの照射が適しており,この条件であれば,フィクスチャー表面を溶融することなく効果的なデブライドメントが可能であり,インプラント周囲炎にて撤去された,汚染物が付着したフィクスチャーを本レーザーでデブライドメントをした場合に,元素分析によりその除染能力が明らかにされている45).また,臨床的にEr:YAGレーザーをインプラント周囲炎治療時のデブライドメントに応用し,良好な効果をもたらすことが文献により示されているが48,49),さらに本稿ではフィクスチャー表面の除染とEr-LBRTを組み合わせることにより,インプラント周囲炎に罹患したフィクスチャー周囲にもメンブレンを使用せず十分な骨の再生が可能であることが示された.
Fig.5はインプラント周囲炎にEr-LBRTを応用した74歳男性の症例であり,切開剥離後,炎症性肉芽組織とフィクスチャー表面をパネル値30mJ/pulse,注水下,非接触照射の条件で徹底的にデブライドメントを行った(Fig.5a–d).フィクスチャーのデブライドメントはチタンの融点が約1,600度付近であるため,定点照射の実験では表面の溶融を引き起こし,さらに注水により瞬時に冷却されて起る微細な亀裂が確認されている.そのため,インプラント表面の損傷を極力回避する条件で照射を行なった.さらに本症例では陽極酸化処理の表面性状を付与されたフィクスチャーであるため,マイクロストラクチャーは蒸散されるが45),マイクロストラクチャー下に存在する母床金属を溶融しないよう注意しデブライドメントを行なった45-47).デブライドメント後,骨欠損部に骨移植材料(Bio-Oss®; Geistlich Pharma AG, Wolhusen, Switzerland)を填入し表面に血餅を形成し縫合を行なった(Fig.5e–f).12ヶ月後のデンタルエックス線写真ではプラットフォームまでの骨再生が確認でき,インプラント周囲粘膜に発赤等の炎症は認められない(Fig.5g–h).(本術式及び使用材料は東京医科歯科大学歯学部倫理委員会承認:551号)

Peri-implantitis treatment with Er-LBRT.
a) Inflammation and bone resorption were observed around the distal implant.
b) After flap reflection, the microstructure surface was exposed into the bone defect. The bone defect was filled with the diseased granulation tissue.
c) The fixture surface and the granulation tissue was debrided using Er:YAG laser under the condition of non-contact mode with water cooling.
d) After debridement, obvious thermal damage to the microstructure surface, such as discoloration and carbonization was not observed.
e) Blood mixed bovine bone mineral was grafted into the bone defect up to the same height of fixture platform.
f) Blood clot was formed using Er:YAG laser under the condition of non-contact mode without water spray.
g) After 6 month from Er-LBRT, the soft tissue hearing process was a favorable condition.
h) After 12 month, the bone defect was filled with regenerated bone at the same height of platform on the dental X-ray photograph.
また,本症例で用いた骨移植材料(Bio-Oss)には成長因子等のタンパクは含まれておらず,レーザー照射は骨移植材の成分にとくに変化を及ぼしてはいないと推測され,レーザーと骨移植材との相互作用は生じていないと考えられる.しかし,レーザーによる骨面のデブライドメント時には骨組織(骨細胞)を刺激し50),また,レーザー照射により血餅形成の促進を行う際には,血小板や細胞成分の活性化を生じている可能性があり,レーザーが骨再生に有利に働いていることが考えられる.これらの点については,今後Er-LBRTの基礎研究を行い,その作用の詳細を明らかにする必要がある.
Er:YAGレーザーの登場は,歯周およびインプラント周囲の再生治療に様々な変化をもたらしつつある.現在の歯科における再生治療の潮流としては,大幅な骨再生にメンブレンの使用は欠かせないとされている37-39).しかし,比較的規模の大きい骨欠損においても,Er:YAGレーザーを用いての血餅形成によりメンブレンを使用せず十分に再生が可能であることが臨床上示されている.現時点では,骨再生におけるEr:YAGレーザーの直接の作用を示す基礎的・臨床的な明確なエビデンスは得られていないが,本稿で示したように,Er-LBRTの非常に容易化された臨床術式とこれまでに得られている良好な骨組織再生の臨床成績により,歯周組織再生においてレーザーの効果が作用している可能性が推測される.一方で,2018年には米国歯周病学会より,歯周外科治療におけるレーザーの応用においては付加的な効果は認められないとのコンセンサスリポートが出されている51).しかし,レーザーは設定条件や応用方法が多彩であるため各論文間での比較は難しく52,53),特に本Er-LBRT法では特異的な応用を行っているため,過去の臨床結果は必ずしも直接の参考にならないと考えられる.また,歯周外科およびインプラント周囲外科治療においてレーザーは,臨床成績の向上だけでなく,実際には徹底的なデブライドメントの効率化などの手技上の容易化も目的として応用されている.従って,今後は基礎と臨床の両面から,Er-LBRT応用後の組織再生機序も含め,臨床成績の向上におけるレーザーの作用に関してさらなる研究を行う必要がある.
利益相反なし.
本稿の執筆にあたり,御協力いただいたWalter Meinzer先生に感謝申し上げます.