2022 年 43 巻 2 号 p. 113-119
2022 年 43 巻 2 号 p. 113-119
GaAlAs半導体レーザー(810 nm)は象牙質・歯髄複合体での硬組織形成を促進させることから,歯髄保存療法の予知性向上に寄与する可能性がある.その機構は,歯髄の可逆性組織傷害に対する修復機転に基づくと思われるが,詳細は明らかでない.そこで著者らは,同レーザーをラット臼歯に照射後,象牙芽細胞分化マーカー(熱ショックタンパク25)発現細胞の挙動や非コラーゲン性基質タンパク質の発現動態を解析した.本稿ではその成績を概説するとともに,同レーザーによる硬組織形成促進機構を考察する.
GaAlAs diode laser (810 nm) is known to induce mineralized tissue formation in dentin/pulp complex, and thus may contribute to the improvement in the predictability of vital pulp therapy. The mineralized tissue formation may involve the reparative process that takes place after injury of the dental pulp, whereas the detailed mechnisms remain to be elucidated. Thus, the authors examined the dynamics of cells expressing an odontoblast differentiation marker (heat-shock protein 25) and analyzed the expression of non-collagenous matrix proteins in diode laser-irradiated rat molars. The purpose of this paper is to review our experimental findings and discuss mechanisms behind the diode laser-induced mineralized tissue formation in dentin/pulp complex.
レーザーはこれまで歯内療法の領域において,歯髄の診断(レーザードップラー法など),象牙質知覚過敏症の治療,感染根管の殺菌(根管内照射,レーザー洗浄法),外科的歯内治療(根面や肉芽組織の郭清,逆根管充填用窩洞形成)などの多彩な応用が試みられている1-3).加えて,生活歯へのレーザー照射が象牙質・歯髄複合体での硬組織形成促進作用を示すことが1980年代より報告されており4-6),歯髄保存療法の予知性向上や新たな歯髄保存療法の開発につながることから,長きに渡って注目されている.これは,新生硬組織が歯髄を覆う硬組織の厚みを増加させ,外部から歯髄に到達する刺激を遮断する防御的役割を演じることを,最大の理由とする.
GaAlAs半導体レーザーは組織透過性レーザーに分類され,水分および血中ヘモグロビンに対する吸収係数が低いことから,低出力で生体深部まで到達できることを特徴とする.歯科領域での半導体レーザーの応用については,高出力では主に組織の切開・凝固・蒸散に用いられ,また低出力では顎関節症の疼痛7),抜歯後疼痛8),感染根管治療後の疼痛9)あるいは象牙質知覚過敏症の疼痛10-12)などの緩和などに有効とされる.さらに半導体レーザーの硬組織に対する作用として,骨形成の促進13,14)や象牙質形成の促進15-20)が報告されている.特に後者については,象牙質・歯髄複合体における創傷治癒の促進,あるいは確実な硬組織形成による歯髄保存療法の予知性向上などに寄与する可能性が注目されている.
本項では,GaAlAs半導体レーザーの象牙質・歯髄複合体に対する硬組織形成促進作用について,著者らの解析結果を中心にその機序を考察する.
レーザーの象牙質・歯髄複合体に対する硬組織形成促進機構は,損傷された象牙質・歯髄複合体で営まれる創傷治癒・修復機構と密接に関わると考えられる.すなわち,象牙質・歯髄複合体の創傷治癒は,その過程で新生硬組織の形成を伴うことを大きい特徴とする.
う蝕や外傷により象牙質に損傷が生じると,主として口腔内細菌に由来する刺激侵襲が象牙細管を経由して歯髄に到達し歯髄疾患が生じるが,象牙質損傷部にう蝕の除去・修復などの適切な処置が施された場合は,細菌の影響が排除されるとともに象牙質・歯髄複合体の防御・治癒機転が作動し,歯髄疾患が回復に赴く.
象牙質・歯髄複合体における組織修復の様相は加わった刺激の種類や強さにより異なるが,象牙質の傷害が生じた部位では多くの場合,同部に存在する象牙芽細胞の死滅とともに,その近傍の歯髄に局所的な炎症や変性・壊死が生じる.しかしながら,適切な歯髄保護が行われた場合は炎症の消退に続いて営まれる治癒の進展に伴い,新たな硬組織形成細胞(新生象牙芽細胞様細胞)が歯髄最表層に再び配列し,同部に新生硬組織(修復象牙質)が形成される.この過程で,歯髄内の組織幹細胞や前駆細胞が増殖・遊走を経て新生象牙芽細胞様細胞に分化すると考えられている21).一方,歯髄に加えられた刺激が軽度あるいは緩徐な場合は既存の象牙芽細胞は死滅せず炎症の消退とともに象牙質形成に転じると考えられており,この機序により形成された新生象牙質は反応象牙質と称される21).
2.2 各種レーザーによる歯髄傷害と新生硬組織形成レーザー照射による歯髄傷害の有無,程度については,レーザーの種類や照射条件,術後の観察期間,さらには実験動物種などの多くの条件の相違から,一定の見解は必ずしも得られていない.しかしながら,象牙質知覚過敏処置を想定したネコ犬歯へのパルス波Nd:YAGレーザー照射後22),ラット臼歯へのパルス波Nd:YAGレーザー照射後23),あるいはラット臼歯へのGaAlAs半導体レーザー(810 nm)照射後15)において,術後数時間から数日経過時点で照射部近傍を中心に局所的な歯髄壊死や炎症性細胞浸潤などの傷害性変化が観察されている.ラット臼歯にEr:YAGレーザーで窩洞形成を行なった場合も,照射後数時間で照射部近傍の象牙芽細胞が死滅することが観察されている24).ところが観察期間の延長により歯髄で硬組織形成が生じることも確認されており10-15,23,24),歯髄の組織傷害は可逆的で,続いて硬組織形成を伴う創傷治癒が展開されることが示唆される.
一方,ヒト臼歯にEr:YAGレーザーで窩洞形成を行なった研究では,術後一週で明瞭な歯髄傷害は観察されておらず25),レーザーの種類や照射条件によっては組織傷害を最小限とすることも可能であることが示唆されるとともに,同レーザーがう蝕の除去や窩洞形成に応用できることの根拠となっている.
いずれにしても,生活歯にレーザー照射を行った場合,照射後の初期反応として歯髄に可逆性の傷害性変化が誘発されるとの見解が主流であり,新生硬組織形成は象牙質・歯髄複合体で組織傷害を契機として展開される修復機構をその本態とするものと考えられる.
上述のように,GaAlAs半導体レーザーは低出力で生体深部まで到達できることを特徴とし,ラット臼歯歯冠(非切削)への照射により象牙質・歯髄複合体における硬組織形成を促進させることが示されている15).ヒト小臼歯への窩洞形成後16,17),あるいはサルに対する直接覆髄後18)に半導体レーザーを照射した場合も硬組織形成の促進が観察されている.
また,半導体レーザーは象牙質知覚過敏症における疼痛緩和に広く応用されており,その有効性を支持する多数の臨床研究もなされている10-12).その機序の一つとして,新生硬組織が象牙細管の歯髄側開口部を封鎖する形で形成され,動水力学的機構による痛みの発生が抑制されるというメカニズムが推察されている.
ところが半導体レーザー照射後の硬組織形成過程について解析した報告は限られている.そこで本稿では,ラット臼歯(非切削)に対するGaAlAs半導体レーザー(810 nm)照射後の象牙芽細胞の応答,あるいは硬組織関連非コラーゲンタンパクの発現動態についての著者らのデータ19,20)を提示し,考察を加えたい.なお,本研究は新潟大学実験動物委員会の承認を得て行った(承認番号47-3).
3.1 GaAlAs半導体レーザー(810 nm)照射後の新生硬組織形成と象牙芽細胞の挙動生後8週齢Wistar系雄性ラットの上顎第一臼歯に対し,GaAlAs半導体レーザー装置(発振波長810 nm,連続発振,コア径0.6 mmの石英ファイバーの先端部を直径0.1 mmの円錐状に加工した接触型;オサダライトサージ3000,長田電機工業,東京)を使用して,出力0.5 Wもしくは1.5 W,60秒3回連続照射の条件で,チップを歯冠近心面に接触させた状態でレーザーを照射した.コントロールには非照射のラット上顎第一臼歯を用いた.照射直後あるいは照射1~21日後に動物を安楽死させたのち,被験歯を組織学的解析,象牙芽細胞の分化マーカーである熱ショックタンパク25(heat-shock protein 25; HSP-25)26)に対する免疫組織化学的解析,およびブロモデオキシウリジン(BrdU)標識法による増殖細胞の挙動解析に供した.
その結果,半導体レーザー照射部による歯質の欠損は生じなかったが,照射部近傍を中心に歯髄に傷害性変化が誘発されたのち,新生硬組織形成を伴う治癒が生じることが確認された.HSP-25に対する免疫染色によりレーザー照射に対する象牙芽細胞の応答を明瞭に観察可能であった.
0.5 W群(Fig.1)では,照射直後に照射部直下での象牙芽細胞の配列の乱れとHSP-25陽性反応の減弱や消失がみられたが(Fig.1b, f),1日後ではHSP-25陽性象牙芽細胞は概ね再配列し(Fig.1c, g),14日経過後以降では細管構造を有する新生硬組織の形成が照射部直下に限局性に観察された(Fig.1d, h).これらの新生硬組織は,HSP-25陽性の象牙芽細胞突起がしばしば原生象牙質まで連続しており,主として反応象牙質に分類された.
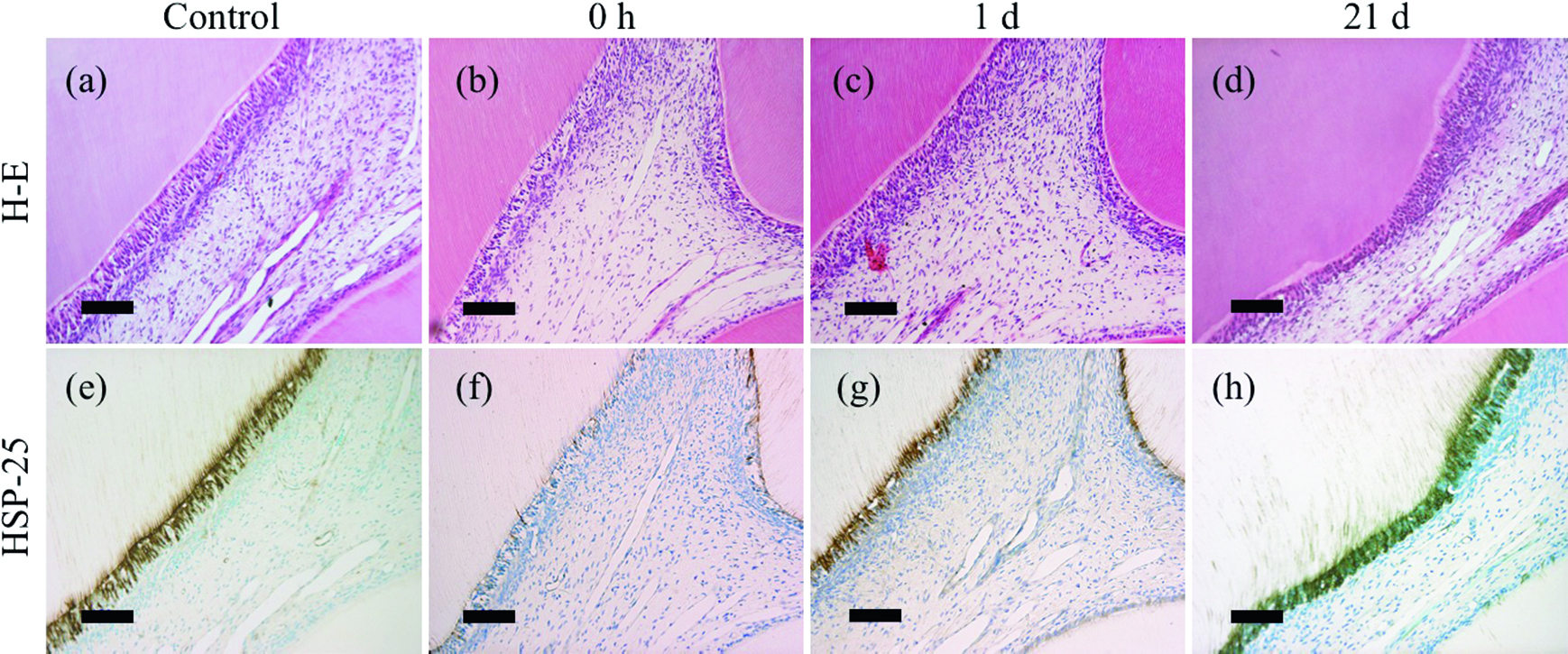
Representative photomicrographs of rat upper first molars after irradiation of GaAlAs diode laser at an output power of 0.5 W. (a,e) Control (no irradiation). (b, f) Immediately, (c, g) 1 day, and (d, h) 21 days after irradiation. (a-d) Hematoxylin and eosin (H-E) staining. (e-h) Immunoperoxidase staining for heat-shock protein 25 (HSP-25). Bars = 100 μm.
一方1.5 W群(Fig.2, 3)においては,照射直後から3日後まで照射部近傍のHSP-25陽性象牙芽細胞は消失しており,3日後では歯髄組織に顕著な変性が観察された(Fig.2a, d),5日後では同部に細胞の再分布が観察されるとともに,少数のHSP-25陽性細胞が確認された(Fig.2b, e).7日後よりレーザー照射部近傍にHSP-25陽性の象牙芽細胞様細胞の配列と少量の新生硬組織形成が認められ(Fig.3a, b),14日後ではHSP-25陽性の象牙芽細胞様細胞の配列はより明瞭になり,不規則な細管構造を有する修復象牙質の形成が観察された(Fig.2c, f).照射部の中心からやや離れた根尖側では反応象牙質が観察される例もみられたが,これらはHSP-25陽性の象牙芽細胞様細胞の突起が既存の象牙質にまで連続して観察されることで修復象牙質と区別可能であった(Fig.2f).21日後(Fig.3e-l)では,HSP-25陽性細胞の配列を伴う細管象牙質(修復象牙質および反応象牙質)の形成を示す試料(Fig.3e, f),およびHSP-25陽性細胞もしくは陰性の細胞の封入を伴う骨様の新生硬組織(以下,骨様組織)の形成を示す試料(Fig.3i, j)の両者がみられた.
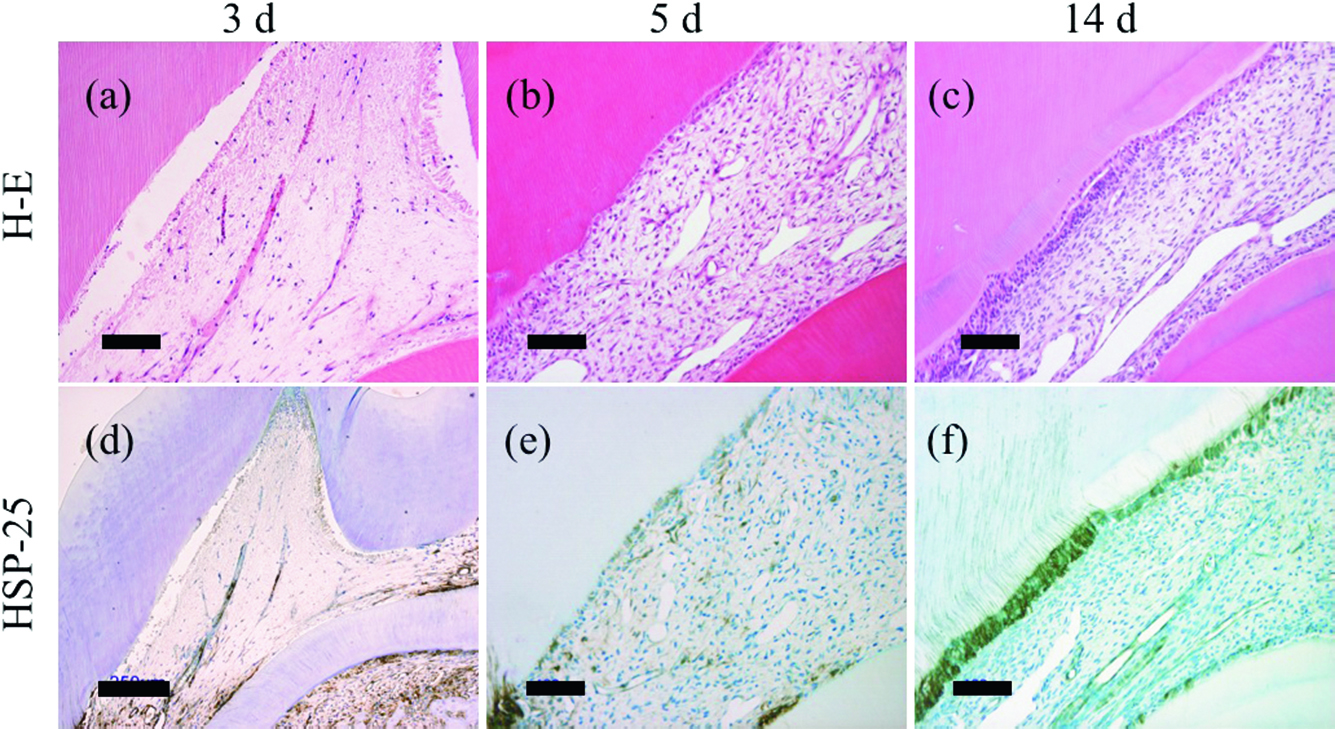
Representative photomicrographs of rat upper first molars after irradiation of GaAlAs diode laser at an output power of 1.5 W. (a, d) Three days, (b, e) 5 days, and (c, f) 14 days after irradiation. (a-c) Hematoxylin and eosin (H-E) staining. (d-f) Immunoperoxidase staining for heat-shock protein 25 (HSP-25). Bars = 250 μm (d) and 100 μm (others).
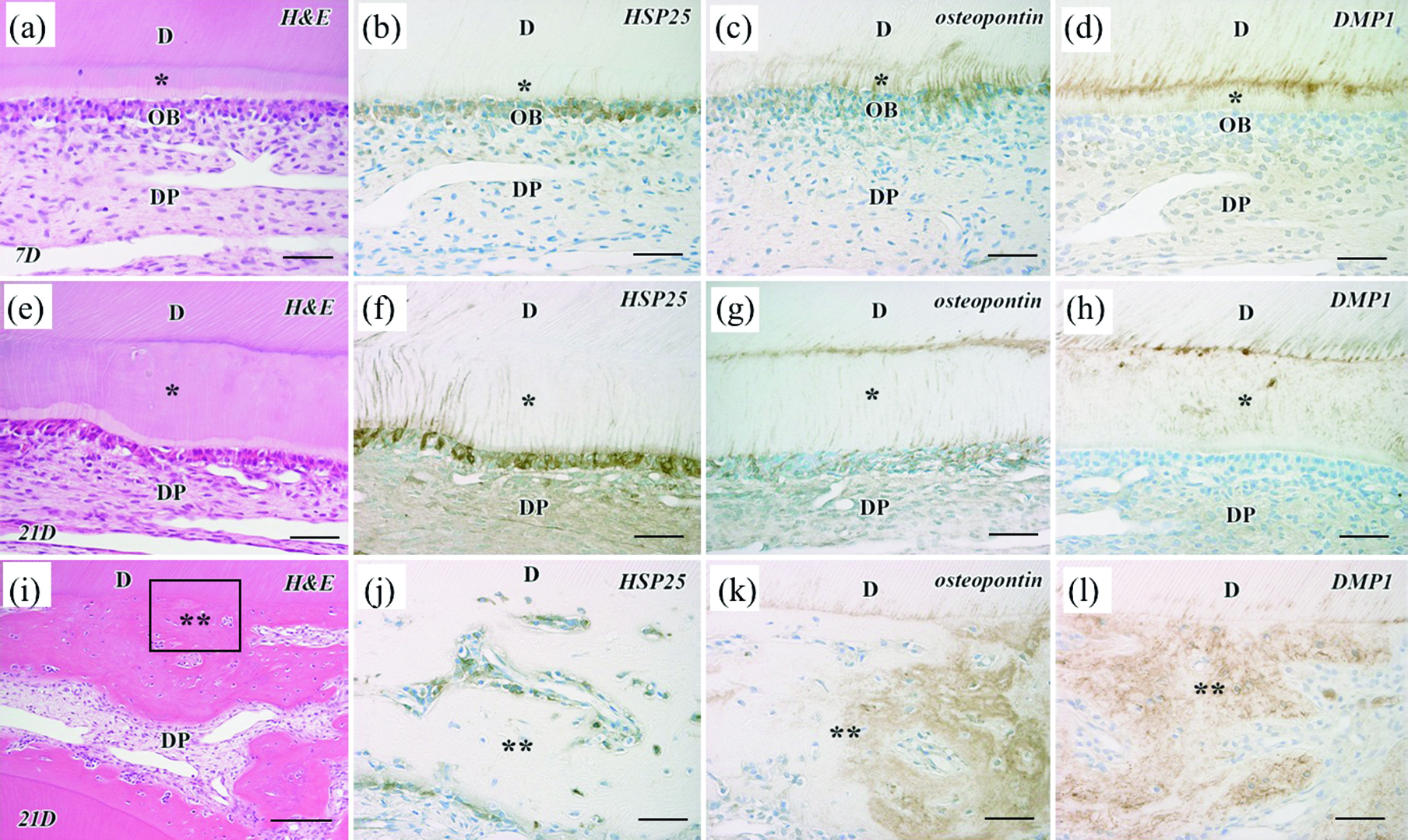
Representative photomicrographs of rat upper first molars at 7 days (a-d) or 21 days (e-l) after irradiation of GaAlAs diode laser at an output power of 1.5 W. (e-h) A specimen showing reparative dentin formation. (i-l) A specimen showing bone-like tissue formation. (a, e, i) Hematoxylin and eosin (H-E) staining. (b, f, j) Heat-shock protein 25 (HSP-25), (c, g, k) osteopontin, and (d, h, l) dentin matrix protein 1 (DMP1) immunoperoxidase staining. D, dentin; DP; dental pulp; *, reparative dentin; **, bone-like tissue. Bars = 100 μm (i) or 50 μm (a-h, j-l). Reproduced with modification from Shigetani et al.20) with permission.
BrdU陽性細胞は1.5 W群でのみ検出され,照射後3日をピークとして2~5日で有意な増加を示した19)(データ示さず).
以上に述べた歯髄の反応は,基本的には過去の報告15)と同様であり,レーザーのエネルギーの多寡に応じて照射部近傍の象牙芽細胞および歯髄組織に傷害性の変化が生じたのち,歯髄に備えられる修復機構が作動して新生硬組織形成を伴う治癒が生じる過程を反映したものと考えられる.レーザー照射部には歯質欠損が生じなかったことから,細菌性因子による負の影響を被ることなく組織修復が進行したと思われる.
0.5 W群では主として反応象牙質の形成が観察されたが,この群では照射1日後にすでにHSP-25陽性の象牙芽細胞様細胞の配列が確認されたことから,低エネルギー条件の照射であることを反映して,既存の象牙芽細胞の多くが細胞死に至ることなく硬組織形成に転じたと考えられる.
1.5 W群ではレーザー照射に対する初発反応としてHSP-25陽性象牙芽細胞は消失したものの,その後はBrdU陽性細胞の一過性の増加を伴う歯髄の組織修復の進展とともに,HSP-25陽性の新生象牙芽細胞様細胞がレーザー照射部の歯髄-象牙境に再配列したのち新生硬組織が形成された.この所見は,歯髄内に生存する間葉系幹細胞や前駆細胞が増殖・遊走を経てHSP-25陽性を示す新生象牙芽細胞様細胞に分化する過程を反映したものと考えられる.ラット臼歯への窩洞形成後では,HSP-25陽性細胞が歯髄-象牙境で一旦消失したのち再配列し,その後に細胞分裂が活発となるとの所見から,象牙芽細胞下層に存在する前駆細胞の遊走と最終分化が初発反応として生じる可能性が提示されている26).今回の条件では象牙芽細胞下層の前駆細胞は細胞死に陥り,この種の機構は作動しなかったものと推測される.また,照射部の中心から離れた部位では反応象牙質もみられたが,これについては,レーザーのエネルギーが低レベルにとどまった領域では既存の象牙芽細胞が死滅することなく硬組織形成に転じたことを反映したと考えられる.
骨様組織の形成機構は明確といえないが,照射2週後までは骨様組織に相当する明確な形態的特徴を示す硬組織が認められなかったことから,形成初期段階の機構は修復象牙質と共通であると推察される.その後,硬組織形成が何らかの理由で急速に進展し,周囲の細胞が取り込まれ骨様の形態を呈するに至ったのであろう.一方,マウス臼歯の再植後では,歯髄幹細胞の死滅が骨様組織の形成に関連することが示唆されている27).さらに,歯髄幹細胞が骨系細胞への分化能を備えるとの報告もあり28),骨芽細胞様細胞が歯髄内に出現し骨様象牙質形成に関与した可能性も皆無と言えない.
3.2 半導体レーザー(810 nm)照射後の非コラーゲン性基質タンパク質の発現象牙質・歯髄複合体にはさまざまな非コラーゲン性基質タンパク質が存在しており,硬組織形成や石灰化の開始・調節などに関与する21).中でも象牙質基質タンパク1(dentin matrix protein 1: DMP1)は象牙質基質中の主要な非コラーゲンタンパク質の一つであり29),間葉系幹細胞や前駆細胞の新生象牙芽細胞様細胞への分化の調節30),あるいは新生硬組織の石灰化誘導31)に関与する.また,オステオポンチンは象牙質,象牙前質に分布し,分子内のインテグリン結合部位を介した細胞・基質間接着を通じて細胞分化誘導に関与する32).直接覆髄後の被蓋硬組織形成過程でオステオポンチン33)やDMP134)が露髄部近傍の新生硬組織に局在すること,あるいは窩洞形成後の歯髄治癒過程で石灰化前線にオステオポンチンが沈着し,新生象牙芽細胞様細胞のI型コラーゲン形成に関与すること35)が示されており,これらの非コラーゲン性基質タンパク質がレーザー照射後の新生硬組織形成過程でも役割を演じることが想定される.
そこで上述の1.5 W群について,オステオポンチンおよびDMP1を対象として,歯冠歯髄におけるmRNA発現の経時変化をリアルタイムPCR法で定量解析するとともに,タンパク質の局在を免疫組織化学的に解析した20).
その結果,オステオポンチンのmRNA発現レベルは照射後3日をピークとする上昇を示し,3~7日後に対照(非照射歯)と比較して有意に高レベルであり,またDMP1のmRNA発現レベルは1~7日後に有意な上昇を示した20)(データ示さず).以上より,半導体レーザー照射後の歯髄では,傷害性変化からの修復過程の初期段階において,幹細胞や前駆細胞の活発な細胞分化に先立ちオステオポンチン,DMP1のmRNA発現が亢進することが明らかになった.
一方,オステオポンチン,DMP1のタンパク局在は,原生象牙質と新生硬組織との境界部で照射7日後より観察され(Fig.3c, d)21日後も明瞭であった(Fig.3g, h).同部は新生硬組織形成の起点として新生硬組織形成細胞の最終分化や新生硬組織の初期石灰化が生じる部位であるため,半導体レーザー照射後の歯髄における新生硬組織形成の初期段階において,オステオポンチンやDMP1が幹細胞や前駆細胞の最終分化や新生硬組織の石灰化の調節に役割を演じることが推察される.直接覆髄後においても,オステオポンチンとDMP1は露髄部直下,すなわち新生硬組織形成の起点に局在しており33,34),これらが共通の役割を演じることが推察される.
術後21日後(Fig.3e-l)においては,修復象牙質,反応象牙質が形成された例では原生象牙質との境界部近傍にオステオポンチン,DMP1陽性反応が観察されるとともに,DMP1陽性反応は新生硬組織内にも明瞭であった(Fig.3g, h).また骨様組織が形成された例では,DMP1陽性反応は新生硬組織内に広く認められたのに対して(Fig.3l),オステオポンチン陽性反応は新生硬組織の一部に限局して観察された(Fig.3k).すなわち,骨様組織はDMP1が瀰漫性に局在する点では骨36)および象牙質に共通しているが,オステオポンチンの局在は不均一であり,これについては形成時期や形成機構などの相違を反映している可能性があるものの詳細は明らかでない.いずれにしても,骨様象牙質が活発に形成される時期ではオステオポンチン,DMP1ともmRNA発現レベルは低下していたことから,これらの遺伝子発現の亢進は骨様象牙質形成には積極的に関与しないことが示唆された.
本稿で述べた著者らの所見は,GaAlAs半導体レーザー照射による傷害性変化を契機として作動した修復機転が,同レーザーの生活歯への照射による硬組織形成促進の主たる機序であるとの見解を支持している.従って,歯髄における硬組織形成を促進させるためには,レーザー光の作用で歯髄にいわば適度の刺激,すなわち可逆性かつ必要最低限の組織傷害を誘発させることが必要条件と思われる.0.5 W群の所見はこの条件にある程度合致しており,適切なレーザー照射条件により修復象牙質や反応象牙質を均質かつ再現性よく形成可能であることを示唆している.一方,1.5 W群の所見は出力が過大であった際の組織反応を反映したものと考えられるが,硬組織の損傷がみられなかったことから,細菌感染の影響を被ることなく組織修復が進行したと思われる.特徴的な所見として骨様組織の形成がみられたが,これらは多孔性かつ不均一な構造を呈しており,防御的役割は必ずしも十分でないと考えられる.
GaAlAs半導体レーザー照射後の傷害性変化の主因は同レーザーの熱作用と推定される.これに加えて,レーザー光の生物調節作用(photobiomodulation)により細胞分化や細胞機能の賦活化が生じ,修復過程のいずれかのステップに対して促進的に作用する可能性も考えられる.実際,培養歯髄細胞への半導体レーザー照射により細胞増殖や硬組織形成関連遺伝子の発現が亢進することが報告されており37,38),この種の機構の関与が推定されるが,今後の解析が必要である.
修復象牙質や反応象牙質の形成が,歯髄を覆う硬組織の厚みを増加させ歯の外部から歯髄に到達する刺激を減弱させる防御的役割を演じることは言うまでもない.加えて,修復象牙質と原生象牙質との間では象牙細管の連続性が乏しいことから,象牙質細管を経由した傷害性刺激の歯髄への到達を低減させる役割も演じると考えられる.本稿で述べた著者らの知見は,GaAlAs半導体レーザーの生活歯への照射により,硬組織を損傷させない(切削を伴わない)条件下でこの種の変化を人為的に誘導できる可能性を示唆しており,本レーザーの象牙質知覚過敏症への有効性の機序の一端を説明する可能性もあろう.いずれにしても,象牙質・歯髄複合体での新生硬組織形成を第一義的な目的としてレーザーを応用するためには,今後の硬組織形成機構の更なる解明と適切なレーザー照射条件の追究が不可欠である.
本研究にご協力頂いた新潟大学大学院医歯学総合研究科口腔健康科学講座う蝕学分野,同顎顔面再建学講座硬組織形態学分野の皆様に深く感謝申し上げます.
利益相反なし.