近年,農業技術や環境の急速な変化,人口増加などにより,遺伝資源の多様性が脅かされている.遺伝的な多様性保全は,貴重な資源を次の世代に伝えるための最も重要な課題のひとつである.したがって,遺伝資源を最適な条件下で長期にわたり維持・保管することが急務である.液体窒素を用いた超低温保存は,遺伝資源を維持する上で最も信頼性が高く,コスト効率とスペース効率が高く,安全な方法である.植物の茎頂分裂組織,菌糸体,胚,精子,精巣,卵巣および始原生殖細胞などの多様な生物材料に適用されているガラス化を基礎とした長期保存法について解説する.
生物の多様性は,環境破壊,人口増加,異常気象および農業技術の変遷など急速に進む生態系バランスの崩壊により滅失(遺伝的侵食)する危機にさらされている.このような状況下で,多様な遺伝資源の収集・保存は,新作物や新品種の開発,創薬研究において必要不可欠である(農業生物資源研究所 2010).農業・食品産業分野では食糧不足問題の解決が求められており,過酷な環境や変化する気候にも耐えて農業生産の継続を可能にする遺伝資源の保存・利用が強く求められる.また,高品質品種の育成や薬用に使われる動植物や微生物遺伝資源の保全は,経済的価値と人類の健康を守る意味で重要なミッションである.
世界の国々で遺伝資源銀行(Gene bank)を設立し,自国の農業,産業および医療に役立てるために膨大な数の保存事業が国策として実施されている.特に,米国のジーンバンク事業は大規模で植物遺伝資源だけでも種子を中心に 55 万点が長期保存されている.
遺伝資源には,種子のように比較的保存しやすいもの以外に,栄養体で保存するイモ類や果樹,微生物,動物なども含まれ,こうした遺伝資源の効率的な保存が未来の農業の鍵になると言っても過言ではない.現在,生物遺伝資源の長期保存法は,主として4つの方法がある(表1).本稿では,液体窒素を用いた超低温保存技術の開発研究とその保存方法について解説する.

ものの保存に関しては,通常,保存温度が低いほうが長持ちする.しかし,低温下で組織細胞内の水が凍結すると,細胞は氷結晶形成により致死的ダメージを受ける.それを避け,生存性を維持できる長期保存を可能にする唯一のメカニズムは,細胞内の水をガラス化させることである(Fahy et al. 1984).ガラスといえばシリカをはじめとする無機ガラスが有名であるが,「ガラス」とは材質名ではなく物理的な状態の名称で,原子が規則正しい配列の結晶構造がとれず,ランダムな原子配列のまま非結晶質(アモルファス)な固体化した状態を指す.有機物,金属もガラス状態にすることができる.ガラス状態では粘性が非常に高いため分子の拡散を伴うすべての化学反応が停止し,ガラス転移温度よりも低い温度で維持すれば結晶化は理論上完全に防ぐことができる.そのため,安定した状態で長期保存することが可能となる.ガラス状態への変化は狭い温度域で生じ,その温度はガラス転移点(Tg)で示される.低分子で Tg 以上の状態は過冷却液体,高分子の場合はラバー状態と呼ぶ.保存性の高い食品にはガラス状態のものが多く,ハードキャンディ(Hartel 1993)やかつお節(鈴木ら 1995),乾燥種子(Sakurai et al. 2008)はガラス状態であることがよく知られている.ガラス状態であるかどうかは,基本的にガラス転移が観測されることが前提である.
凍結保存法は,1980 年代に研究開発された手法で,緩慢凍結法(Slow freezing あるいは Controlled rate cooling)ともいい,細胞の外をあえて凍結させて細胞内の水を凍結脱水した後,液体窒素で冷却する保存法である.冷却する過程で表面が氷晶に覆われ凍結しているように見えることから凍結保存と呼ばれる.-30℃~-40℃あるいは-80℃まで冷却して十分に凍結脱水すると,細胞内溶液は濃縮され,その状態で液体窒素に移すと一部の細胞が部分的にガラス化することから部分的ガラス化と呼ばれる(図 1).農学分野(酒井 1987)や医学分野(阿曽,隅田 1983)では,動植物の細胞や組織の長期保存法に,超低温下での凍結保存法が活用されてきた.農業生物資源ジーンバンク事業(農研機構)でも,微生物と動物精子で,また,植物のうち,耐凍性の高いクワ(Yakuwa and Oka 1988,新野ら 1991,Niino et al. 1992),リンゴ(Sakai and Nishiyama 1978),ナシ(Oka et al. 1991,Suzuki et al. 1997)の冬芽で利用されている.プログラムフリーザー等を用いて,一定速度で冷却(0.1~1℃/min)し,凍結脱水するため,高額な機材が必要である(Reed and Uchendu 2008)
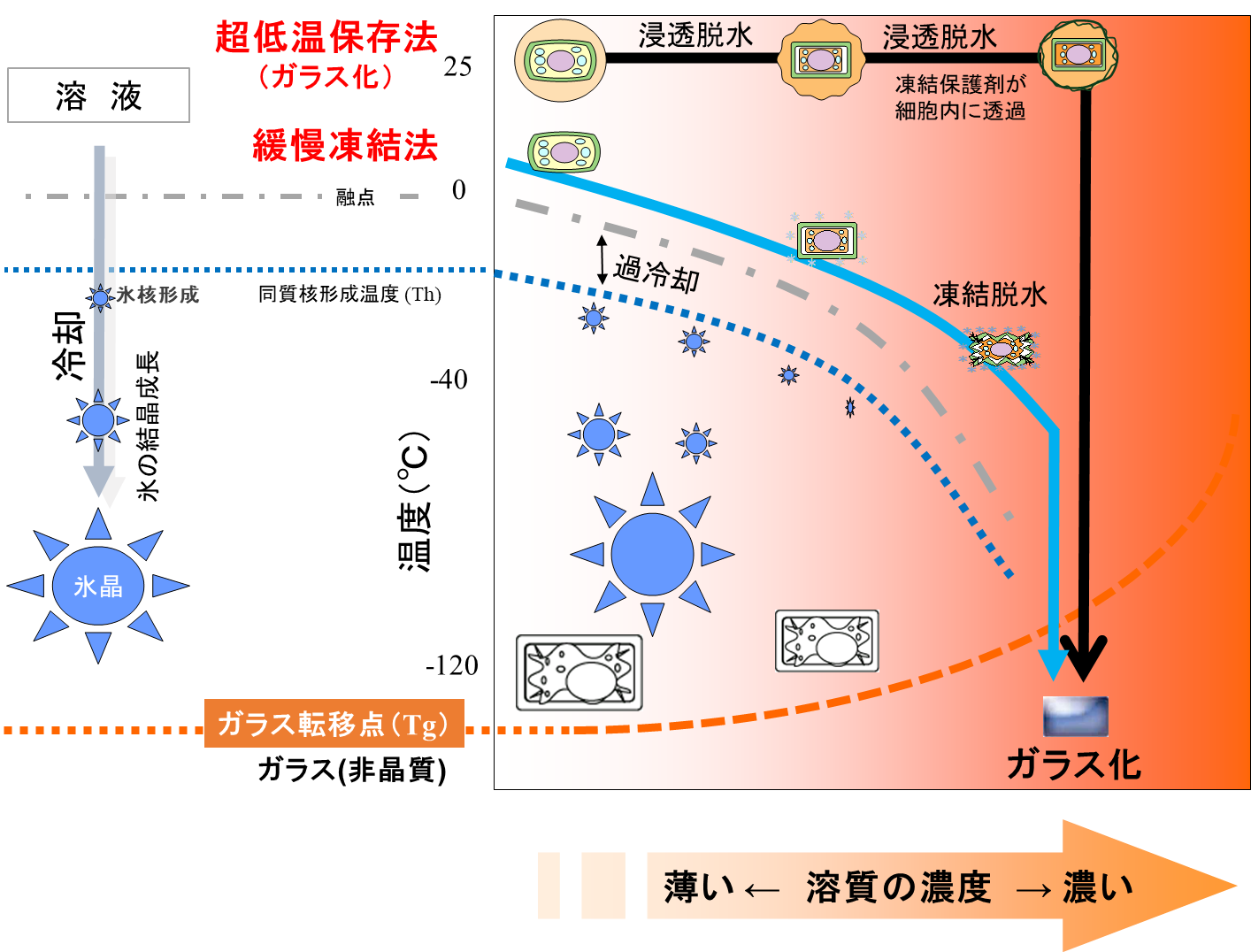
一方,1985 年に開発されたガラス化法(Rall and Fahy 1985)は,凍結保存と異なり凍結を伴わないため,超低温保存と呼ばれる.ガラス化液(浸透脱水剤)を用いて,数ミリ以下の生物材料(細胞)を浸透脱水し細胞内へも薬剤を浸透させた後,液体窒素で急速冷却してガラス化させる(図 1).この方法で保存を成功させる鍵は,(1)薬害の少ないガラス化液の開発,(2)脱水耐性が高い生育ステージの検討,(3)脱水耐性付与処理である(Tanaka 2018b).
凍結保存法の場合,細胞外の氷晶形成(凍結脱水)に伴う電解質水溶液の濃縮と細胞膜透過プロセスが生存率に大きく関係する.高濃度電解質に起因した浸透ストレスあるいは化学的なストレスにより細胞膜への傷害や脂質二重層の構造変化などが起こると,凍結損傷が引き起こされる(Mazur 1970, Gordon-Kamm and Steponkus 1984, Fujikawa 1995) .一方,ガラス化法では,液体窒素浸漬による急速冷却に対して細胞の浸透脱水収縮が不十分な場合,細胞内の水の過冷却度が増加し,致死的な細胞内凍結が起きるが,適切なガラス化液濃度と処理時間が判明していれば,凍結脱水中に起きる傷害がなく,最適化がしやすく操作性が良いなどのメリットが多い.
植物の一般種子(orthodox seed)や花粉は,ガラス状態になることで長期保存が可能となっている(Williams and Leopold 1989, Sun WQ and Leopold AC 1997, Buitink and Leprince 2008).1950 年に岩手県平泉の中尊寺金色堂に安置されている藤原氏 3 代の遺体(ミイラ)の学術調査をした際,首桶(1189 年頃)に納められていたハスの種子を 1993 年に蒔いた結果,804 年の時を経て発芽し,その後,開花した(長島 2001).種子は保存状態が良ければ数百年経過しても発芽する例である.しかし,種子も保存状態が悪ければ短期間でも発芽能力を失う.これは種子がガラス状態から脱ガラス化したことに起因する.脱ガラス化は,高温・吸湿によって引き起こされるため,Tg 以下の温度で低湿度の環境で保存することが重要である.そのため,世界中のジーンバンクで湿度 40%以下,温度 15~-20℃の条件下で種子を保存している.
農研機構遺伝資源研究センターでは,一般種子の保存用種子は含水率が 5~7%に達するまで相対湿度 10%,温度 20℃の乾燥室で 3~4 週間乾燥させる.その後,配布用種子は,プラスチックボトル(スクリューキャップ付)に移し,相対湿度 30%,温度-1℃の条件下で保存する.一方,長期保存用の種子は,真鍮の缶に脱気封入し,相対湿度 30%,温度−18℃の条件で保存する(知花ら 2016).椎名ら(2001)は,イネ,ダイズ,トウモロコシ,コムギおよびオオムギを供試して,配布用種子と長期保存用種子の寿命を調査したところ,保存容器によっては 25℃あるいは室温で 13 年間保存しても発芽率は高いまま維持された.一方で,周囲の湿度変化の影響を受けやすい紙袋で保存した種子は,1 年後に発芽率低下の兆しが表れ,5 年後には供試作物すべてが発芽力を失った.普通種子では,種子の乾燥条件が非常に重要である.
筆者らは,種子の超低温保存法開発のために,液体窒素タンクの気相部分(-150~-180℃)に保存した種子を用いて,発芽率調査を行った結果,供試したいずれの作物でも,液体窒素保存したものとしていないものの発芽率に差異は観察されなかった(Shirata et al. 2005).なお,低温と乾燥に弱い難貯蔵性種子(recalcitrant seed)とされる種の保存法(Walters et al. 2008)として,胚軸をガラス化法で処理してから液体窒素で保存し,再生させることが可能である(Normah and Makeen 2008).
ここまでは,超低温保存法に関する説明を行ってきた.ここからは,超低温保存法に関する筆者らの技術開発およびジーンバンク遺伝資源保存について述べる.
凍結保護物質の開発
緩慢凍結法とガラス化法のいずれでも,冷却過程で細胞が致死的な細胞内凍結を起こさないよう,凍結保護物質(凍結保護剤)で処理をする.凍結保護剤は,細胞膜透過型と細胞膜非透過型にわけられる.低分子の DMSO やグリセロールなどの,細胞内に透過することができる細胞膜透過型は,低温下でも水溶性が高く高濃度に濃縮することができる物質である.束一性により溶液の凝固点を下げ,さらに,氷晶形成を抑える働きがある.細胞膜非透過型である糖類や一部の高分子化合物は,細胞膜を透過できないので細胞膜を安定化させる作用がある.緩慢凍結法とガラス化法において,両性電解質高分子のカルボキシル化ポリリジンなどの物質を凍結保護剤として加えると,保存後の生存率が高くなることが報告されている(Matsumura et al. 2016, 2020).
ガラス化法は室温から急速にガラス化させるため,あらかじめ8M 近い高浸透圧のガラス化液で細胞を脱水する必要がある.一方で,緩慢凍結法では,あえて細胞外に氷晶を形成させて凍結脱水するため,凍結保護剤は,細胞外凍結による傷害から細胞を保護する効果もある.
Matsumura et al. (2020)はガラス状態を安定化させる効果が高い両性電解質高分子化合物を分子設計し,液体窒素および毒性のある DMSO を用いずに間葉系幹細胞のシートおよびスフェロイド(三次元的な細胞のコロニー)を高生存率でガラス化保存することに成功した.この機序に関しては,Matsumura et al. (2021)が,両性電解質高分子であるカルボキシル化ポリリジンがマトリックスを形成することで水や塩をトラップし,細胞外の氷核が細胞内に流入することと氷晶形成を抑制することで細胞の凍結保護を可能にすると報告している.
超低温保存用冷却・昇温デバイスの開発
一般的に,ガラス化法では急速冷却により細胞内凍結なしにガラス化させることが重要である.冷却速度を高めガラス化させる手段として,熱伝導率の良いガラス化保存用デバイスの開発が挙げられる.ヒトの卵子および胚などの医学分野では ABS 樹脂(Acrylonitrile Butadiene Styrene Resins)製デバイスのクライオトップ(Kuwayama and Kato 2000)が普及している.熱伝導率が高い素材として,金,銅,銀,アルミニウムが知られている.植物遺伝資源の超低温保存では,腐食しにくいアルミニウム製プレートが開発され(Sekizawa et al. 2011, Yamamoto et al. 2011a, Niino et al. 2013) ,様々な植物種の超低温保存で実績を上げている.畜産分野では,ブタ受精卵を,ヒトの血液透析で用いる中空糸に入れてガラス化保存し高い生存率を得ている (Matsunari et al. 2012) .さらに,ガラス化法における昇温(融解)過程では,冷却過程よりも細胞内凍結を起こしやすいが,Seki and Mazur(2012) は急速融解を用いることで高い生存率が得られること,また,ガラス化液の凍結保護剤成分濃度を半分以下に希釈しても,冷却過程では細胞内凍結は起こさずガラス化することを報告した.
デバイスの工夫によりガラス化法における冷却過程と昇温過程の温度変化速度を速め,超低温保存に成功している.結果的に超低温保存が困難といわれてきた生物種への応用が広がっている.
茎頂の緩慢凍結法は,生物種ごとに最適凍結脱水速度が異なる.また,耐凍性の低い材料では保存できない問題点がある.植物茎頂の凍結保存において,保存後の生存は確認されるが,カルス化し遺伝的変異を起こすことが報告されている(Haskins and Kartha 1980).
1980 年代に行われた緩慢凍結法では,保存した植物茎頂分裂組織の多くが致死的な傷害を受けており,生存した茎頂分裂組織以外の細胞がカルス化後,二次的にシュートを形成する可能性が示され,遺伝的な変異が起きず簡便で効率的な保存法の開発が急務であった.
1990 年に植物専用のガラス化液(PVS2)を開発(Sakai et al. 1990)して以降,日本は多くの植物種において,ガラス化法による超低温保存に成功した.また,茎頂をアルギン酸ゲルで保護したビーズガラス化法を開発し,リンドウやイチゴなどの遺伝資源(Niino et al. 2003; Tanaka et al. 2004, 2008)で実用化が進んだ.しかし,この方法も液体窒素保存後の生存率は比較的高いものの操作に熟練を要すること,脱水処理時間の最適範囲が狭いこと,大量に保存処理をすることが難しいことから,さらなる新技術の開発が求められた.そこで,液体窒素温度まで冷却した植物茎頂細胞の超微細構造を解析するために,アルミニウム製試料台に固定した,最適なガラス化処理条件で超低温保存した茎頂細胞を無水系凍結置換固定法と電子顕微鏡を組み合わせて解析した.その結果,茎頂細胞には氷晶形成が見られないことから,アルミニウム素材に固定された茎頂の細胞内は,超低温保存過程において氷晶形成することなく,ガラス化していると考えられた(Tanaka et al. 2018a, 2018b).これらの知見を元に,アルミニウム製プレート上の窪みにアルギン酸ゲルで茎頂等を固着させ,ガラス化液で浸透脱水する V cryo-plate法(Sekizawa et al. 2011, Yamamoto et al. 2011)および風乾脱水する D cryo-plate法(Niino et al. 2013)が開発された.この方法は,アルミニウム製プレートの移動によりすべての処理を行うため,操作に熟練を要さず,生存率も高いという特徴がある.植物種ごとに保存法を開発することは比較的容易で,この 2 つの cryo-plate 法による超低温保存法の最適処理条件の決定には,(1)脱水処理時間(ガラス化液処理 20分~50 分間あるいは風乾 30~120 分間)と(2)脱水耐性付与処理(ショ糖濃度 0.4 M~1.6 M+2.0 Mグリセロール溶液で30分間)の検討を行うだけで多くの植物種の保存法が確立可能となった.これまでに,ゼニゴケ(Tanaka et al. 2016),キク(田中ら 2016),イチゴ(Yamamoto et al. 2011b),イグサ(Niino et al. 2013),バレイショ(Arizaga et al. 2016),サトウキビ(Rafique et al. 2016),ラッキョウ(Tanaka et al. 2019),ポプラ(田中ら 2021)などで技術開発および品種試験を行い多様な植物遺伝資源に対応できることを実証した(Niino et al. 2019, Matsumoto et al. 2013).
超低温下では細胞の生理活性が停止するため,茎頂を安定的かつ長期的に保存でき,各国の生物遺伝資源バンクで超低温保存が使われている.ガラス化法で 10 年間超低温保存したワサビ遺伝資源の遺伝的変異を,化学的および分子生物学的手法を用いて解析した結果,長期(10 年間)保存しても変異等がほとんど起きないことが報告された(Matsumoto et al. 2013, Takimoto et al. 2019).
また,近年では,ネギ属(ニンニク,ワケギ,ラッキョウ)を上記2法で保存法を開発したところ,V cryo-plate 法は平均 97.1%,D cryo-plate 法では平均 94.0%の非常に高い生存率が得られた(田中ら 2020, Tanaka et al. 2021).また,ネギ属茎頂はガラス状態であれば安定的に保存が可能であり,D cryo-plate 法を用いて保存した場合,Tg は-40℃であるため,-80℃の冷凍庫でも 1~3 年 間では生存率の低下は認められなかった( Tanaka et al. 2021).
農業生物資源ジーンバンク事業における植物の超低温保存
穀物や乾燥に耐えられる一般種子は種子バンクで保存されるが,乾燥や長期保存に耐えられない種子や種子ができない,あるいは種子では品種としての特性を維持できない栄養繁殖性植物(果樹やイモなど)は,野外バンク(圃場保存)で維持されている.農業生物資源ジーンバンク事業では,植物遺伝資源を 23 万 6 千点保存しているが,このうち,約 20 万 6 千点は種子バンクで,約 2 万 9 千点の遺伝資源(果樹類,根茎類等)が野外ジーンバンクで栄養繁殖により維持されている(2022 年 11 月時点).これらの栄養繁殖性植物遺伝資源を滅失させないために,二重保存体制構築に向けた取り組みが行われている.耐凍性の高いクワやリンゴの冬芽では,緩慢凍結保存が利用されてきた(Yakuwa and Oka 1988,新野ら 1991,Niino et al. 1992, Sakai and Nishiyama 1978).農業生物資源ジーンバンク事業では,約 1,300 点のクワを気相型の液体窒素タンクで凍結保存している.
現在は,これまで毎年栽培を繰り返してきたバレイショ遺伝資源の超低温保存事業を進めている.なお,無菌培養で増殖させた茎頂の超低温保存実績は,バレイショ約 700 点,イグサ 182 点,イチゴ 63 点,ハッカ 29 点,サトウキビ 17 点,ナシ 89 点,モモ 78 点,その他多数を液相型の液体窒素タンクで保存している(2022 年 10 月時点).一方,国際的には超低温保存が盛んに利用されており,例えば,ドイツのライプニッツ植物遺伝作物学研究所(IPK)ではバレイショ 1,500 点以上が液体窒素で保存されている.
これまでに開発した手法をもとに,今後も,対象を拡大していく予定である.
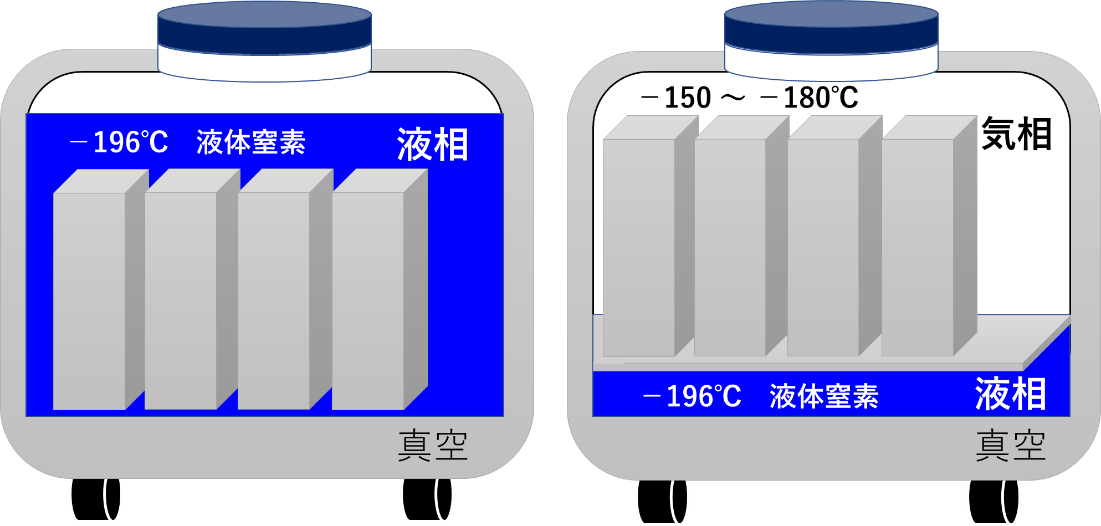
微生物では世代時間が短いため,継代培養法では,胞子形成能や物質産生能の低下など培養による性質の変化が起こる.また,コンタミネーションのリスクが高まることが懸念される.長期保存には,緩慢凍結法,凍結乾燥法および乾燥法が有効である.緩慢凍結法では,細菌類と胞子を形成しない真菌類の多くを安全に保存できる.しかし,胞子を形成しない菌類では保存する際の処理条件が保存成績すなわち生存率に大きな影響を与える(中川 2012) .一般的には,プログラムフリーザーを用いて試料ごとに最適冷却速度を検討する緩慢凍結法で保存事業が行われている.凍結保護物質としてはグリセロール,DMSO あるいはトレハロースが用いられる.また,超低温下で保管中に生物遺伝資源(試料)のクロスコンタミネーションがおきることを防ぐために,液相型液体窒素タンクではなく気相型液体窒素タンク(図 2)を用いて維持する(-150℃~-180℃).
一般的に菌株の大半は,凍結保存と乾燥保存により長期保存されている(根井 1977,日本土壌微生物学会 2013).日本微生物資源学会が毎年取りまとめている事業報告(保有株数)によれば,2020 年度保有株数(日本微生物資源学会誌 2022)は,製品評価技術基盤機構バイオテクノロジーセンター 193,631 点が最多で,次いで,群馬大学医学部薬剤耐性菌実験施設 81,322 点,国立遺伝学研究所遺伝形質研究系微生物機能研究室 65,562 点,農研機構遺伝資源研究センター 37,248 点,理化学研究所バイオリソース研究センター微生物材料開発室 30,650 点と続く.24 の関係機関が保有する登録菌株の合計は 565,812 点である.
農研機構では最近,難貯蔵性菌類のひとつである卵菌の新規超低温保存法を開発した.クロミスタ界に属する卵菌類は,緩慢凍結法を用いた凍結保存が困難な微生物のひとつとされ,農業生物資源ジーンバンク事業として 1,000 点を超える系統を保存するには,安定した長期保存技術の開発が求められてきた.従来の保存法と異なる超低温保存法の開発を目指して,卵菌類と同様に細胞壁を持つ植物遺伝資源のドロップレット・ガラス化保存技術(Tanaka et al. 2011)を応用し,実践的な技術開発に取り組み成功した(Uzuhashi et al. 2020).卵菌類の細胞は多核嚢状体で,菌糸の太さは直径 10 µm以上になるものもあるが隔壁がほとんどないため,ひとつのコロニーが多核嚢状体の1細胞で作られる場合もある.したがって,緩慢凍結法では細胞内が十分脱水されずに冷却過程において致死的な細胞内凍結(氷晶形成にともなう物理的破壊)が起きていることが考えられた.そのため,ガラス化液を用いて細胞内水分を浸透脱水し,同時に凍結保護剤を細胞内に浸透させ,液体窒素で急速冷却し細胞を完全ガラス化させた.したがって,太く長い細胞でも細胞内凍結の発生を回避し,高い生存率が得られたと考えられる.今後,同手法は,他の難保存性微生物の管理・系統保存技術の開発にも寄与するものと期待される.
動物の細胞,精子,卵子,受精卵等の長期保存は,緩慢凍結法または超低温保存法によって行われている.大きな組織や器官の超低温保存は依然として困難である.一般的に確立されていると思われている動物精子の保存でさえ,保存技術が確立されていない種は多い.一例として,ニホンザルの精子も保存技術が確立されていない.
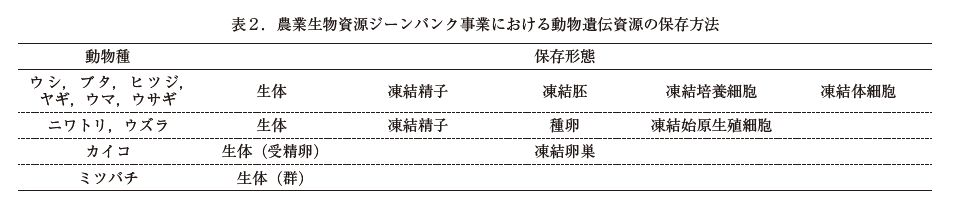
農業生物資源ジーンバンク事業では,表 2 の生物種等について生体を中心に保存している.凍結保存では家畜や家禽精子を中心に約 11 万本の凍結精子封入ストローを保存している.動物(家畜・家禽)遺伝資源は,絶滅が危惧されるために貴重な資源である.近年,家畜伝染病蔓延防止のために発症地区の全頭殺処分の実施が行われている.したがって,二重保存体制を構築するためには飼養地域から隔離された場所での液体窒素保存が強く望まれている.
近年,発生生物学の進展に伴い始原生殖細胞の研究やES細胞,人工多能性幹細胞の樹立により,保存が困難であった遺伝資源についても超低温保存による長期保存の可能性が広がりつつある.
ニワトリ始原生殖細胞の凍結保存
鳥類や魚類の遺伝資源保存分野では,精子の緩慢凍結保存が行われてきた(農業生物資源研究所 1994,Lahnsteiner 2000).一方,卵子は,他の動物細胞と比較して体積が大きく,大量の卵黄を含むため,卵子や受精卵の凍結保存が困難である.雌側の遺伝資源保存ができないということは,集団の再生(復元)を完全に行うことはできないことになる.
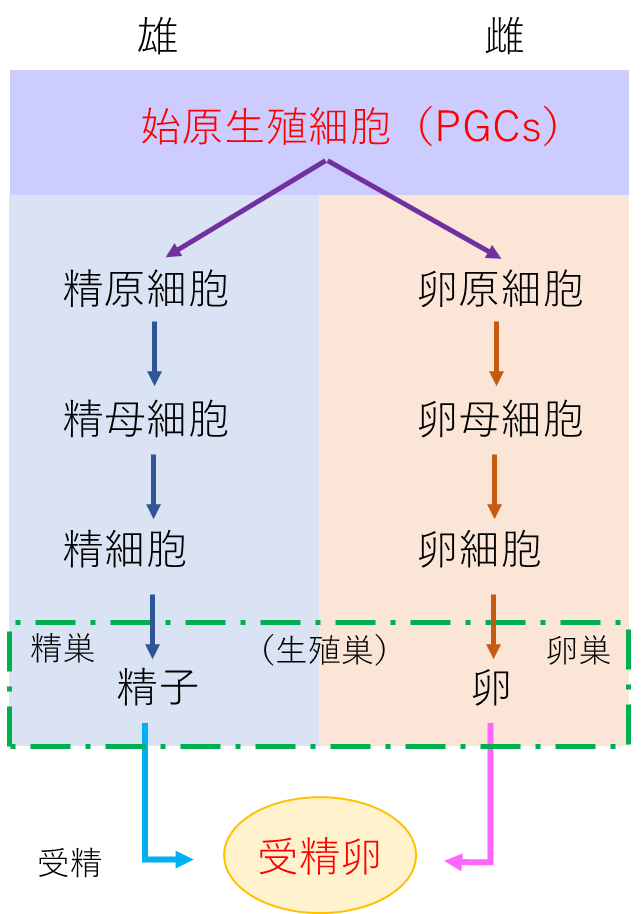
この問題を解決するべくSetioko et al. (2007)はニワトリを用いて精子や卵子の起源となる始原生殖細胞(Primordial Germ Cells ; PGCs)の凍結保存法を開発した.鳥類は胚体外に始原生殖細胞が出現し,胚の血中を循環して生殖巣へと辿り着く.したがって,始原生殖細胞をドナーの血中から採取して凍結保存し,個体再生する際は保存した始原生殖細胞を宿主胚に移植し復元する.この技術は農業生物資源ジーンバンク事業で実用化され,ニワトリ 15 点とウズラ 3 点の保存実績がある.また,始原生殖細胞を用いた魚類遺伝資源の凍結保存法を東京海洋大学の吉崎らのグループが報告している(Lee et al. 2013).液体窒素で保存した始原生殖細胞を不妊化処理したレシピエントの魚に移植すると,卵にも精子にも分化する.そのため,絶滅危惧種の魚類に応用することが期待されている.
ショウジョウバエ始原生殖細胞の超低温保存
遺伝学の研究においては,ライフサイクルが短く,明確な形質を示すモデル生物種が重要なツールとなる.ショウジョウバエは,ヒト疾病モデルや遺伝子解析に利用され,大きな役割を果たしている.16 万種類を超える系統を維持するには,莫大な労力とコストを要する.昆虫個体の凍結保存は困難であることから,筆者らは生殖細胞に焦点を定めて超低温保存技術の開発を行った結果,卵や精子の元となる始原生殖細胞が超低温保存に最適であることを突き止めた(図 3).保存したい系統の胚から始原生殖細胞を,ガラスキャピラリー針を用いて採取し,採取後ただちに最適ガラス化処理を施すと超低温条件下で安定的に保存できる.
個体の再生にあたっては,始原生殖細胞を作ることができない不妊系統の胚に,保存系統から取り出した融解後の始原生殖細胞を移植すると,正常な卵や精子に分化する.この始原生殖細胞が移植された雄と雌を交配させることにより,元の系統と全く同じ遺伝子セットを持つ個体を得ることに成功した(Asaoka et al. 2021,小林ら 2021).個体の性質に左右されない世界初のショウジョウバエ保存技術である.本成果は,ショウジョウバエを保存する京都工芸繊維大学ショウジョウバエ遺伝資源センターに技術移転され,国際的に貴重な生物遺伝資源の安定的な保存に貢献している(Takano-Shimizu et al. 2022).
カイコ生殖巣の超低温保存
カイコは日本が世界一のコレクションを持つ遺伝資源であり,モデル生物である.農業生物資源ジーンバンク事業の動物遺伝資源の中で最も活用されているものである.現在 662 点が生体保存されており,毎年,飼育によって更新されている.
カイコ遺伝資源の長期保存には,緩慢凍結法による卵巣と精子の凍結保存が報告されている(図 3).しかし,凍結精子を利用した人工授精は,半数の系統において受精率が低く,未だ試行錯誤な状況である.
雌側の凍結保存は,ドナー幼虫から卵巣を摘出し,凍結保護剤とともに-80℃フリーザーで緩慢凍結(凍結脱水)を行い,液体窒素中で長期保存する.凍結卵巣は昇温後,別の雌幼虫(卵巣除去したレシピエント)に外科的手術により移植する.一方,精巣はこれまで実用的な凍結保存が見いだせず,凍結に対する耐性が低いことが原因と推測するにとどまっていた.そこで,ガラス化法を用いたカイコ精巣の超低温保存法の開発を行った.
Fukumori et al.(2022)は,精巣のガラス化処理を行うにあたり,植物の超低温保存法(前出の cryo-plate法)をベースにカイコ精巣に応用した手法を開発した.雄幼虫から精巣を摘出し,アルミニウム製プレートの表面にアルギン酸ゲルで固着させ,ガラス化液処理を行い,アルミニウム製プレートごと液体窒素に直接浸漬し急速冷却する.この方法で処理した精巣を急速融解させ別の雄幼虫(精巣除去したレシピエント)に移植して成虫まで飼育したところ,受精能力を有する精巣移植個体を確認することができた.精巣の状態を観察した結果,ガラス化処理による精巣への物理的なダメージはほとんど確認されないことから,超低温保存した精巣の保存状況は良好であると判断された.以上のことから,カイコの卵巣および精巣をそれぞれ最適な保存法で超低温保存し,必要時に保存生殖巣を融解し,レシピエント幼虫に移植して飼育し,成虫(蛾)の雄と雌を交尾させ次世代を得ることで系統復元するシステムを構築しつつある.将来的には昆虫多様性保護を可能にする汎用性の高い昆虫雌雄生殖質保全法の確立も可能である.
次世代シーケンサーやゲノム編集技術,特に CRISPR/Cas9 の登場により,生命科学分野では非モデル生物の研究が飛躍的に進展し,組換え体の生物遺伝資源数が爆発的に増加している.医療・創薬研究における昆虫の役割も重要となってきており,カイコによる組換え蛋白質の大量生産はワクチンをはじめとする医薬品製造に多大な貢献を果たすと期待されている.ゲノム編集技術等の開発により農研機構内だけでも年間約 150 点ずつ増加している(伴野 2018).この結果,超低温による長期保存技術の開発および技術普及がかつてないほど求められている(Tanaka et al. 2016).超低温保存技術は,一度作成した生物資源をいつでも利用可能な状態で保存し,融解後すぐに利用できる技術である.農業生物資源ジーンバンク事業と並行して,戦略的生物資源の保管システムを開発し社会実装することは,社会的にも重要な基盤技術開発である.
また,生物資源を用いている研究者が次々と退職を迎えるにあたり,栽培や飼育を伴う維持・管理が難しくなっている.生命科学の発展や農業振興を考えれば当然生物資源を持ち続けるべきだが,予算もマンパワーも不足し,自然消滅に近い形で多くの資源が全国的に失われる可能性が高い.多少でも余力のあるうちに遺伝資源のバックアップ保存体制を整えることを提案する.
すべての著者は開示すべき利益相反はない.